混菌静态发酵改善双低菜籽粕品质
2020-06-03郝怡宁王志高何荣鞠兴荣袁建
郝怡宁,王志高,何荣,鞠兴荣,袁建
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏省粮油质量安全控制及深加工重点实验室,南京 210023)
0 引言
【研究意义】菜籽粕(rapeseed meal,RSM)作为菜籽油的副产物,年产量超过4 000万t,在蛋白质饼粕的产量中仅次于豆粕(Soybean meal,SBM),排名第二位[1]。我国是农业大国,油菜籽的产量居世界第一,菜籽粕的年产量已超过1 000万t[2]。菜籽粕是一种重要的蛋白质资源,由于其富含粗蛋白、蛋氨酸、赖氨酸等营养成分,具有很高的潜在营养价值,所以其发展潜力巨大。但是菜籽粕中存在一些抗营养因子,如硫代葡萄糖苷、粗纤维、植酸等,特别是高水平的硫代葡萄糖苷,会降低适口性,导致生长迟缓、甲状腺肿大和器官组织受损[3];此外,这些抗营养因子可以使消化酶失活,降低高活性肽的释放速率,从而降低营养利用率。因此,过去的很多研究都侧重于去除抗营养因子,而忽略了营养因子的增加[4-5]。随着双低菜籽粕的出现,提高菜籽粕的综合品质,改善菜籽粕的营养结构就显得尤为重要。挥发性风味物质及呈味物质组成是评价农产品特别是饲用经济作物品质的重要指标之一。采用电子鼻和电子舌快速检测菜籽粕发酵过程中风味变化的综合信息,对提高菜籽粕品质具有重要的意义。在目前我国蛋白资源紧缺的情况下,改善菜籽粕品质,提高菜籽粕的利用率,可推动我国畜牧和食品工业的发展,并带来显著的经济和社会效益。【前人研究进展】为了降低成本,缓解资源短缺的现状,许多研究人员一直在急于寻找其他的蛋白来源来降低豆粕的使用[6]。酶解法已经被用来提高菜籽粕的营养价值,主要是增加小肽含量,但是酶解效率低,并且成本较高。微生物发酵被认为是一种去除抗营养因子,同时提高营养价值的替代方案。前人的研究表明,微生物发酵可以增加菜籽粕中小肽含量[7],提高适口性,从而提高营养利用率,但不同菌种的发酵效果不同。顾斌等[8]研究发现,枯草芽孢杆菌和白地霉混菌发酵可以提高菜籽粕中蛋白的效价,降低抗营养物质。小鼠试验表明,在饲粮中添加一定比例的发酵菜籽粕虽然能够促进小鼠生长,但是长期食用会对小鼠的肝脏和肾脏造成轻度损伤。WANG等[2]利用乳酸菌发酵菜籽粕产生乳酸促进酸味,通过蛋白质变性来降低咀嚼性,从而提高适口性,增加消费者的接受度。【本研究切入点】过去为了提高菜籽粕的利用率,微生物发酵的研究多集中于菜籽粕脱毒上,而忽略了提高和改善菜籽粕的综合品质,造成了资源浪费。气味和滋味是评价发酵菜籽粕综合品质的重要指标之一,但微生物发酵对菜籽粕风味物质及呈味物质影响的研究未见报道。通过静态发酵代替搅拌式发酵,降低大规模发酵的生产成本。【拟解决的关键问题】采用混菌静态发酵工艺,在降低抗营养物质的基础上丰富菜籽粕的营养价值,改善菜籽粕的营养结构。利用电子鼻和电子舌等综合分析技术,研究发酵前后以及发酵过程中菜籽粕气味与滋味的变化,并通过体内试验验证发酵菜籽粕的生物可利用性,全面探讨静态发酵工艺对菜籽粕品质特性的影响,为菜籽粕的广泛利用和深度开发提供理论依据。
1 材料与方法
试验于 2018年在南京财经大学食品科学与工程学院国家重点实验室进行。动物试验于2019年1月在南京申基生物有限公司进行。
1.1 材料与试剂
枯草芽孢杆菌Bacillus subtilis20030、雅致放射毛霉Actinomucor elegans40252,中国工业微生物菌种保藏中心。
1.1.1 主要原料 甘蓝型双低菜籽粕,粉碎后过 60目筛备用。
1.1.2 主要试剂 细胞色素C、抑肽酶、杆菌肽、还原型谷胱甘肽、甘氨酸、甲醇(色谱纯)、川芎嗪标品,上海源叶生物科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
Agilent 1260高效液相色谱仪,美国Agilent公司;高速冷冻离心机,Thermo Fisher公司;恒温培养震荡器,上海智城分析仪制造有限公司;味觉分析仪--ASTREE电子舌、α-FOX3000电子鼻,法国 Alpha MOS公司。
1.3 试验方法
1.3.1 静态发酵 发酵之前混合物组成为:190 g菜籽粕和10 g麦麸混合,加入270 mL蒸馏水(包含0.5%的葡萄糖和0.36% KH2PO4)。将混合物在120℃条件下灭菌20 min,在超净台内冷却后接种枯草芽孢杆菌和雅致放射毛霉,接种比例为4∶1,搅拌均匀后在32℃下静置5 d,每隔1 d取样。取出菜籽粕样品在50℃下烘干,时间为36 h。将烘干后的菜籽粕磨成粉,过60目筛,保存在4℃条件下备用。
1.3.2 菜籽粕(抗)营养物质的测定 硫甙:氯化钯法[9];粗纤维:酸碱消煮法,GB/T6434—2006;植酸:三氯化铁比色法[10];粗蛋白、水溶性蛋白:NYT 1205—2006;多肽:参考鲁伟等[11]的方法。
1.3.3 氨基酸的测定 准确称取一定量样品于水解管中,在减压条件下加6 mol·L-1盐酸,密封后在110℃高温下水解24 h,将水解液过滤后旋蒸除去盐酸至干,用 0.02 mol·L-1的盐酸定容至 50 mL,稀释两倍后经0.22 μm滤膜过滤,上氨基酸自动分析仪检测。
1.3.4 多肽分子量分布的测定 TSKgel G2000SWXL色谱条件参考谷中华等[12]的方法。分子量标品为细胞色素C(MW 12327 D)、抑肽酶(MW 6511.51 D)、杆菌肽(MW 1422.69 D)、还原型谷胱甘肽(MW 307.32 D)、甘氨酸(MW 75.067 D)
1.3.5 川芎嗪的检测
1.3.5.1 色谱条件 参考兰顺[13]的方法,并稍作修改。色谱柱:Hypersil C18(250 mm×4.6 mm,5 μm);流动相:甲醇:超纯水(50∶50 V/V);流速:0.7 mL·min-1,检测波长:282 nm;柱温:室温。
1.3.5.2 制备标准曲线 精确称取 TTMP标品于适当体积的甲醇中,制备浓度为20 μg·mL-1的母液。取标准品母液稀释,用0.45 μm微孔滤膜过滤,分别制成浓度为 1.0、2.0、4.0、8.0、12.0 和 16.0 μg·mL-1的溶液。
1.3.5.3 样品溶液的配制 以甲醇为溶剂,料液比1∶40,超声提取30 min,4 500 r/min离心10 min,取上清液用0.45 μm微孔滤膜过滤,即得样品溶液。
1.3.6 电子鼻感官评价 精确称取 2.00 g菜籽粕样品放置于20 mL顶空瓶内,样品测量流速为150 mL·min-1,检测时间为120 s。该电子鼻装有12个不同的气体传感器:LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL、LY2/gCT、T30/1、P10/1、P10/2、P40/1、T70/2和PA/2,通过传感器阵列响应和模式识别技术对挥发性气体分子进行分析。
1.3.7 电子舌感官评价 准确取2.00 g待测样品,加入蒸馏水后摇匀,定容后倒入测量杯进行检测。本试验所用的Astree电子舌系统配置了AHS、PKS、CTS、NMS、CPS、ANS和SCS 7根传感器,其中AHS、CTS、NMS、ANS和SCS为5根专一性传感器,分别对酸、咸、鲜、甜和苦具有专一响应。测定时每个样品的数据采集时间为120 s,记录第120 s时传感器的响应值,用于后续分析。
1.3.8 动物试验 按体重将 Spargue-Dawlcy大鼠分为空白豆粕组(SBM组)和试验菜籽粕组(FRSM组,发酵菜籽粕等氮代替基础饲粮25%的豆粕),每组6只,两组大鼠初始平均体重分别为53.9和54.6 g。试验周期为42 d,每隔7 d称重测定平均日增重和平均日采食量。参考汤震等[14]的方法,取肾脏、肝脏胸腺和脾脏,对胸腺和脾脏分别称重,测定大鼠免疫器官指数。对大鼠肾脏、肝脏和胸腺进行病理切片,HE染色后,显微镜下观察并拍照。
1.4 数据处理
每组试验重复3次,所得结果以平均值形式表示。采用Origin 8.5绘图,应用SPSS统计软件分析试验数据,采用单因素方差分析评价两组间差异的显著性(P<0.05)。
2 结果
2.1 混菌静态发酵对双低菜籽粕营养成分的影响
2.1.1 对硫甙葡萄糖苷、粗纤维、植酸与蛋白的影响 由图1-A可知,随着发酵时间的延长,硫甙葡萄糖苷、粗纤维和植酸的含量逐渐降低。硫代葡萄糖苷的含量由 20.37 μmol·g-1降至 11.15 μmol·g-1,降解率达 45.26%。粗纤维和植酸的降解率分别为31.16%和41.37%。由图1-B可知,粗蛋白、水溶性蛋白和多肽的含量均在发酵后期有显著增长。发酵后菜籽粕中水溶性蛋白的含量由 10.3%显著增加到20.26%,多肽含量由2.7%增加到10.3%,增加率高达281.48%。
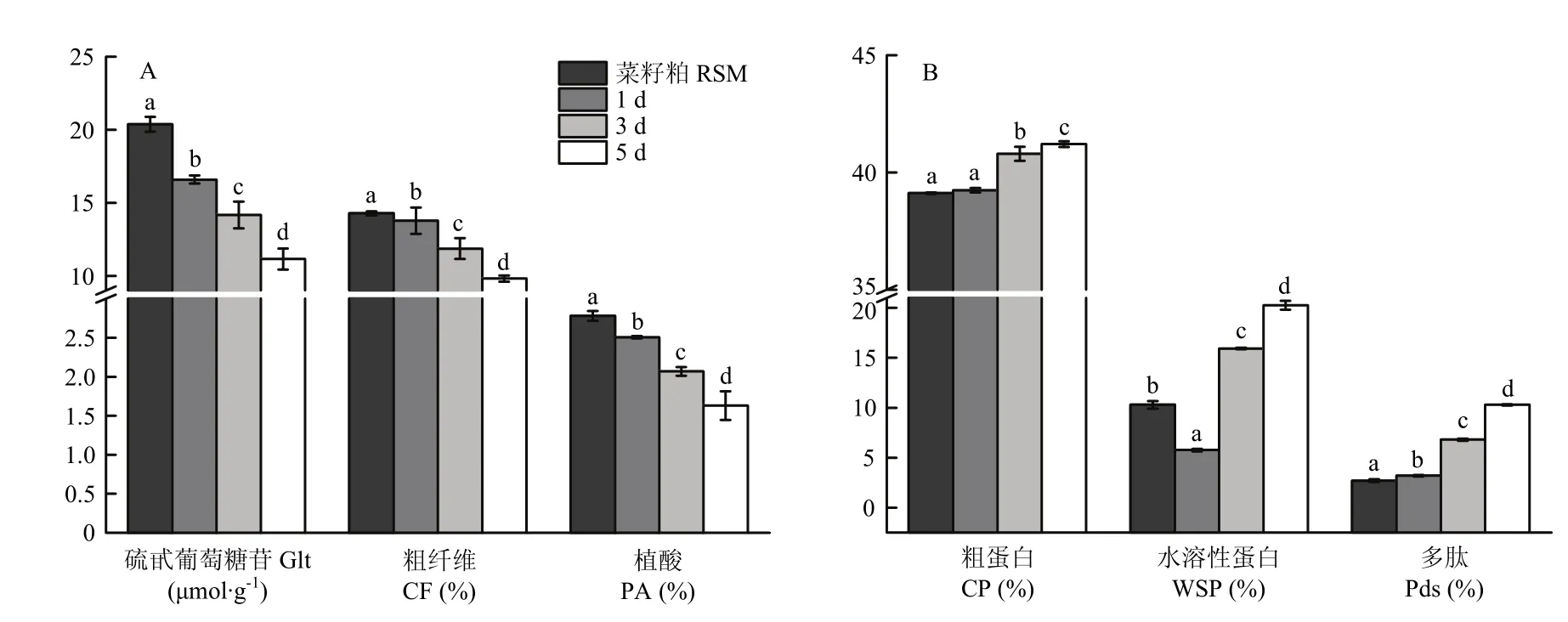
图1 静态发酵对菜籽粕中抗营养物质(A)和营养物质(B)的影响Fig. 1 Effect of static fermentation on antinutrients (A) and nutrients (B) in rapeseed meal
2.1.2 对多肽分子量分布的影响 如图2所示,未发酵菜籽粕中主要含有高分子量的蛋白质,经过微生物发酵,蛋白质被水解成氨基酸和分子量在180—7 000 Da的多肽。发酵第3天,1 586 Da之前的峰值已经不存在,当发酵第5天时,大部分菜籽多肽被降解为分子量在500—108 Da的小分子肽。
2.1.3 对氨基酸组成的影响 发酵前后氨基酸总量和组成发生了显著性变化(表 1),但发酵第 3天与发酵第5天的菜籽粕氨基酸总量无明显变化。发酵5 d后,菜籽粕中氨基酸总量增加了19.58%,必须氨基酸总量增加了25.30%。半胱氨酸和苯丙氨酸的增幅较大,分别为96.88%和74.55%,赖氨酸、苏氨酸、精氨酸的增幅较低,分别为13.25%、14.39%和7.78%。
2.1.4 对川芎嗪含量的影响 由图3可知,在菜籽粕中并未发现川芎嗪,发酵1 d后川芎嗪以一种新的物质出现,并随着发酵时间的延长,川芎嗪的含量迅速增加,在发酵第5天达到590 mg·kg-1。
2.2 混菌静态发酵对双低菜籽气味的影响
由于挥发性化合物的任何轻微变化都会引起电子鼻传感器响应的差异[15],因此,电子鼻技术已被广泛应用于食品研究[16]。在本研究中,利用配备 12个传感器的电子鼻获得菜籽粕的综合风味图谱。每个传感器的响应幅度取决于气味分子的组成和浓度[15]。用电子鼻分析菜籽粕和发酵1、3、5 d后的菜籽粕样品,由图4可知,4个样品的指纹图谱均存在显著差异。图 4-A 显示,传感器ly2/lg、pa/2、t70/2、p40/1、p10/2、p10/1、t30/1对4个样品的响应值均大于零,并且随着发酵时间的延长而增加。相反,除了传感器LY2/gCT外,其他传感器(LY2/G、LY2/AA、LY2/GH、LY2/gCTL)的响应是负的,并且随着发酵时间的增加而降低。结果表明,生RSM和5 d样品的挥发性成分在发酵过程中差异最大。这些差异可能是由于一些挥发性化合物的出现或消失以及相似挥发性化合物浓度的变化所造成[17]。雷达指纹图谱显示,发酵3 d和5 d后的菜籽粕香气分布比其他分布更接近,说明它们的气味相似性很高。
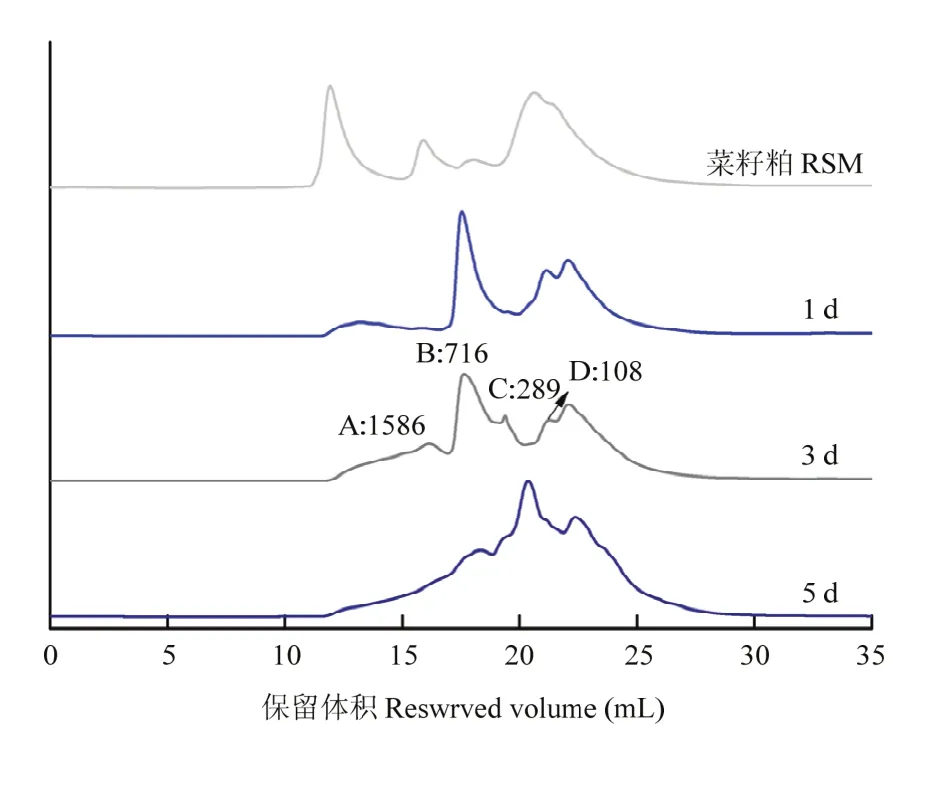
图2 菜籽粕发酵过程中菜籽肽分子量分布Fig. 2 Molecular weight distribution of peptides in rapeseed meal during fermentation
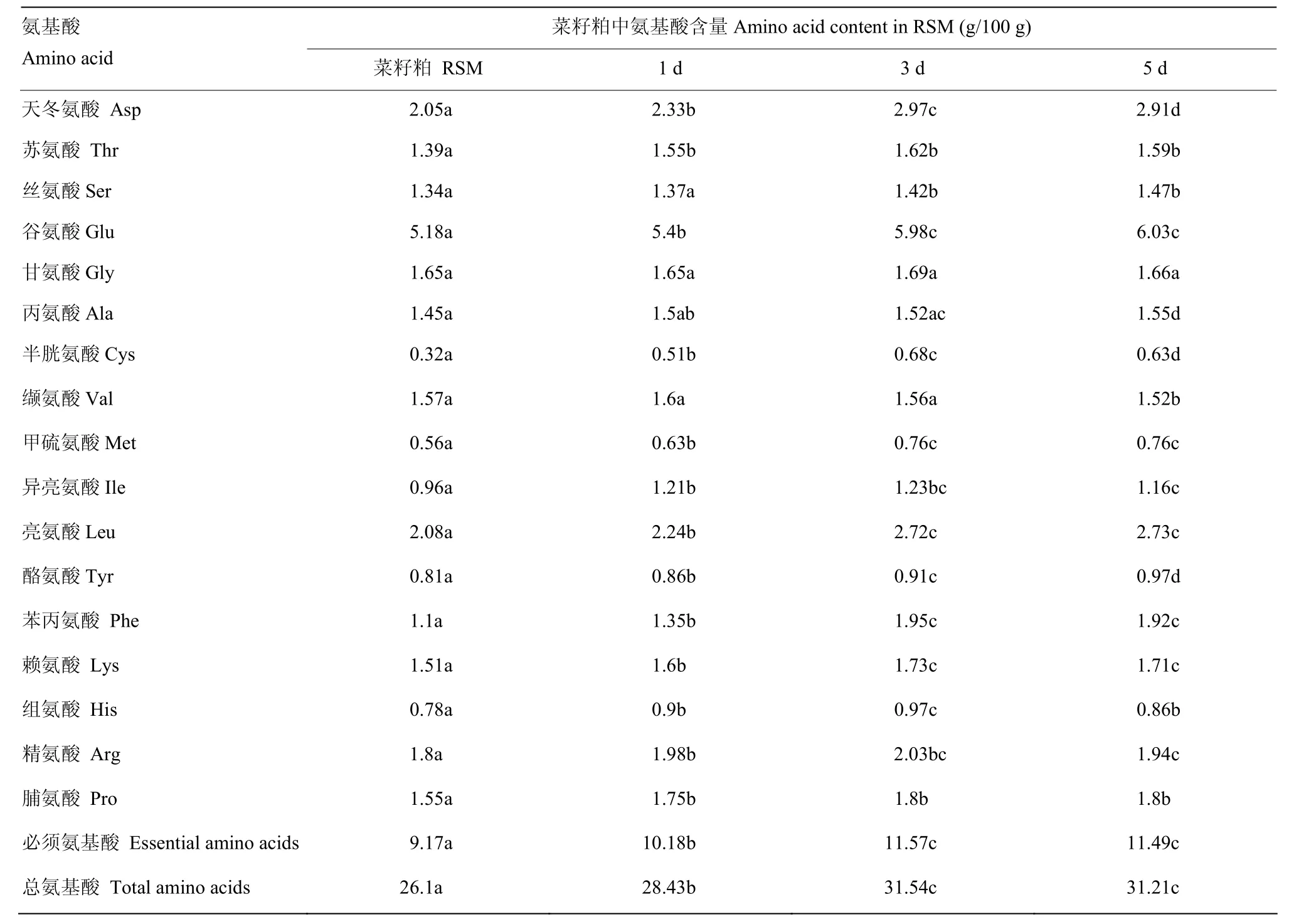
表1 发酵菜籽粕中氨基酸的种类和含量Table 1 Types and contents of amino acids in rapeseed meal and fermented rapeseed meal
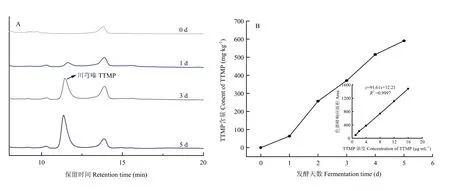
图3 菜籽粕粕中川芎嗪的色谱图(A)、川芎嗪在发酵过程中含量的变化(B)Fig. 3 Chromatographic charts of tetramethylpyrazine in rapeseed meal (A), changes of tetramethylpyrazine content during fermentation (B)
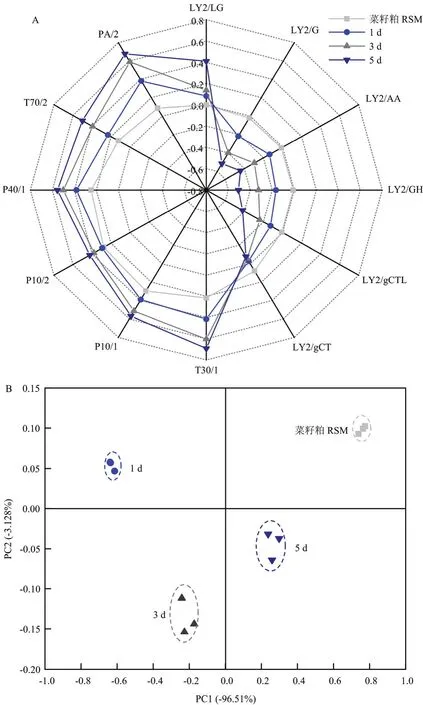
图4 不同发酵时间菜籽粕样品的电子鼻的雷达图(A)和PCA图(B)Fig. 4 Radar fingerprint chart (A) and PCA (B) of electronic nose data for rapeseed meal at different fermentation times
图4-B显示菜籽粕和发酵菜籽粕的主要成分1和2的贡献率分别为96.51%和3.128%。总方差贡献率为99.638%(95%以上),表明该方法有效,反映了样品提供的总体信息,因此在一定意义上可以代表样品挥发性风味物质的主要特征[18]。PCA结果表明,RSM的挥发性化合物位于第一象限,但其他发酵样品位于不同的区域。这说明RSM与FRSM的挥发性物质存在显著差异。发酵1 d的样品挥发性组分位于第二象限,远离发酵3 d和5 d的样品,表明发酵前期对挥发性风味物质有显著的影响。样品3 d组和5 d组虽然位于不同的象限内,但它们之间的距离较近,说明发酵3 d后挥发性成分的含量和组成趋于稳定。以上结果表明,在电子鼻数据上使用PCA可以区分RSM和FRSM以及不同发酵时间的FRSM。
2.3 混菌静态发酵对双低菜籽粕滋味的影响
由图5-A可知,AHS、SCS、ANS和NMS 4种传感器对4种样品具有较好的响应。其中AHS和SCS的响应值在发酵前后发生了明显变化,随着发酵时间的延长,响应值逐渐增大。虽然ANS和NMS的响应值较高,但在发酵前后无明显变化。说明菜籽粕本身就含有一定浓度的糖类、氨基酸、核苷酸和有机酸等甜味和鲜味贡献物[19]。
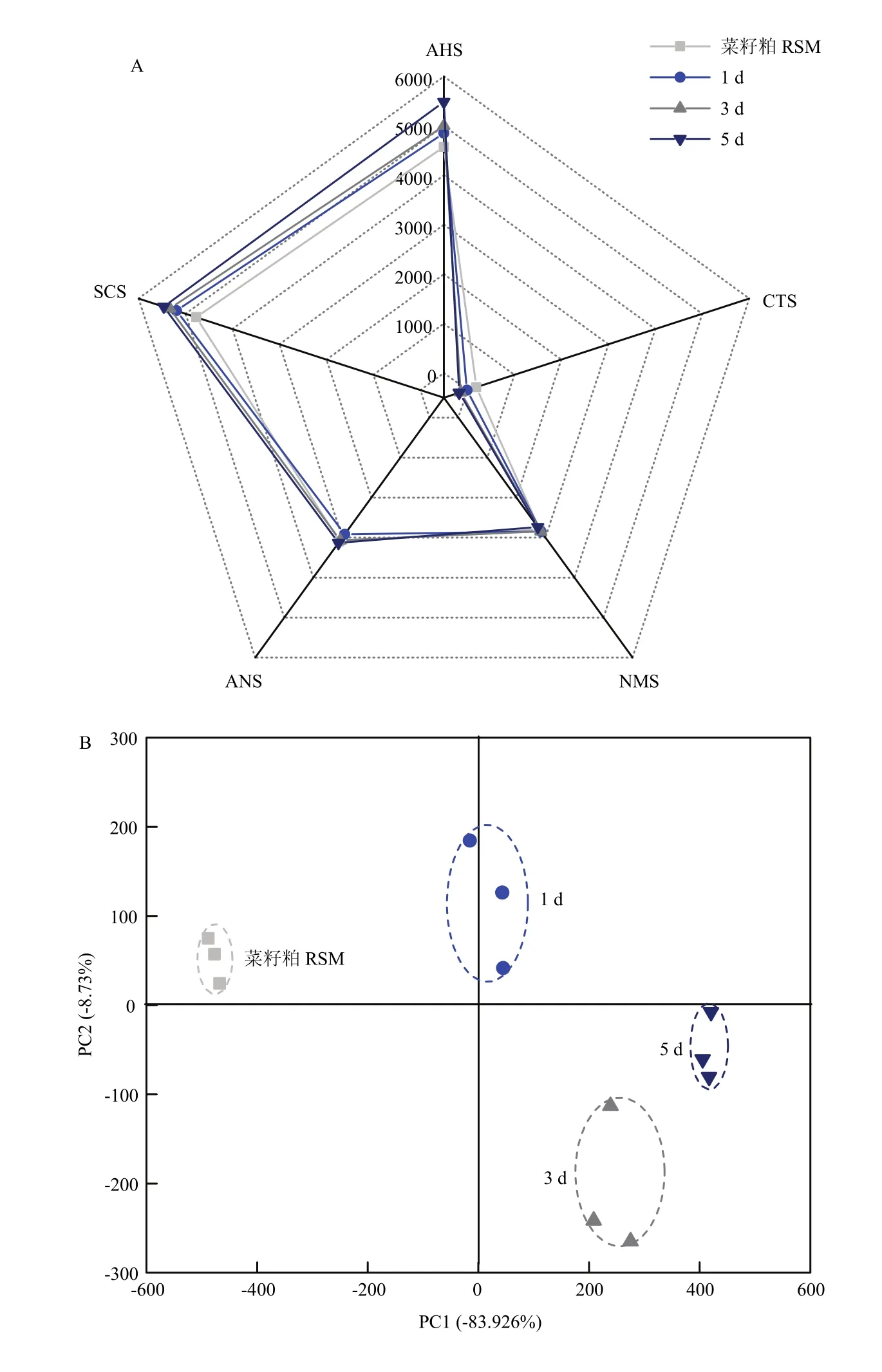
图5 不同发酵时间菜籽粕样品的电子舌的雷达图(A)和PCA图(B)Fig. 5 Radar fingerprint chart (A) and PCA (B) of electronic tongue data for rapeseed meal at different fermentation times
如图 5-B所示。PC1和 PC2的贡献率分别为83.92%和 8.73%,两者之和高达 92.65%,表明 PC1和PC2的总贡献率几乎包含了样品的所有信息。RSM落于第一象限,与不同时间发酵菜籽粕的中心相距较远,表明发酵前后菜籽粕的芳香性物质发生了很大变化。发酵1 d的发酵菜籽粕样品位于第二象限,与发酵第3、5天的发酵菜籽粕样品相距较远,能够明显区分开。发酵第3天和第5天的发酵菜籽粕都位于第四象限,且相距较近,说明它们滋味的相似性很高。
2.4 发酵菜籽粕对大鼠体重和免疫器官指数的影响
如表2所示,发酵5 d的菜籽粕等氮代替大鼠饲粮中25%的豆粕对大鼠的免疫器官指数和后期(21—42 d)平均日增重无明显的影响,但可以显著提高大鼠平均日采食量和前期(0—21 d)的平均日增重。
2.5 发酵菜籽粕对大鼠肾脏、肝脏和胸腺的影响
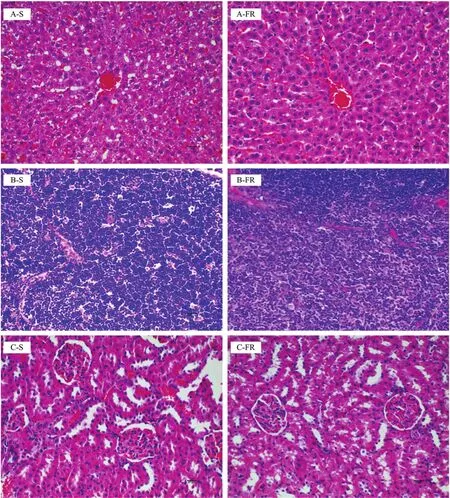
图6 各组小鼠器官组织形态学变化(HE染色,×200)Fig. 6 Spleen morphology of mice in all groups (HE staining, ×200)

表2 发酵菜籽粕对大鼠体重、采食量和免疫器官指数的影响Table 2 Effects of fermented rapeseed meal on body weight, feed intake and immune organ index in rats
两组肝脏 HE染色结果显示(图6),肝细胞形态完整,细胞核无增大,肝小叶组织形态良好,无炎性细胞浸润。两组肾脏HE染色结果显示,肾脏组织结构完整清晰,未见管型,间质无炎性细胞浸润,肾小管上皮细胞胞质染色均匀,胞核居中,未见空泡样变性、凋亡与坏死。两组胸腺组织HE染色结果显示正常,皮质、髓质界限清晰。
3 讨论
采用静态发酵显著降低了发酵菜籽粕中硫甙葡萄糖苷和植酸的浓度,与菜籽粕相比,分别降低了45.26%和41.37%。本研究中硫代葡萄糖苷的降解率低于陆豫等[5]的研究结果,一方面是由于双低菜籽粕本身硫甙葡萄糖苷的浓度(低于30 μmol·g-1)远远低于普通菜粕;另一方面可能是由于微生物的选择和优化发酵条件的指标不同。植酸降解率高于HU等[20]的研究,枯草芽孢杆菌不仅可以产生芥子酶来降解硫甙葡萄糖苷等化合物[21-22],还可以分泌植酸酶[23],能够分解植酸并释放植酸中的磷,提高动物对磷的利用率。菜籽粕中富含粗纤维,可能会影响营养物质(主要是蛋白质和氨基酸)的消化率。在本研究中,枯草芽孢杆菌产生的纤维素酶显著降低了菜籽粕中粗纤维的含量。菜籽粕中粗蛋白含量的增加是由于发酵过程中一些物质被分解产生挥发性气体,导致蛋白质浓度在一定程度上浓缩。菜籽粕中多肽含量从 2.7%增加至10.3%,明显高于WANG等[2]的研究(6.6%)。发酵过程中肽水平的增加是由微生物发酵产生的蛋白酶水解蛋白质引起,菜籽多肽可能具有某些生物活性,因此,菜籽多肽是评价菜籽粕营养价值的重要指标之一。此外,未发酵菜籽粕中主要含有高分子量蛋白质,经过发酵工艺,蛋白质被水解成氨基酸和分子量在 180—7 000 Da范围内的小肽。从图2可以看出,第3天时1 586 Da之前的峰值已经不存在,表明这些蛋白质对微生物蛋白酶降解的敏感性[7]。当发酵时间达到第5天时,分子量在500—108 Da的小肽和氨基酸在菜籽粕中含量最丰富。这是由于枯草芽孢杆菌和雅致放射毛霉菌都具有产蛋白酶的能力,蛋白酶能够将大分子的蛋白质分解为多肽,并进一步裂解为小分子寡肽和氨基酸残基。与大分子蛋白质相比,小肽具有更高的营养价值,因为小肽不仅能被动物肠道直接吸收,而且具有调节生理功能、增强免疫力、促进氨基酸吸收等作用。菜籽多肽的生理活性取决于多肽分子量大小及氨基酸序列。菜籽粕比豆粕中氨基酸的组成更加有利和合理。菜籽粕中含有较多的甲硫氨酸和半胱氨酸,但含有较少的赖氨酸。赖氨酸、苏氨酸和甲硫氨酸是限制某些动物饲料营养效率的 3种氨基酸[24]。赖氨酸和甲硫氨酸是蛋白质饲料的重要营养强化剂[25],苏氨酸则是维持家畜和家禽生长和免疫功能的必需氨基酸[26]。有些家禽,比如肉鸡,本身不能产生精氨酸,所以需要通过进食含有该氨基酸的膳食进行补充[27],因此,提高精氨酸在菜籽粕中的含量对今后将发酵菜籽粕运用于鸡饲料生产中有重要的意义。在本研究中,菜籽粕中必须氨基酸总量从发酵前的9.17%提高到发酵后的11.57%,提高率为26.17%,使得氨基酸的比例更为合理。总氨基酸含量的增加主要是微生物发酵合成支原体蛋白,这与 HE等[7]的研究结果相似。
发酵的菜籽粕中新检测到川芎嗪,川芎嗪(Tetramethylpyrazine,TTMP)又名四甲基吡嗪,是一种杂环含氮化合物,被广泛用作风味添加剂,具有烘烤、花生、榛子、可可等诱食性香气[28]。此前有报道称TTMP对食物的整体香气有显著贡献[29]。TMPP也被认为是发酵大豆和可可豆中的关键挥发性化合物,含量随着枯草芽孢杆菌数量的增加而增加[30-31]。曾有报道称枯草芽孢杆菌能通过微生物代谢从头合成 TMPP[32-33]。菜籽粕作为静态发酵培养基,富含糖、蛋白质和氨基酸,为枯草芽孢杆菌形成TTMP提供了充足的底物。TTMP在发酵菜籽粕中含量很高,它不仅仅是一种天然风味化合物,也是一种具有重要临床应用价值的生物活性成分[34-35]。近期有报道称,补充TTMP可显著降低肉仔鸡鼠伤寒沙门氏菌负荷和炎症反应[36]。此外,在食醋和白酒发酵过程中也发现了TTMP,它通常具有较低的风味阈值,因此被认为对酱香型风味有重要的贡献,并将它的含量作为一项功能性指标来评价食醋和白酒的质量[29,37]。因此,TTMP的产生对提高发酵菜籽粕的营养价值和整体风味具有重要作用。综上所述,本研究所采用的菌种类型及工艺可以提高菜籽粕的营养价值。
有研究表明,枯草芽孢杆菌可以改善豆粕的的风味品质,提高豆粕中吡嗪类的种类和含量[30]。经雅致放射毛酶发酵的豆乳,酯类的含量明显增提高[38]。本研究将枯草芽孢杆菌和雅致放射毛霉菌混菌发酵菜籽粕,得到的发酵菜籽粕兼具枯草芽孢杆菌和雅致放射毛霉的发酵香气,丰富了发酵菜籽粕的风味。电子舌的作用机理与鼻的作用机理相似,能够通过电子传感器检测人类的味觉。本研究中,传感器 AHS和 SCS的响应值随着发酵时间的延长而逐渐升高,其中AHS代表酸味,WANG等[2]利用微生物发酵菜籽粕促进酸味,认为酸味可以提高适口性,增加消费者的接受度。SCS代表苦味,发酵菜籽粕中苦味的增加可能是由于发酵后苦味氨基酸含量升高。虽然ANS和NMS在发酵前后无明显变化,但是响应值较高,说明菜籽粕本身就含有一定浓度的糖类、氨基酸、核苷酸和有机酸等甜味和鲜味贡献物。
静态发酵菜籽粕等氮代替基础饲粮中25%的豆粕可以明显提高大鼠的平均日增重日增重和平均日采食量,这与HU等[20]的研究结果相似。这可能与菜籽粕中蛋白质的降解导致消化率的提高有关。HONG等[39]发现,发酵可以将SBM中的多肽分子量降低,小肽更有利于新断奶仔猪的生长。此外,静态发酵能有效的降低抗营养物质,促进酸味增加,有利于提高菜籽粕的适口性。发酵后的特殊香气也可能是导致动物采食量增加的原因之一。如果饮食中硫甙葡萄糖苷的含量高,会导致肾脏和肝脏受损。组织病理学能可靠地反应机体器官与组织的损伤程度以及功能性变化,也是间接反应毒性程度所采用的主要方法。顾斌[8]曾在小鼠饲料中添加了15%的菜籽粕和发酵菜籽粕,发现与菜籽粕相比,添加同量的发酵菜籽粕能够减轻菜籽粕对小鼠肾脏、肝脏和胸腺的损伤。本研究中,HE染色结果表明两组大鼠的肾脏、肝脏和胸腺无显著差异,表明发酵菜籽粕未对大鼠产生慢性毒性作用。
4 结果
从品质角度看,本研究选用的有益菌(枯草芽孢杆菌和雅致放射毛霉菌)及发酵工艺显著降低了菜籽粕的抗营养物质的含量,提高了营养成分的含量;并对滋味和气味产生一定影响,特别是发酵后新产生的川芎嗪,不仅提高了菜籽粕的营养价值,并对菜籽粕的风味产生积极的影响。从安全角度看,发酵菜籽粕添加到大鼠饲粮中可以促进大鼠的生长,且不会对大鼠的肾脏、肝脏和胸腺造成损伤。
