不同菌种发酵对藜麦蛋白质特性及脂质构成的影响
2020-06-03延莎邢洁雯王晓闻
延莎,邢洁雯,王晓闻
(山西农业大学食品科学与工程学院,山西太谷 030801)
0 引言
【研究意义】藜麦是一种苋科藜属假谷物,原产于南美洲安第斯山区,由于其具有卓越的营养品质而被广泛认可[1]。藜麦蛋白质含量为14%—16%,且是富含组氨酸和赖氨酸的优质蛋白质。淀粉是藜麦最主要的碳水化合物,含量为58.1%—64.2%,其次还富含膳食纤维[2]。藜麦的脂类含量约为6%,亚油酸、亚麻酸等必需脂肪酸的含量较其他谷类更为合理[3]。此外,藜麦富含各种矿物质、维生素和植物化学成分,是一种“全营养食品”[4]。联合国粮农组织(FAO)指定藜麦为 21世纪能提供粮食安全的作物之一[3]。2014年以来,我国在山西、吉林、青海、甘肃和河北等省份开始较大规模种植藜麦[5],然而藜麦在我国还属于推广初期,普通民众对藜麦知之甚少,亟待将藜麦从田地推向餐桌。国内的藜麦产品多为初加工食品,主要是藜麦米,其他深加工产品较少,开发藜麦的深加工产品对藜麦产业发展具有重要意义。【前人研究进展】发酵食品是原料经微生物作用后获得的产品,是人类日常饮食中的重要组成部分[6]。发酵可以改变食品材料的组织结构,形成独特的风味;另外,通过降解抗营养物质和产生有益的成分来改善食品的营养特性[7]。藜麦高碳水化合物、高蛋白含量的特性可作为发酵原料,国外已有一些关于藜麦发酵产品的报道。CEBALLOS-GONZALEZ等[8]用乳酸菌发酵藜麦面团制成无谷蛋白白面包,获得了均匀多孔、感官品质好、营养价值高的产品。LORUSSO等[9]用天然发酵藜麦粉代替小麦粉制备意大利面,可明显改善其质地特性,增加蛋白质体外消化率和降低血糖生成指数。BIANCHI等[6]以藜麦和大豆为原料,以干酪乳杆菌为发酵剂,开发一种具有潜在益生菌功能的饮料。【本研究切入点】目前的研究较少探讨关于发酵对藜麦主要营养成分的影响,尤其是脂质方面的研究几乎没有涉及。不同加工方式对藜麦营养代谢影响的相关报道较缺乏。【拟解决的关键问题】采用不同菌种发酵后,了解藜麦蛋白质水解情况并首次利用脂质组学技术对藜麦脂质进行分析,明确发酵后藜麦主要营养成分的变化趋势,为藜麦发酵食品的开发提供理论依据。
1 材料与方法
试验于2019年3月在山西农业大学食品科学与工程学院进行。
1.1 材料与试剂
藜麦购于赣州市九鲤湖食品有限公司;活性干酵母、植物乳杆菌购于安琪酵母股份有限公司。
甲醇、乙腈、甲酸、甲酸铵、异丙醇购于赛默飞世尔科技(中国)有限公司,色谱纯;37种脂肪酸混合标准品、17种氨基酸混合标准品、色氨酸标品购于Sigma公司,分析纯;牛肉膏、蛋白胨购于上海索莱宝生物科技有限公司;氢氧化钠、牛血清白蛋白、考马斯亮蓝、D-无水葡萄糖、3,5-二硝基水杨酸等购于国药集团化学试剂有限公司,均为分析纯。
1.2 仪器与设备
SC-3610低速离心机,安徽中科中佳科学仪器有限公司;YHG-400-BS-II远红外快速恒温干燥箱,上海跃进医疗器械有限公司;SCIENTZ-18N真空冷冻干燥机,宁波新芝生物科技股份有限公司;SH220F型石墨消解仪,山东海能科学仪器有限公司;安捷伦6560离子淌度Q-TOF LC/MS,安捷伦科技(中国)有限公司;ThermoFisher Trace 1310 ISQ气相色谱质谱联用仪、ThermoFisher U3000液相色谱仪,赛默飞世尔科技有限公司。
1.3 试验方法
1.3.1 原料预处理 酵母菌复壮:配置酵母菌培养基,于121℃灭菌20 min,待培养基冷却后在无菌条件下接入酵母菌,在30℃的培养箱中静置培养48 h,直至菌悬液浓度达到5×108CFU/mL。
植物乳杆菌复壮:配置植物乳杆菌培养基,于121℃灭菌 20 min,待冷却后在无菌条件下接入植物乳杆菌,在37℃的培养箱中静置培养48 h,直至菌悬液浓度达到5×108CFU/mL。
藜麦发酵粉的制备:藜麦经中草药粉碎机粉碎后,过80目筛,制得藜麦粉(Q)。称取50 g藜麦粉,共3份,加入50 mL无菌水,分别接入复壮的酵母菌(接种量4%)、植物乳杆菌(接种量4%)、酵母菌和植物乳杆菌混合菌(酵母4%+植物乳杆菌4%),在适宜条件(36℃)下培养48 h。发酵结束后,真空冷冻干燥即得酵母发酵藜麦粉(QY)、植物乳杆菌发酵藜麦粉(QL)和混合菌发酵藜麦粉(QM),保存于-20℃备用。
1.3.2 发酵藜麦蛋白水解特性的测定 蛋白质水解指数(PI)的测定[10]:PI=NPN/TN×100%,NPN(非蛋白氮)、TN(总氮)采用凯氏定氮法测定。
蛋白组分的测定[11]:分别称取5 g藜麦粉和制备好的发酵藜麦样品,用索氏抽提法脱脂后,采用Osborne分级法测定样品的各蛋白组分,分别得到清蛋白、球蛋白、谷蛋白和醇溶性蛋白。
游离氨基酸的测定[12]:17种氨基酸分析方法:称取0.5 g样品,加入0.01 mol·L-1盐酸40 mL,涡旋混匀5 min后超声提取10 min,定容于50 mL容量瓶。避光静置2 h后4 000 r/min离心10 min,取1 mL上清液,加入1 mL 3%的磺基水杨酸,涡旋1 min,避光静置1 h,15 000 r/min离心15 min,取上清液过膜待测。上机条件:Agilent C-18分析柱(250 mm×4.6 mm,5 μm),流动相 A(0.1 mol·L-1醋酸钠溶液∶乙腈=93∶7),流动相 B(乙腈∶水=8∶2),流速为 1 mL·min-1,柱温40℃,检测波长254 nm,洗脱梯度为:0 min,0% B;14 min,15% B;29 min,34% B;30 min,100%B;37 min,100% B;38 min,0%B;45 min,0% B。色氨酸分析方法:用4 mol·L-1NaOH溶液充分溶解样品,调pH至中性,过膜待测。色谱柱同上,流动相为0.02 mol·L-1醋酸溶液∶甲醇=8∶2,检测波长为280 nm,柱温25℃。
1.3.3 发酵藜麦脂质的测定 游离脂肪酸的测定[12]:称取1 g样品于试管中,加入2 mL 5%盐酸甲醇溶液,3 mL氯仿甲醇溶液,100 μL十九烷酸甲酯内标,于85℃水浴1 h。待冷却到室温,加入1 mL正己烷,震荡萃取2 min后,静置1 h,待分层后取上层清液100 μL,用正己烷定容到1 mL,过膜后待测。分析条件:色谱柱为TG-5MS(30 m×0.25 mm×0.25 μm),进样口温度290℃,载气流速1.2 mL·min-1。升温条件:80℃保持1 min,以10℃/min的速率升温至200℃,再以 5℃/min的速率升温至 250℃,最后以 2℃/min的速率升到270℃,保持3 min。质谱条件:离子源温度 280℃,溶剂延迟时间 5 min,扫描范围 30—400 amu,电离方式EI,电子能量70 eV。
脂质的测定[13]:称取1 g样品于玻璃试管中,加入10 mL溶液(二氯甲烷∶甲醇=2∶1),涡旋10 min,5 000 r/min离心10 min,萃取2次,合并两次上清液。上清液中加入5 mL水,涡旋混匀1.5 min,5 000 r/min离心10 min,取下层氯仿层氮吹后用甲醇复溶,过膜待测。分析条件:色谱柱为Agilent Eclipse Plus C8(2.1 mm×100 mm,1.8 μm);流动相:含 5 mmol·L-1甲酸铵和0.1%甲酸水溶液(A),乙腈∶异丙醇(5∶2,v/v)含5 mmol·L-1甲酸铵和0.1%甲酸(B);流速为0.3 mL·min-1;梯度洗脱条件(0 min,60% B;11 min,100% B;20 min,100% B);柱温为40℃。离子源:AIS ESI;检测模式为正离子模式;干燥气流速为 15 L·min-1;干燥气温度200℃;雾化气流速35 psi;鞘气流速11 L·min-1;鞘气温度350℃;毛细管电压3.5 kV;喷嘴电压0 kV;扫描范围:m/z 100—1 200;参比离子:121.0509、922.0098。
1.3.4 发酵藜麦淀粉含量的测定 采用DNS法[14]:根据葡萄糖反应后在540 nm处测定的吸光值,绘制的标准曲线为Y=1.058X-0.1269(R2=0.9986),X为葡萄糖浓度(mg·mL-1),Y为吸光度值。准确称取1 g藜麦样品,放入100 mL三角瓶中,加10 mL 6 mol·L-1HCL和15 mL蒸馏水,在沸水浴中加热30 min,使其充分水解。待冷却至室温后调到中性,稀释合适浓度进行测定。

1.4 数据处理
每个样品进行3次平行试验,结果表示为平均值±标准差。数据统计分析通过软件IBM SPSS Statistics 22处理,多重比较采用LSD法,显著水平为0.05;采用2010版Excel和Origin 9.0软件绘制图表。
2 结果
2.1 发酵对藜麦蛋白质水解的影响
2.1.1 对藜麦蛋白质水解指数的影响 如图1所示,经酵母菌、植物乳杆菌和混合菌作用后,藜麦蛋白质的水解指数都显著升高(P<0.05),表明发酵后产生了更多的多肽、短肽及游离氨基酸等非蛋白氮,且不同菌的作用效果差异显著。与 Q相比,QY、QL和QM的PI分别提高了18.7%、10.1%和17.3%,表明有酵母参与的发酵过程,更有利于藜麦蛋白向较小分子非蛋白氮的转化。
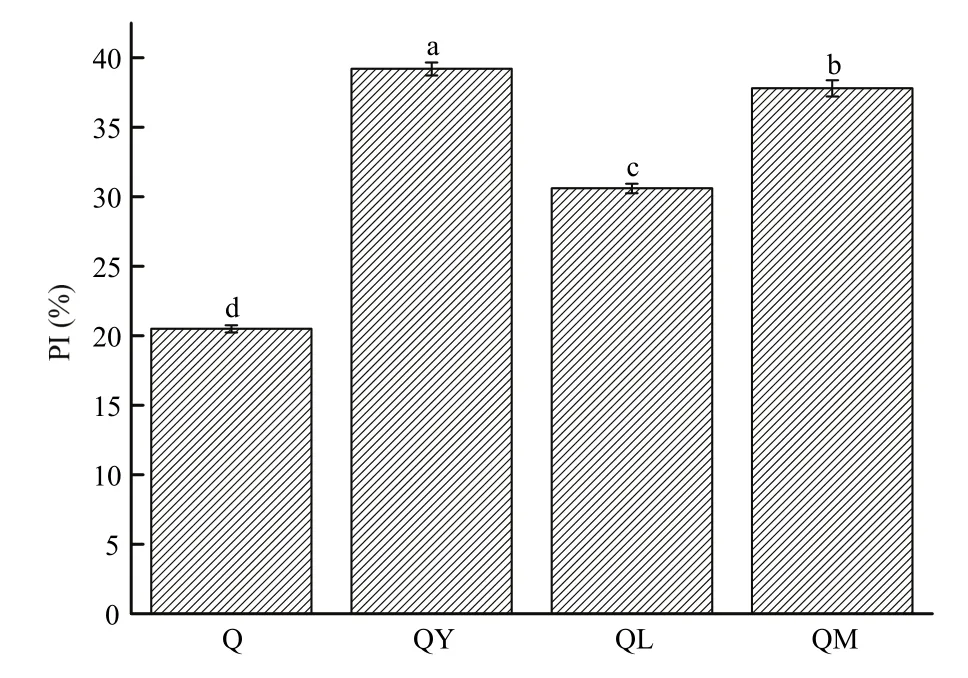
图1 发酵对藜麦蛋白质水解指数的影响Fig. 1 Effect of fermentation on protein hydrolysis index of quinoa
2.1.2 对藜麦各蛋白组分的影响 藜麦蛋白构成包括42.21%清蛋白、37.52%球蛋白、0.56%醇溶蛋白和7.22%谷蛋白,其中清蛋白和球蛋白是最主要的藜麦蛋白,约占总蛋白的80%,藜麦中的醇溶蛋白含量极低。经微生物作用后,各处理中的醇溶蛋白含量变化不显著(P>0.05),清蛋白、球蛋白和谷蛋白含量均显著降低(P<0.05),其中清蛋白和球蛋白变化更为明显,说明微生物和蛋白酶主要分解作用这两种蛋白。经酵母发酵后,QY的清蛋白和球蛋白含量较Q分别降低了10.43%和6.96%;植物乳杆菌作用后,QL的清蛋白和球蛋白含量较Q分别下降了5.10%和4.26%;混合菌发酵后,QM 的清蛋白和球蛋白的含量分别下降了7.68%和4.65%(图2)。酵母菌发酵,更有利于藜麦蛋白分解成较小的分子,这与前面发酵对蛋白质水解指数影响的结果一致。

图2 发酵对藜麦各蛋白组分含量的影响Fig. 2 Effect of fermentation on content of protein components in quinoa
2.1.3 对藜麦游离氨基酸含量的影响 发酵后藜麦游离氨基酸的变化情况如表1所示。藜麦富含所有的必需氨基酸且构成合理,其中亮氨酸、色氨酸和缬氨酸含量较高。藜麦中的含硫氨基酸含量较少,与前面测得的醇溶蛋白含量少相一致。经发酵后,必需和非必需游离氨基酸含量都显著增加(P<0.05),不同微生物作用效果差别明显。酵母发酵后,游离的必需氨基酸约增加了15倍,游离的非必需氨基酸约增加了7倍,总游离氨基酸约增加了9倍;植物乳杆菌作用后,游离的必需氨基酸约增加了9倍,游离的非必需氨基酸约增加了3倍,总游离氨基酸约增加了5倍;混合菌发酵后,游离的必需氨基酸约增加了12倍,游离的非必需氨基酸约增加了6倍,总游离氨基酸约增加了8倍。藜麦发酵后,有更多的必需氨基酸得到释放。经过酵母发酵,藜麦中的游离氨基酸含量显著增加,尤其是必需氨基酸,进一步说明酵母发酵藜麦更有利于蛋白质水解成氨基酸。
2.2 发酵对藜麦脂类的影响
2.2.1 对藜麦游离脂肪酸含量的影响 经不同发酵处理后,藜麦中游离脂肪酸含量的变化情况如表2所示。藜麦中的饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量分别是 5 588.22、13 433.32 和 30 705.28 mg·kg-1,且三者的比例约为1∶2.4∶5.5。在这些脂肪酸中,必需脂肪酸亚油酸含量最高,为26 213.13 mg·kg-1,此外,作为DHA和EPA前体的亚麻酸含量也较高,为4 353.54 mg·kg-1。通过发酵处理后,藜麦中游离的饱和、单不饱和和多不饱和脂肪酸含量都显著增加(P<0.05)。与藜麦原料相比,经酵母发酵后,饱和脂肪酸含量约增加了3.7倍,单不饱和脂肪酸含量约增加了2.4倍,多不饱和脂肪酸含量约增加了1.9倍,且3种脂肪酸的比例约为1∶1.7∶3.3;经植物乳杆菌发酵后,饱和脂肪酸含量约增加了 2.5倍,单不饱和脂肪酸含量约增加了1.8倍,多不饱和脂肪酸含量约增加了1.8倍,且3种脂肪酸的比例约为1∶1.9∶4.3;而经混合菌发酵后,饱和脂肪酸含量约增加了3.1倍,单不饱和脂肪酸含量约增加了2.3倍,多不饱和脂肪酸含量约增加了1.8倍,且3种脂肪酸的比例为1∶2∶3.8。
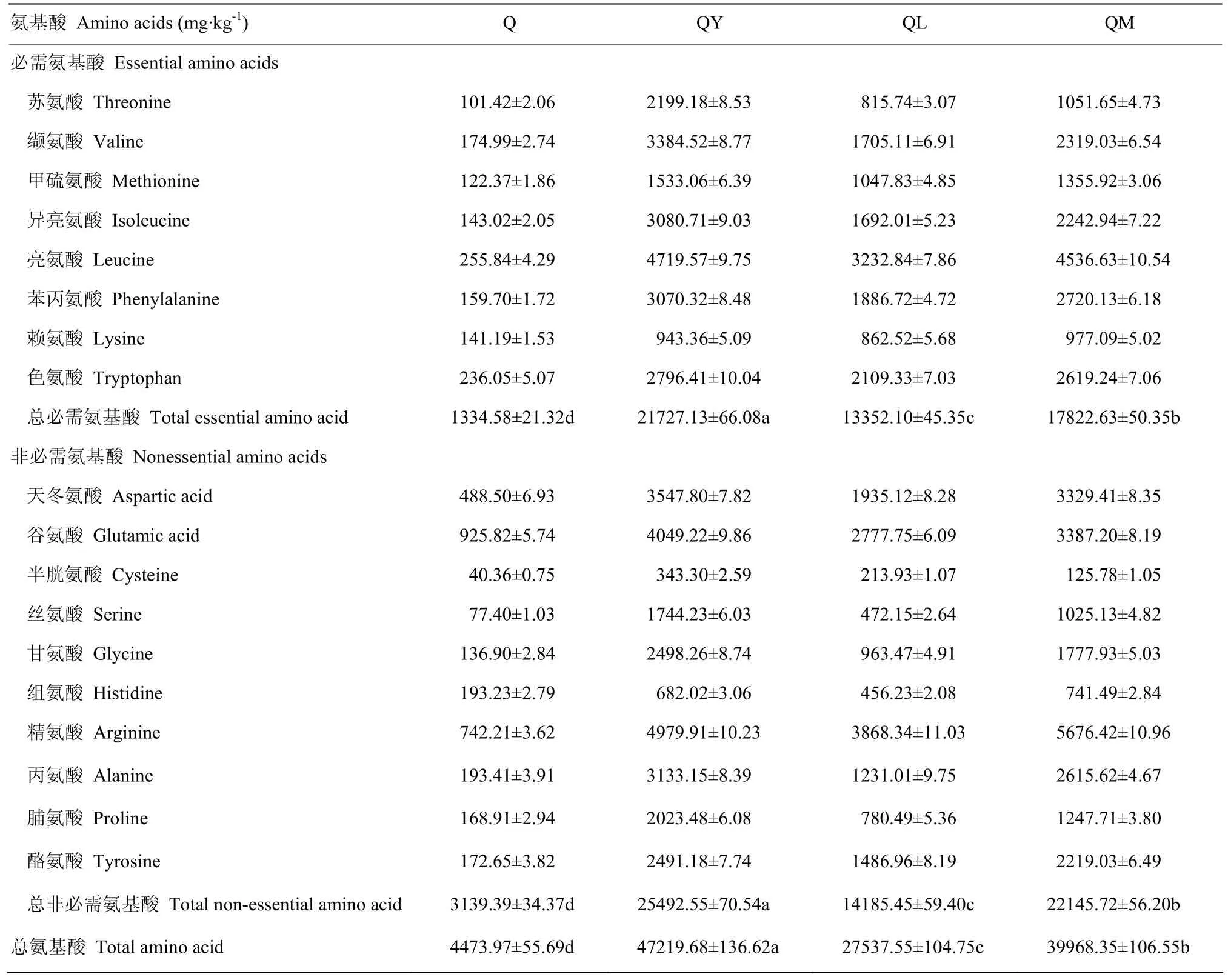
表1 发酵对藜麦游离氨基酸含量的影响Table 1 Effect of fermentation on free amino acids content of quinoa
2.2.2 对藜麦脂质的影响 在正离子模式下,通过IM-MS采集,与谱库离子的一级、二级和碰撞横截面积(CCS)信息比对共鉴定出176种脂质化合物,包括9种脂类,分别是97种甘油三酯(TG)、13种甘油二酯(DG)、28种卵磷脂(PC)、7种脑磷脂(PE)、13种溶血卵磷脂(LPC)、2种溶血磷脂酰乙醇胺(LPE)、6种磷脂酸(PA)、5种神经酰胺(Cer)和5种鞘磷脂(SM)。根据不同处理的藜麦样品脂质构成绘制图3。藜麦中的脂类最主要是TG(90.5%)和DG(5.5%),其他脂类含量不足5%(LPC(1.1%)、LPE(0.02%)、PA(1.0%)、PC(1.1%)、PE(0.6%)、SM 微量)。不同微生物发酵后会降低液质检出藜麦总脂的含量,且各类脂的构成也发生了变化。经酵母发酵后,QY中TG和DG分别减少了3.7%和17.9%,其他功能脂除了 SM 都有所增加,脂类构成为:TG(90.1%)、DG(4.7%)、LPC(1.7%)、LPE(0.03%)、PA(1.1%)、PC(1.4%)、PE(0.7%)、Cer(0.2%)、SM微量。经植物乳杆菌发酵后,QL中TG和DG分别减少了0.9%和10.5%,除了未测到Cer,其他功能脂都有所增加,脂类具体构成为:TG(90.0%)、DG(5.0%)、LPC(1.6%)、LPE(0.03%)、PA(1.2%)、PC(1.3%)、PE(0.84%)和SM(0.03%)。经混合菌作用后,QM中TG和DG分别减少了3.6%和11.7%,
除了LPE变化不大,其他功能脂含量都有所增加,具体的脂类构成如下:TG(90.3%)、DG(5.1%)、LPC(1.2%)、LPE(0.02%)、PA(1.1%)、PC(1.2%)、PE(0.8%)、SM(0.04%)和Cer(0.2%)。有酵母菌参与的藜麦发酵能更有效降低TG含量,提高了其他功能脂的含量(DG除外)。
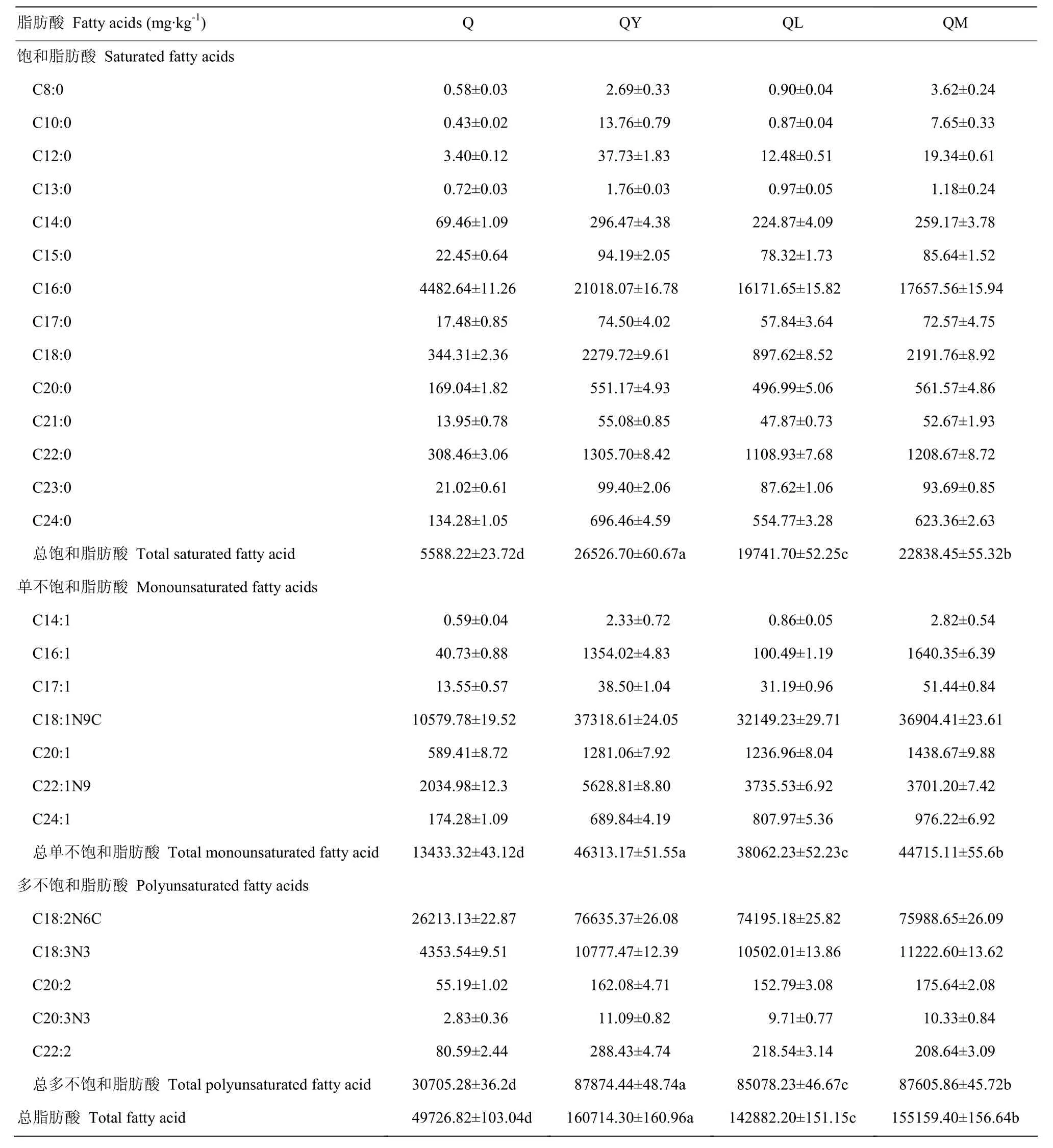
表2 发酵对藜麦游离脂肪酸含量的影响Table 2 Effect of fermentation on free fatty acids content of quinoa

图3 发酵对藜麦脂质构成的影响Fig. 3 Effect of fermentation on lipid composition of quinoa
2.3 发酵对藜麦淀粉含量的影响
未处理的藜麦淀粉含量为 53.6%,经不同发酵处理后,藜麦淀粉含量均显著降低(P<0.05)。与 Q相比,QY淀粉含量降低了56.2%,QL淀粉含量降低了35.1%,QM淀粉含量降低了68.5%,酵母菌和植物乳杆菌生长代谢过程中都会大量消耗碳水化合物,且经混合菌发酵后,藜麦中淀粉含量下降最多(图4)。可见,酵母较植物乳杆菌利用糖的效率更高。
3 讨论
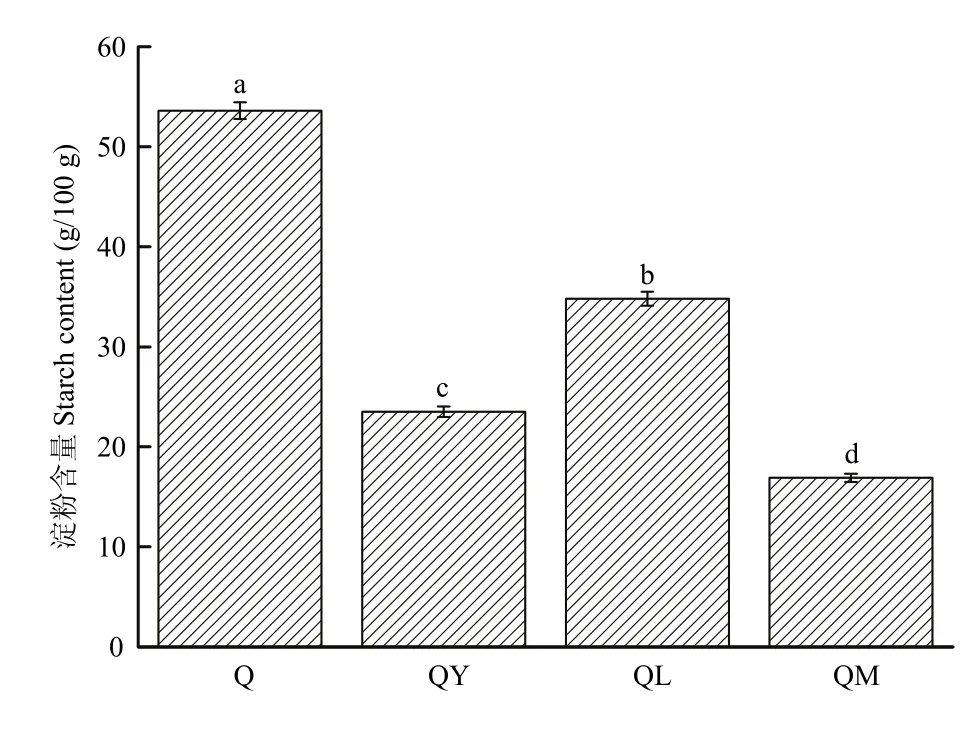
图4 发酵对藜麦淀粉含量的影响Fig. 4 Effect of fermentation on starch content of quinoa
由于藜麦具有独特的营养价值和潜在的健康益处,近年来备受关注[15]。藜麦富含大量营养素,平均蛋白质的质量分数约为16%,淀粉质量分数约为55%,脂类的质量分数约为 7%,这 3大营养成分约为藜麦总质量的78%。蛋白质和脂类相较于淀粉组成更为复杂,但酵对它们的影响在以往的研究中极少涉及。在发酵过程中,由于微生物或内源性蛋白酶的作用,将蛋白质水解为多肽、短肽及游离氨基酸等多种非蛋白氮形式[16],从而会使衡量蛋白质水解程度的蛋白质水解指数(非蛋白氮占蛋白氮的百分含量)升高。利用清酒乳杆菌和木糖葡萄球菌在发酵成萨拉米香肠的过程中,45 d的发酵期后蛋白质水解指数增加了约15%[17]。在本研究中,酵母发酵后蛋白水解指数增加了 18.7%,混合菌提高了 17.3%,植物乳杆菌发酵后变化最小,为10.1%。酵母、植物乳杆菌发酵过程中,主要是清蛋白和球蛋白变化更为明显,其中酵母对这两种蛋白含量下降的影响更突出。王金水等[18]研究酵母和植物乳杆菌对小麦酸面团发酵过程中的蛋白质分解规律,发现酵母对面团中的蛋白质降解作用弱,而植物乳杆菌的降解效果显著,且可溶蛋白和谷蛋白降解最为明显。这个结果与本研究不完全一致,可能是由于小麦与藜麦的蛋白组成差异较大且发酵条件并不相同。已有研究表明,在仅有葡萄糖、果糖和乳糖作为碳源时,乳酸菌和酵母菌具有共生作用[19],酵母菌产生了促进乳酸菌生长的生长因子,然而,这些生长因子的性质和功效取决于发酵微生物的种类和碳源等条件。从藜麦蛋白水解结果来看,混合菌发酵对蛋白的降解作用不如酵母单独作用的效果好。在发酵过程中,谷物酶和微生物代谢对谷物蛋白质转化都起到了重要作用[20]。蛋白质水解依赖于谷物蛋白酶,酵母、乳酸菌的肽酶活性决定了肽、氨基酸和氨基酸代谢物在面团或发酵制品中的积累[21]。然而已有研究表明,酸面团中肽含量较低,氨基酸含量较高,这是由于细胞内肽水解产生的多余氨基酸从细胞中释放出来,肽的细胞内水解有助于氨基酸在酸面团中的积累[22],这可能也是藜麦发酵后游离氨基酸含量增多的原因。此外,谷物中酚类化合物的种类和含量与酶促转化和微生物代谢息息相关[23],选择对酚类具有抗性的微生物发酵至关重要。在谷物制品的发酵和焙烤过程中,微生物的蛋白质代谢除了具有水解产生氨基酸的作用外,还有助于风味的形成[24]。例如,鸟氨酸是小麦面包皮关键风味化合物 2-乙酰-1-吡咯啉在烘烤过程中形成的前体化合物,酵母或乳酸菌可以通过精氨酸代谢产生鸟氨酸[25]。本研究结果初步表明,酵母较植物乳杆菌发酵藜麦更有利于蛋白质、多肽等水解成氨基酸这些小分子化合物,有利于大分子的转化。
相较于蛋白质和碳水化合物,脂类在藜麦中仅占少部分,但对发酵制品品质有重要影响,不仅能为人们的日常饮食提供必需脂肪酸,在加工贮藏中,脂类物质易发生氧化反应且是一些关键香气化合物的前体物质[26]。脂质是一个具有高度多样性的大家族,尽管传统质谱法在脂质组学中具有高敏感和高选择性,但由于脂类分子的结构多样性且同分异构体的存在,很多脂类物质还是不能完全分离和准确鉴定[27]。离子淌度质谱(Ion Mobility-Mass Spectrometry,IM-MS)是离子淌度分离与质谱联用的一种新型二维质谱分析技术。离子淌度分离原理是基于离子在漂移管中与缓冲气体碰撞时的碰撞截面不同,离子可按大小和形状进行分离,所得的漂移时间可进一步计算得到碰撞截面积(CCS)[28]。脂质离子的CCS值代表其与缓冲气体之间可以发生碰撞的有效面积,该值与脂质离子自身的大小、形状及其所带电荷有关,是脂质离子固有的物理化学特性,在鉴定中引入CCS值可以极大地提高可信度[29]。本研究中,通过离子碎片的一级、二级和CCS的信息与谱库进行匹配共鉴定出176种脂质化合物,包括9个种类。小麦粉发酵后,糖脂含量会降低,而非极性脂和磷脂含量会增加,JANSSEN等[30]认为是由于发酵前后蛋白质与不同种类脂的结合而造成。EI-SEBAIY等[31]研究发酵鲻鱼的脂质变化,发现发酵结束后,饱和脂肪酸和不饱和脂肪酸的比值有所升高,这与本研究的结果一致,且饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸的比值更接近1∶1∶1(FAO/WHO推荐的脂肪酸平衡饮食)。VISESSANGUAN等[32]研究了发酵对泰式香肠Nham脂质及脂肪酸的影响,结果与本研究相似,随着游离脂肪酸的增加,甘油三酯、甘油二酯含量会有所下降。加工对脂质构成的影响在动物性食品中研究较多,在谷物类食品中相对较少涉及。本研究发现通过发酵可以改变藜麦的脂质组成,甘油三酯含量相对降低,LPC、LPE、PA、PC和PE相对含量都有所增加,微生物发酵可使藜麦的脂质组成更为合理。
发酵会改善淀粉类食品的营养组成和口感。淀粉作为藜麦含量最多的成分,也是微生物消耗的碳源,发酵后,藜麦中的淀粉含量显著降低。在植物乳杆菌发酵籼米粉过程中,总淀粉含量降低的同时,直链淀粉在总淀粉中的比例会增大。推测可能是植物乳杆菌产生的异淀粉酶将支链淀粉转化为直链淀粉[33]。NUMFOR等[34]对发酵木薯粉的淀粉进行了研究,也发现直链淀粉含量显著增加。本研究只测定了发酵对藜麦淀粉含量的影响,而未对淀粉的理化特性进行分析,然而淀粉的特性对谷物食品的加工适性有重要影响,下一步可针对这部分内容开展深入研究。
4 结论
不同菌种发酵均会增加藜麦蛋白质水解指数,且主要作用于清蛋白和球蛋白。有酵母参与的发酵,更有利于藜麦蛋白向较小分子非蛋白氮的转化。不同发酵都会显著提高游离脂肪酸的含量,且脂类的构成也会发生变化,降低甘油三酯、甘油二酯含量,磷脂等功能脂含量增加,酵母菌发酵更有利于这种转化。因此,酵母较植物乳杆菌更有利于改善发酵藜麦的营养,研究结果为藜麦发酵制品的开发提供了理论依据。
