H9和H6亚型禽流感病毒三重RT-PCR检测方法的建立
2020-06-03谢芝勋罗思思谢丽基张民秀黄娇玲谢志勤邓显文曾婷婷张艳芳
李 丹, 李 孟, 谢芝勋, 罗思思, 谢丽基, 张民秀,黄娇玲, 范 晴, 王 盛, 谢志勤, 邓显文, 曾婷婷, 张艳芳
(广西壮族自治区兽医研究所 广西兽医生物技术重点实验室, 广西 南宁 530001)
禽流感病毒(Avian influenza virus,AIV)是正黏病毒科中A型流感病毒属成员。根据其表面抗原血凝素蛋白(Hemagglutinin,HA)和神经氨酸酶蛋白(Neuraminidase,NA)的差异可将AIV划分为16种不同的HA亚型(H1~H16)和9种不同的NA亚型(N1~N9)[1-3]。依据AIV对鸡致病性的强弱,AIV还可分为高致病性AIV(HPAIV)和低致病性AIV(LPAIV)。H9亚型AIV自1966年在美国首次被发现以来,目前已经给全球养禽业造成了十分严重的经济损失[4]。自1998年广东首次发现人感染H9N2亚型AIV病例以来,H9N2亚型AIV感染人事件也在不断的发生[5]。H6亚型AIV属于LPAIV,在中国、北美和欧洲等地区已被广泛发现[6-7]。研究表明,H6亚型AIV感染范围广泛,其天然宿主主要为水禽,其他陆生禽类感染率相对较少[8]。我国自2000年以来已不断有H6亚型AIV分离的报道,而且还在人群中检测到H6亚型AIV的特异性抗体[9-10],更为严重的是台湾地区已经于2013年6月发现1例H6N1直接感染人的病例[11]。近年来的低致病性禽流感的流行病学监测发现,H9和H6亚型禽流感病毒混合感染普遍存在,部分H9N2和H6N6亚型AIV可为H5N6和H7N9等亚型高致病性禽流感病毒提供内部基因[12-13]。因此,开展H9与H6亚型AIV的研究对家禽养殖及人类健康卫生具有重要意义。
由于传统的禽流感病毒检测方法存在病毒分离培养周期长且需要血清学方法鉴定,而血清学方法要用较多标准阳性血清,但是禽流感病毒不同亚型血清相互间存在不同程度的交叉免疫保护反应,其结果的准确性具有局限性,所以目前禽流感病毒较多采用分子生物学方法进行检测。分子生物学方法特别是RT-PCR检测技术具有快速、简便和准确等优点,在禽流感的诊断及大规模监测过程中应用广泛[14]。由于AIV感染动物后具有相似的临床症状,混合感染的现象也普遍存在,所以在日常诊断中难以及时、准确地对其进行鉴别确诊。近年来,随着分子生物学技术的发展,多重PCR技术的应用也越来越广泛,特别是在禽流感诊断领域中,但关于三重RT-PCR检测区分H9与H6亚型AIV混合感染的方法鲜见报道。鉴于此,依据Genbank中H9和H6亚型AIV的HA基因及所有亚型AIVM基因的保守序列,分别设计3对特异性引物,优化退火温度和引物浓度及其配比等条件,建立优化可同时检测H9与H6亚型AIV的三重RT-PCR检测方法,并对所建方法进行特异性、敏感性及临床样品检测的验证,旨在为H9与H6亚型AIV的监测及其防控提供技术支撑。
1材料与方法
1.1材料
1.1.1毒株AIV毒株(H1N2、H3N2、H6N2、H9N2、H9N6、NDV、IBV及ILTV)均由广西兽医生物技术重点实验室保存;AIV(H7N2、H14N5、H15N9和H16N3)的cDNA 模板由美国宾夕法尼亚州立大学惠赠;AIV毒株(H5N1)cDNA 模板由美国康涅狄格州立大学惠赠;其他AIV毒株(H2N3、H4N5、H8N4、H6N8、H10N3、H11N3、H12N5和H13N5)或cDNA 模板均由香港大学惠赠。
1.1.2试剂SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司,DL 1 000 bp DNA Marker、感受态细胞、PCR产物快速连接载体、胶回收试剂盒及小量质粒抽提试剂盒均购自北京全式金生物技术有限公司。MLV逆转录酶、随机引物、10 mmol dNTP、RNA抽提试剂盒、2×PCR Mix及RNA抑制剂均购自宝生物(北京)有限公司。其他试剂均购自商业公司。
1.2方法
1.2.1引物的设计及合成从GenBank中下载各种不同亚型禽流感病毒的M基因序列、H9和H6亚型AIV的HA基因序列,运用DNAStar比对分析上述序列,找出特异性的保守区域,然后运用Primer Premier 5.0结合Oligo 7设计并通过验证筛选出3对针对M基因、H9和H6亚型AIVHA基因进行扩增的特异性引物。引物由宝生物(大连)有限公司合成。引物序列及目的片段大小见表1。
表1 禽流感病毒H9和H6亚型HA和M基因引物序列
Table 1 Prime Sequence forHAandMgene in H9 and H6 subtype AIV
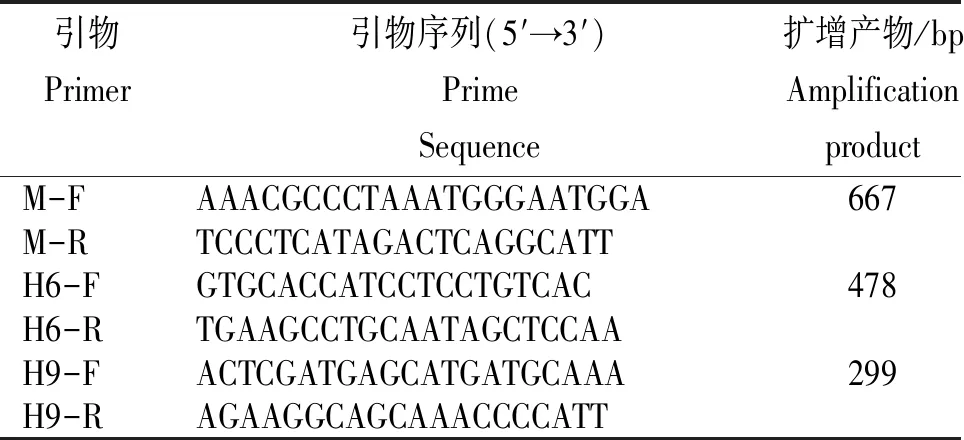
引物Primer引物序列(5′→3′)Prime Sequence扩增产物/bp Amplification productM-F AAACGCCCTAAATGGGAATGGA 667M-R TCCCTCATAGACTCAGGCATT H6-F GTGCACCATCCTCCTGTCAC 478H6-R TGAAGCCTGCAATAGCTCCAA H9-F ACTCGATGAGCATGATGCAAA 299H9-R AGAAGGCAGCAAACCCCATT
1.2.2病原RNA/DNA的提取与cDNA合成参照核酸抽提试剂盒使用说明抽提AIV、IBV、NDV和ARV的RNA及ILTV的DNA,抽提后的核酸模板用33 μL RNA-free水溶解。RNA模板参照宝生物反转录试剂盒的说明合成cDNA,所有核酸模板均于-30℃保存备用。
1.2.3三重RT-PCR反应体系的建立及优化运用25 μL反应体系:2×PCR Mix 12.5 μL,H9与H6亚型AIV cDNA模板各1 μL,引物M-F、M-R、H9-F、H9-R、H6-F和H6-R (20 pmol/μL)分别加入0.1~1.0 μL,共10个梯度,每个梯度递增0.1 μL,优化2个引物组合的浓度,用RNA-free补足至25 μL。同时根据浓度试验的效果再对退火温度及反应时间进行组合优化,最终确定最佳反应体系及条件。
1.2.4特异性试验运用上述所建立的三重RT-PCR检测方法按照对H1N2、H2N3、H3N2、H4N5、H5N1、H6N8、H7N2、H8N4、H9N2、H9N6、H10N3、H11N3、H12N5、H13N5、H14N5、H15N9、H16N3、NDV、IBV和ILTV的cDNA/DNA进行检测,验证所建方法的特异性。
1.2.5标准品的制备分别以H9N2与H6N6毒株cDNA为模板扩增M基因和HA基因,得到其全长目的片段,并将目的片段分别连接到载体上并送测序。将插入有H9与H6亚型AIV的HA基因和M基因全长片段并测序正确的重组质粒分别命名为M-T、H9-T和H6-T。用商品化的质粒抽提试剂盒分别提取含有M-T、H9-T和H6-T的质粒,并用微量核酸检测仪测定其浓度,根据相关公式计算样品相对应的拷贝数,同时将M-T、H9-T与H6-T质粒等拷贝数混合,并按10倍的倍比稀释混合样品,以便获得M-T、H9-T与H6-T质粒DNA浓度均为5×102~5×107拷贝/μL的标准品。
1.2.6敏感性试验运用上述优化好的三重RT-PCR检测方法对制备好的浓度为5×10~5×109拷贝/μL的M-T、H9-T与H6-T质粒样品进行扩增,验证该检测方法的敏感性。
1.2.7临床样品检测运用所建立的三重PCR检测方法对近期从南宁、柳州和防城港不同活禽市场采集的152份鸡和鸭咽喉及泄殖腔棉拭子样品的部分进行PCR检测鉴定,同时将相同编号剩余样品经过处理后接种SPF鸡胚进行流感病毒的分离与血清学鉴定,将鉴定H9与H6亚型AIV为阳性的样品进行HA基因的序列测定,所有M基因阳性样品也进行序列测定。然后将上述方法的检测结果进行对比,进而验证三重RT-PCR检测结果的准确性。
2结果与分析
2.1H9和H6亚型AIV的三重RT-PCR反应条件
对M基因、H9与H6亚型AIVHA基因3对特异性引物浓度比例及扩增温度时间等的优化得到三重RT-PCR反应的最佳体系:2×PCR Mix 12.5 μL,H9与H6亚型AIV cDNA共2 μL为模板,特异性引物M-F和M-R(20 pmol/μL)加入量为0.6 μL、特异性引物H9-F和H9-R(20 pmol/μL)的加入量为0.7 μL,特异性引物H6-F及H6-R(20 pmol/μL)的加入量为1 μL,用RNA-free水补足至终体积为25 μL。对退火温度进行梯度优化筛选确定该反应体系的最佳退火温度为53℃。
2.2H9和H6亚型AIV的三重RT-PCR反应条件的验证情况
2.2.1特异性从图1看出,用建立的三重RT-PCR法从H9及H6亚型AIV混合样品分别检测出3条特异性条带,分别为667 bp(通用)、478 bp(H6亚型)及299 bp(H9亚型);对H9N2和H9N6亚型AIV PCR检测的结果仅出现2条特异性条带,片段大小分别为667 bp和299 bp;对H6N2亚型AIV进行扩增仅检测出2条特异性条带,片段大小分别为667 bp和478 bp;对其他亚型AIV仅有1条667 bp的特异性条带,常见的禽病病原体均未扩增出条带。表明,所建立的三重RT-PCR法具有良好的特异性。
2.2.2敏感性从图2看出,对浓度为5×102~5×107拷贝/μL的M基因、H6与H9亚型的AIV均有3条明显的特异性扩增条带,片段大小分别为667 bp、478 bp和299 bp;对浓度小于5×103拷贝/μL的M基因、H6与H9亚型AIV均无扩增条带。由此可见,该法最低能同时检测到质粒模板量为5×103拷贝/μL的M基因、H6与H9亚型AIV。
注:M.DL1000 DNA Marker;1.H9N2+H6;2.H9N6+H6;3.H6N6;4.H6N2;5.H6N8;6.H9N2;7.H9N6;8.H1N2;9.H2N2;10.H3N2;11.H5N1;12.H7N2;13.H10N3;14.H11N3;15.H12N5;16.H14N5;17.H15N9;18.H16N3;19.H4N5;20.IBV;21.ILTV;22.NDV;23.阴性对照。
Note:M.DL1000 DNA Marker;1.H9N2+H6;2.H9N6+H6;3.H6N6;4.H6N2;5.H6N8;6.H9N2;7.H9N6;8.H1N2;9.H2N2;10.H3N2;11.H5N1;12.H7N2;13.H10N3;14.H11N3;15.H12N5;16.H14N5;17.H15N9;18.H16N3;19.H4N5;20.IBV;21.ILTV;22.NDV;23.negative control.
图1 H9和H6亚型AIV的三重RT-PCR特异性
Fig.1 Specificity of H9 and H6 subtype AIV by triplex RT-PCR
注:M为DNA标准DL1000;1~6分别为浓度1.5×107拷贝/μL、2.5×106拷贝/μL、3.5×105拷贝/μL、4.5×104拷贝/μL、5.5×103拷贝/μL和6.5×102拷贝/μL;7.阴性对照。
Note: M, DNA Marker DL1000; the concentration from 1 to 6 is 1.5×107copies/μL, 2.5×106copies/μL, 3.5×105copies/μL, 4.5×104copies/μL, 5.5×103copies/μL and 6.5×102copies/μL, respectively; 7. negative control.
图2 H9和H6亚型AIV的三重RT-PCR敏感性
Fig.2 Sensitivity of H9 and H6 subtype AIV by triplex RT-PCR
2.2.3临床样品检测样品PCR检测的结果显示,有13份样品为H9与H6亚型AIV混合感染阳性,阳性率为8.55%;28份样品能扩增出299 bp的目的条带,为H9Nx AIV,阳性率为18.42%;6份样品能扩增出478 bp的目的条带,为H6Nx AIV,阳性率为3.95%;有18份仅有667 bp的目的条带,是除H6Nx和H9Nx外的其他亚型禽流感病毒。部分活禽市场棉拭子样品PCR检测结果见图3。上述样品检测结果与经典的鸡胚病毒分离鉴定,及其HA基因和M基因测序结果100%相符。
注:M.DNA标准DL1000;5和7为H6亚型AIV阳性产物;1、9、12和17为H9亚型AIV阳性产物;3和19为H9与H6亚型AIV的阳性产物;8、13和15为其他亚型AIV的阳性产物;其余为阴性产物。
Note: M, DNA Marker DL1000; 5 and 7, positive products of H6 subtype AIV; 1, 9, 12 and 17, positive products of H9 subtype AIV; 3 and 19, positive products of H6 and H9 subtype AIV; 8 ,13 and 15, positive products of other subtype of AIV; the others are negative products.
图3 部分活禽棉拭子样品的RT-PCR检测
Fig.3 Detection of cotton swab samples from some live poultry by RT-PCR
3结论与讨论
自20世纪90年代H9亚型AIV在中国被发现以来,已在全国各养殖区流行,该亚型病毒的流行不仅给中国的家禽业造成严重的经济损失,且可直接感染人(H9N2亚型AIV),给人类带来致病风险,直至目前,其直接感染人病例还在不断出现。H6亚型AIV对家禽呈现低致病性,但是其可跨越种属屏障直接感染人,可在健康人群血清中检测到H6亚型AIV抗体阳性,甚至在2013年6月中国台湾出现首例人感染H6N1亚型AIV的病例[15]。近年的研究表明,H9和H6亚型LPAIV还可为H7N9和H5N6等HPAIV的重组提供内部基因[16-17],这些“新毒株”已对人类公共卫生的安全构成了严重威胁,已引发全球科学家对H9与H6亚型AIV的密切关注和深入研究。
近年来,广西壮族自治区兽医研究所持续多年对广西地区家禽中LPAIV流行情况的监测发现,广西家禽中LPAIV感染比例较高的是H9亚型AIV,H6亚型AIV也经常在鸭和鹅中被检测到,该结果与华东地区等中国其他地区LPAIV的监测结果[18-20]基本一致。由于LPAIV在家禽体内多以混合感染形式存在,且多数病毒对家禽的致病性不强,临床症状及剖检病变极其相似,肉眼和常规方法难以快速准确地鉴别诊断。目前,对于H9与H6亚型AIV的混合感染主要采用传统的病毒分离及血清学方法进行鉴定,该方法不仅耗时且准确性难保证,迫切需要建立一种快速有效地检测及鉴别H9与H6亚型AIV的方法,为2种亚型AIV的快速准确鉴别提供可靠的技术支撑。
通过软件设计针对H9与H6亚型AIVHA基因及M基因的特异性引物,经过对不同引物组合进行试验筛选得到扩增效果较好的1个引物组合,然后对反应体系中引物浓度、引物比例、退火温度和扩增时间进行优化,最终建立可同时检测H9与H6亚型AIV的方法。该方法只能特异性扩增出H9与H6亚型AIVHA基因及M基因,不能检测出其他亚型AIVHA基因及其他常见家禽病原的核酸。敏感性试验结果表明,该方法最低能检测到量为5×103拷贝/μL的3种质粒的模板。另外,不同地区采集的152份临床样品的检测结果也表明,其与病毒分离及测序结果完全相符。综上,研究已成功建立了一种能够同时检测H9与H6亚型AIV三重RT-PCR方法,一次PCR反应便可同时确定样品中H9与H6亚型AIV的混合感染及单一感染情况,该方法具有特异性强、快速简便及易操作等优点,十分适于在基层单位应用推广,有利于畜牧业的健康发展,可为H9与H6亚型AIV的监测及其防控提供技术支撑。
