抑制USP22表达对胶质瘤细胞顺铂耐药的影响
2020-06-02吕和力
吕和力
神经胶质瘤是大脑中最常见的原发性肿瘤,占所有恶性脑肿瘤的80%[1]。化疗是胶质瘤重要的辅助治疗手段之一,但是由于肿瘤存在异质性的问题,病人对化疗药物的敏感性有很大差异,从而影响了治疗效果。顺铂是胶质瘤化疗的重要药物之一,因此探讨胶质瘤的顺铂耐药分子特征,对开发胶质瘤个体化化疗具有参考意义。泛素特异性肽酶22 (ubiquitin specific peptidase 22,USP22)是泛素水解酶家族一个较新的成员,被证实在多种恶性肿瘤的发生、发展和转移中扮演重要角色[2-3]。大量的研究发现USP22在多种肿瘤中表达增高,其异常高表达常预示肿瘤即出现转移或出现化疗耐药[4-5]。其中,李朝晖等[6]检测到USP22基因在胶质瘤细胞中高表达,并且证实USP22基因在胶质瘤细胞的增殖中发挥重要作用。王宛明等[7]发现抑制USP22表达可增加胰腺癌细胞对化疗药物吉西他滨的敏感性。但是,USP22 是否与胶质瘤耐药相关尚未有文献报道。本研究探讨在胶质瘤中USP22的表达是否参与其顺铂耐药,从而发掘胶质瘤顺铂耐药的潜在分子机制,为胶质瘤化疗提供新的理论依据。
1 材料与方法
1.1 材料 人胶质瘤细胞株U251购自中科院上海细胞所。DMEM培养基、胎牛血清购自美国Gibco公司。顺铂(cisplatin)购自美国Sigma公司。USP22单克隆抗体为美国Santa Cruz公司的产品。Lipofectamine 2000试剂、CCK-8试剂盒和Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 诱导顺铂耐药胶质瘤细胞株 参照文献[8],用顺铂剂量梯度爬升筛选方法将U251细胞体外培养10个月,建立顺铂耐受细胞株(U251/CP2)。采用CCK-8方法,测定细胞的顺铂半数抑制浓度(IC50),鉴定所诱导的U251/CP2细胞株的耐药性。
1.2.2 构建USP22沉默表达的细胞株 利用Lipofectamine 2000将USP22-shRNA表达质粒与病毒包装混合质粒共转染至293T细胞,进行病毒包装。收集病毒液后分别感染U251和U251/CP2细胞,polybrene筛选稳定干扰USP22表达的细胞克隆。RT-PCR法检测细胞USP22 mRNA表达水平,鉴定沉默效果。
1.2.3 流式细胞术检测细胞凋亡 转染24 h后,收集细胞。PBS洗涤2次,重悬于500 μL的Binding Buffer溶液中,细胞筛过筛,加入5 μL Annexin Ⅴ和 5 μL PI染色液后混匀,室温下孵育15 min,然后上样至流式细胞仪检测分析凋亡情况。
1.2.4 Western blotting检测USP22蛋白水平 提取细胞总蛋白质,BCA法检测蛋白浓度后取等量蛋白上样,10% SDS-PAG/E恒压电泳分离蛋白,然后恒流电转至PVDF膜,5%脱脂牛奶室温封闭1 h,USP22一抗和GAPDH内参4 ℃孵育过夜,PBST洗膜后,二抗37 ℃孵育1 h,采用凝胶成像系统成像,利用图像分析软件进行分析。
1.2.5 CCK-8检测顺铂IC50取对数生长期的细胞消化后制备成细胞悬液,以2×104/mL密度接种于96孔板,每孔100 μL,贴壁过夜。不同分组设3个复孔,培养24 h后,每孔加入10 μL CCK-8溶液,孵育3 h,酶标仪测定450 nm处的吸光度,绘制曲线,计算顺铂IC50。
1.3 统计学方法 采用t检验、单因素方差分析及q检验。
2 结果
2.1 顺铂耐药细胞株U251/CP2的建立 经历持续10个月的诱导,获得在顺铂(2 μg/mL)中生长良好的耐药细胞U251/CP2。与亲本细胞相比,U251/CP2形态略有变化,表现为胞体较小,轴突较短且未分叉(见图1)。CCK-8法检测亲本细胞U251和耐药细胞U251/CP2对顺铂的敏感性差异有统计学意义(P<0.01),显示U251/CP2顺铂耐药;U251/CP2细胞无药培养2周后,IC50为(71.68±0.49) μg/mL,耐药性未见降低(P>0.05),说明U251/CP2对顺铂稳定耐药(见表1)。

表1 耐药细胞U251/CP2的耐药性检测
q检验:与对照组U251比较**P<0.01
2.2 USP22沉默细胞株U251-shUSP22、U251/CP2-shUSP22的建立 RT-PCR检测U251组、U251/CP2组、U251-shUSP22组和U251/CP2-shUSP22组细胞中USP22 mRNA的相对表达量分别为0.80±0.10、0.29±0.02、0.12±0.05、0.18±0.05。与U251组相比,U251-shUSP22组的USP22 mRNA表达水平明显降低(t=10.49,P<0.01);与U251/CP2组相比,U251/CP2-shUSP22组的USP22 mRNA表达水平也明显降低(t=3.44,P<0.05),说明成功干扰USP22基因沉默表达(见图2)。
2.3 抑制USP22表达促进胶质瘤细胞凋亡 流式细胞仪检测U251组、U251-shUSP22组、U251/CP2组和U251/CP2-shUSP22组的细胞凋亡率分别为(4.13±0.59)%、(23.64±4.82)%、(7.65±0.73)% 和(19.36±5.49)%;与U251组相比,U251-shUSP22组细胞凋亡率明显升高(t=6.96,P<0.01);与U251/CP2组相比,U251/CP2-shUSP22组的细胞凋亡率同样也明显升高(t=3.66,P<0.05);提示抑制USP22的表达可以显著提高胶质瘤细胞的凋亡率(见图3)。
2.4 顺铂促进胶质瘤细胞中USP22蛋白的表达 Western blotting检测发现0 μg/mL、0.5 μg/mL、8 μg/mL顺铂短暂处理(24 h)后U251细胞内USP22蛋白相对表达量分别为0.21±0.02、0.30±0.01、0.64±0.01,U251/CP2细胞2 μg/mL顺铂短暂处理(24 h)后USP22蛋白相对表达量为0.43±0.02(见图4)。与对照U251(0 μg/mL)组相比,USP22蛋白表达水平在U251(0.5 μg/mL)组、U251(8 μg/mL)组和U251/CP2(2 μg/mL)组中均明显提高(t=9.70、40.35、14.60,P<0.01)。提示顺铂用药可影响胶质瘤细胞中USP22的表达。
2.5 USP22表达下调增强胶质瘤细胞对顺铂的敏感性 与对照细胞U251相比,U251-shUSP22中USP22的蛋白表达水平明显下调(t=6.83,P<0.01)(见图5)。同时,U251-shUSP22的顺铂IC50为(0.56±0.07) μg/mL,与U251的顺铂IC50 (1.23±0.13) μg/mL差异有统计学意义(t=7.70,P<0.01)。提示下调USP22表达可增强胶质瘤细胞对顺铂的敏感性。
2.6 USP22表达下调可部分逆转耐药细胞株对顺铂耐药 与对照细胞U251/CP2相比,U251/CP2-shUSP22中USP22蛋白表达水平显著下调(t=3.01,P<0.05)(见图6)。U251/CP2的顺铂IC50为(73.73±2.74) μg/mL,而U251/CP2-shUSP22的顺铂IC50下降至(51.25±1.09) μg/mL(P<0.01) (见表2),提示USP22表达下调,可逆转耐药细胞株U251/CP2对顺铂的耐药。U251与U251/CP2-shUSP22的顺铂敏感性差异有统计学意义(P<0.01),说明USP22表达下调可在一定程度上逆转U251/CP2对顺铂耐药,但并非完全逆转。
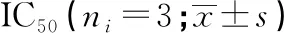
表2 CCK-8检测各组细胞的顺铂
q检验:与对照组U251比较**P<0.01
3 讨论
胶质瘤是最常见的原发性中枢神经系统肿瘤,恶性程度高,侵袭性强,易复发,治疗相当困难。目前临床常用的治疗胶质瘤推荐方案包括替莫唑胺(TMZ) 剂量密度方案、联合治疗方案、抗血管生成治疗等。替莫唑胺为常用抗肿瘤药物,可通过阻断DNA合成,发挥抗肿瘤作用,控制病情进展。但是,并非所有病人均对替莫唑胺敏感,比如,O6-甲基鸟嘌呤-DNA 甲基转移酶高表达病人易对烷化剂类产生耐药性[9]。有学者[10]指出采用替莫唑胺与铂类药物联合治疗复发性恶性肿瘤效果更优,可有效改善病人临床症状,控制癌灶扩散,延长病人生存时间。
顺铂是临床上最常用的铂类药物,主要作用靶点就是DNA,通过在细胞内形成铂-DNA加合物抑制DNA的复制和转录,是临床治疗多种实体瘤的重要药物,也是对胶质瘤敏感性较高的药物之一[11-12]。以抑制DNA合成的抗肿瘤药物,同时会使细胞启动防止其自身凋亡的多种修复机制来修复损伤的DNA,比如激活各种DNA修复酶使受损伤的DNA尽量恢复其结构和功能,从而尽量维持其正常的结构和功能,从而降低了该药物的临床疗效,使得肿瘤对该药物产生耐药性[13]。
胶质瘤的化疗耐药机制十分复杂,涉及到多方面因素,比如肿瘤细胞内药物的积聚减少、药物作用靶点减少、凋亡与抗凋亡机制失衡、DNA修复机制及肿瘤干细胞等。TABATABAI等[14]从胶质瘤中分离出胶质瘤干细胞(glioma stem cell,GSC)并发现胶质瘤细胞和GSC均具有多药耐药现象,以GSC更为显著。无论在体内还是体外GSC基本处于休眠状态,停滞于细胞周期中的G0/G1期并且高表达ABCG2、MDR等耐药基因。GSC能特征性表达ABC转运体,能将多种化疗药物转运出细胞外,从而对化疗药物产生耐药性[15]。另外,胶质瘤的耐药性还可能与高表达的MGMT、抗凋亡蛋白和凋亡蛋白抑制因子有关。崔磊等[16]利用芯片-基因组杂交技术筛选胶质瘤细胞中与顺铂耐药相关分子标志物,发现与胶质瘤顺铂耐药有关的基因包括CFHR1、CFHR3和IL-7等。但是,USP22基因是否也参与了胶质瘤耐药尚未有研究报道。
USP22基因位于人类17号染色体,编码蛋白产物约66 000,是hSAGA(human Spt-Ada-Gcn5 acetyltransferase)复合物的一个亚单位,是一类去泛素化酶,主要通过去泛素化修饰来调控肿瘤细胞的生长分化、影响细胞周期、转录激活和信号转导等。同时,USP22作为一个肿瘤干细胞标记家族的成员,在细胞周期、DNA转录、肿瘤发生发展进程中发挥重要作用,USP22可能通过细胞周期G1/S转换参与肿瘤耐药[17]。
李朝晖研究团队[6,18]通过多项研究,明确了USP22在胶质瘤细胞中高表达,且验证了USP22通过调节细胞凋亡和细胞周期在胶质瘤细胞的增殖中发挥作用。吕磊等[19]的研究指出沉默USP22可逆转膀胱癌细胞T24对丝裂霉素化疗药的耐药。王宛明等[7]的研究则指出了抑制USP22可逆转胰腺癌细胞SW1990对吉西他滨化疗药的耐药。然而,关于USP22是否参与了胶质瘤细胞耐药目前尚无人研究。
本研究首次探讨USP22表达与胶质瘤细胞顺铂耐药的关系。首先,通过剂量梯度爬升诱导顺铂耐药胶质瘤细胞株U251/CP2,相对于亲本细胞株U251,U251/CP2对顺铂的敏感性显著下降,显示出顺铂耐受。此后,Western blotting检测其中USP22蛋白表达情况,发现在U251/CP2中USP22的表达显著高于U251,提示USP22可能参与了胶质瘤顺铂获得性耐药。因此,本文又采用小干扰RNA沉默U251、U251/CP2细胞的USP22表达,证实抑制USP22表达可降低U251对顺铂的抗药性并可在一定程度上逆转耐药细胞株对顺铂的耐药。
综上所述,本研究发现USP22的表达与胶质瘤U251细胞对顺铂的耐药有相关性,提示USP22可能是胶质瘤顺铂耐药的分子机制之一,为进一步研究胶质瘤顺铂耐药机制提供了新的方向。
