新型美白剂4-(3,5-二甲氧基苯乙基)-1,3-苯二酚的合成及其性能
2020-06-01苏振宁尹志刚樊凯奇钱恒玉张同艳王瑞娟余述燕
苏振宁,尹志刚,王 璞,樊凯奇,钱恒玉,张同艳,王瑞娟,余述燕
(1.郑州轻工业大学 材料与化学工程学院,郑州 450002; 2.上海璞萃生物科技有限公司,上海 201506)
0 引 言
健康美白肌肤是很多人追求的目标,但人体肌肤暴露在阳光下会使表面产生很多活性氧自由基(reactive oxygen species,ROS)[1],另外,空气中的颗粒物PM2.5、PM10、汽车尾气、工业废气(CO2、CO、SO2、NOx等)、地表臭氧以及烟灰等附着在皮肤表面都会产生ROS[2]。ROS在低浓度水平时,会激活皮肤黑素细胞增殖和酪氨酸酶基因表达,提高黑色素的合成量; ROS浓度蓄积升高会与皮肤细胞发生氧化应激,造成DNA、蛋白质、细胞器的氧化损伤,严重时可造成细胞凋亡或直接死亡,进而破坏皮肤的正常结构,引起皮肤光老化,甚至皮肤结构损伤[3-4]; 而皮肤结构损伤反过来可加剧黑色素在皮肤内部沉积(如黄褐斑、老年斑等),更有甚者可引起细胞癌变(黑色素瘤)或者黑色素细胞受损伤而导致白癜风[5]。
酪氨酸酶是一种含铜元素复合物,属于酚类氧化酶,在微生物、动植物和人体中含量各异[6]。 酪氨酸酶与黑色素形成有着密切联系,人类皮肤色素沉着、黑色素瘤和神经退行性疾病等一系列肌肤问题都与黑色素形成有关[7-8]。 研究发现,酪氨酸酶抑制剂可以明显抑制酪氨酸酶的活性,减少黑色素生成[9-10],这使酪氨酸酶抑制剂成为优良美白成分而被广泛应用于护肤类化妆品中[11-12]。 然而,黑色素可以吸收过滤紫外线保护皮肤细胞不受损伤,而其本身也存在一种微观机制可有效地去除自由基[13](尤其ROS)以降低自由基对细胞的损伤[14-15]。 从这个意义上讲,减少黑色素形成量会削弱皮肤的保护机制,从而影响ROS清除。
综上,面对健康美白肤色需求,结合日常生活中无法避免的ROS环境,在使用美白剂注重美白效果的同时,也要兼顾ROS对皮肤的不良影响,减轻或者消除这种影响就需要引入抗氧化剂,以应对外源性ROS效应,弥补内源黑色素自身消除ROS机制的缺失。 因此,“酪氨酸酶抑制剂在具有酪氨酸酶活性抑制作用的同时,必须具有抗氧化性”,这样才能够使开发的美白产品避免出现“白癜风”斑点隐患。 研究发现,很多白藜芦醇衍生物不仅具有良好美白效果,还具有抗氧化性能[16-17],如白藜芦醇(Resveratrol)、氧化白藜芦醇(oxyresveratrol)、苯乙基间苯二酚(phenylethyl resorcinol)等(图1a—c)。 Kim等[18]设计合成了一些白藜芦醇类似物,并研究了其抗氧化性能,结果发现,带甲氧基的白藜芦醇类似物优于白藜芦醇本身或其他白藜芦醇类似物。 另有文献报道,将白藜芦醇苯环上酚羟基甲基化可以增加化合物的脂溶性,有利增强其对细胞的透膜能力[19]。 二苯乙烯是白藜芦醇的基本结构,Roldos等[20]、Cardile等[21]和Kageura等[22]将其双键还原为单键,得到一批具有较高生物活性的化合物。

图1 白藜芦醇、氧化白藜芦醇、苯乙基间苯二酚和目标分子的结构式Fig.1 Structures of resveratrol,oxyresveratrol,phenylethyl resorcinol and TM
本文详细研究了白藜芦醇及其衍生物的结构与生物活性[23-24],在此基础上设计合成了一种新型美白剂4-(3,5-二甲氧基苯乙基)-1,3-苯二酚(图1d),并应用DPPH自由基清除、酪氨酸酶活性抑制等实验评价了合成产物的抗氧化性和对酪氨酸酶的抑制活性。
1 材料与方法
1.1 试剂与仪器
主要试剂: 2,4-二羟基苯甲醛(99%)、3,5-二甲氧基苄溴(97%)、苄溴(98%)、亚磷酸三乙酯(98%)、甲醇钠(99%)、Pd/C(5%Pd)、THF(99.5%)、DMF(99.8%)、DPPH(96%)、酪氨酸酶(25 000 U)、L-多巴(99%)、L-酪氨酸(99%)、DMSO-d6(99.9%),均为上海麦克林生化科技有限公司生产; 无水碳酸钾(99%)、无水硫酸钠(99%)、NH4Cl(99.5%)、磷酸二氢钠(99%)、磷酸氢二钠(99%)均为天津市科密欧化学试剂有限公司生产; 乙腈(99%)、乙酸乙酯(99%)、甲醇(99%)、丙酮(99%)、甲苯(99%)均为天津津东天正化学试剂有限公司生产。
主要仪器: Thermo Fisher Orbitrap质谱仪、Thermo Fisher Nicolet红外光谱仪,赛默飞世尔科技有限公司; BrukerAvance 400核磁共振仪,德国Bruker公司; TU-1900紫外可见分光光度计,北京普析通用仪器有限公司; RE-2000E旋转蒸发仪、FSA-6B循环真空水泵,郑州长城科工贸有限公司。
1.2 美白剂4-(3,5-二甲氧基苯乙基)-1,3-苯二酚的合成
1.2.1 2,4-二苄氧基苯甲醛(中间体Ⅰ)的合成 室温下,在100 mL三口瓶中加入无水乙腈37.5 mL,搅拌下加入2,4-二羟基苯甲醛7.5 g(54.35 mmol)、无水碳酸钾9.01 g、苄溴9.76 g(57.08 mmol)后,搅拌1 h,将反应混合物缓缓升温至82 ℃,继续搅拌5 h。 冷却至室温,将反应混合物倒入冰水中,用乙酸乙酯(3×25 mL)萃取,合并萃取液,经水洗、无水硫酸钠干燥,蒸馏回收乙酸乙酯,干燥至恒重,得到白色固体产品(中间体Ⅰ)14.50 g,收率84%。
中间体Ⅰ:m.p. 95~97 ℃;1H-NMR(400 MHz,DMSO-d6)δ: 10.25 (d,J=0.8 Hz,1H,CHO),7.70 (d,J=8.8 Hz,1H,Ar-H),7.42 (m,10H,Ar-H),6.92 (d,J=2.4 Hz,1H,Ar-H),6.75 (dd,J=8.8,1.6 Hz,1H,Ar-H),5.28 (s,2H,CH2),5.22 (s,2H,CH2);13C-NMR(100 MHz,DMSO-d6)δ: 187.61,165.52,162.62,136.83,136.66,130.35,129.02,128.99,128.61,128.48,128.44,128.01,119.04,108.13,100.84,70.29,40.57,40.36,40.15,39.94,39.74,39.53,39.32。
1.2.2 3,5-二甲氧基苯甲基膦酸二乙酯(中间体Ⅱ)的合成 室温下,在100 mL三口瓶中加入3,5-二甲氧基苄溴14.00 g(60.58 mmol)、亚磷酸三乙酯20.13 g(121.16 mmol),搅拌,将反应混合物缓慢加热至135 ℃,保持12 h,反应完全后于90 ℃减压蒸馏,回收剩余的亚磷酸三乙酯,得到棕色液体产品(中间体Ⅱ)15.72 g,收率90%。
中间体Ⅱ:1H-NMR(400 MHz,DMSO-d6)δ: 6.49(t,J=2.4 Hz,2H,Ar-H),6.40(dd,J=4.4,2.4 Hz,1H,Ar-H),3.98 (m,4H,CH2),3.74(s,6H,CH3),3.19(t,J=11.6 Hz,2H,CH2),1.20 (m,6H,CH3);13C-NMR(100 MHz,DMSO-d6)δ: 160.8,160.7,134.8,134.7,108.3,108.2,98.7,98.6,61.8,61.7,55.4,33.6,32.3,16.5,16.4。
1.2.3 (1E)-(2,4-二苄氧基)-2-(3,5-二甲氧基)苯乙烯(中间体Ⅲ)的合成 在150 mL三口瓶中加入甲醇钠1.47 g,0 ℃时在氮气保护条件下,加入中间体Ⅱ(6.52 g,22.62 mmol)与THF(30 mL)的混合溶液,室温下搅拌1 h,在0 ℃条件下,缓慢加入中间体Ⅰ(7.20 g,22.64 mmol)与THF(30 mL)的混合溶液,搅拌至反应完全(12 h),将反应混合物倒入冷却(0 ℃)的饱和NH4Cl溶液中,搅拌30 min,分出有机相,水层用(3×25 mL)乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,回收溶剂,得到棕色液体产品(中间体Ⅲ)7.84 g,收率85%。
中间体Ⅲ:1H-NMR(400 MHz,DMSO-d6)δ: 7.41(m,12H,Ar-H),7.09(m,1H,Ar-H),6.82(d,J=2.4 Hz,1H,Ar-H),6.68(dd,J=8.8,2.4 Hz, 1H,Ar-H),6.65(d,J=2 Hz,2H,Ar-H),6.41(t,J=2 Hz,1H,Ar-H),5.21(s,2H,CH2),5.13(s,2H,CH2) 3.76(s,6H,CH3);13C-NMR(100 MHz,DMSO-d6)δ: 161.14,159.80,157.35,140.41,137.60,137.26,128.94,128.91,128.37,128.33,127.89,119.29,107.29,104.19,101.30,99.77,70.17,69.59,55.60,40.69,40.40,40.20,39.99,39.78,39.57,39.26。
1.2.4 4-(3,5-二甲氧基苯乙基)-1,3-苯二酚(TM)的合成 在100 mL三口瓶中加入中间体Ⅲ(3 g,6.63 mmol),甲醇丙酮混合溶剂(V/V=1/4)50 mL,5% Pd/C 0.61 g,密闭反应体系,氮气置换3次后通入氢气,缓慢加热到60 ℃,开始氢化,常压条件下反应至体系不再吸收氢气。 过滤,滤饼用(3×25 mL)上述甲醇丙酮混合溶剂萃取,回收催化剂,萃取液合并,回收溶剂,残留物经柱层析纯化,得到黄色透明液体,加入100 mL丙酮中,搅拌30 min,过滤,干燥至恒重,得到米白色固体产品1.31 g,收率72%。
4-(3,5-二甲氧基苯乙基)-1,3-苯二酚:m.p. 76~78 ℃。IR (KBr),v/cm-1:3 132,2 925,1 615,1 521,1 431,1 144,815。1H-NMR(400 MHz,DMSO-d6)δ: 6.81(d,J=8 Hz,1H,Ar-H),6.34(m,4H,Ar-H),6.16(dd,J=8,2.4 Hz,1H,Ar-H),3.31(s,6H,OCH3),2.72(m,4H,CH2)。 HRMS (ESI) calcd for C16H18O4[M+H]+274.120 5,found 275.115 0。
1.3 DPPH自由基清除活性测定
通过测定二苯基苦基苯肼 (DPPH)自由基的清除能力评价4-(3,5-二甲氧基苯乙基)-1,3-苯二酚(TM)的抗氧化活性,并将3种常见美白剂苯乙基间苯二酚(Phenylethyl Resorcinol,PR)、α-熊果苷(Alpha-Arbutin,AA)、光甘草定(Glabridin,GLA)作为阳性对照。 参照Mensor等[25]的方法,用无水乙醇将TM和PR、AA、GLA分别配制成不同浓度的溶液作为待测液,DPPH用无水乙醇配置成0.2 mmol/L的溶液。 在3 mL测活体系中,依次加入1 mL待测液、2 mL DPPH溶液,1 mL待测液、2 mL无水乙醇,1 mL无水乙醇、2 mL DPPH溶液,于比色皿中混合均匀,静置30 min,分别测定3组体系517 nm处的吸光度Ai、Aj、Ao,每组测定3次取平均值,并计算清除率
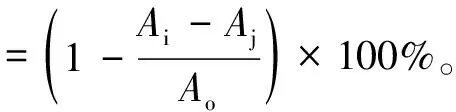
1.4 酪氨酸酶抑制活性测定
对酪氨酸酶的活性抑制作用包括对单酚酶和二酚酶的抑制,参考文献[26],对4-(3,5-二甲氧基苯乙基)-1,3-苯二酚(TM)的酪氨酸酶活性抑制作用作出评价,并将3种常见美白剂苯乙基间苯二酚(phenylethyl resorcinol,PR)、α-熊果苷(alpha-arbutin,AA)、光甘草定(glabridin,GLA)作为阳性对照。 以L-酪氨酸为底物,探究目标化合物对酪氨酸酶单酚酶的抑制作用; 以L-多巴为底物,探究目标化合物对酪氨酸酶二酚酶的抑制作用。 配制pH=6.8、0.5 mol/L的PBS缓冲液,将TM和PR、AA、GLA分别溶解于DMSO中,用PBS缓冲液稀释至不同浓度作为待测液,DMSO浓度为3%,酪氨酸酶利用PBS缓冲液配制为酶活力为50 U/mL的溶液,利用PBS缓冲液将L-酪氨酸和L-多巴分别配制为6、0.5 mmol/L的溶液作为底物溶液。 在3 mL测活体系中,依次加入0.5 mL底物溶液、0.5 mL待测溶液、1.5 mL PBS缓冲液、0.5 mL酪氨酸酶溶液,0.5 mL底物溶液、0.5 mL待测溶液、2 mL PBS缓冲液,0.5 mL底物溶液、2 mL PBS缓冲液、0.5 mL酪氨酸酶溶液,0.5 mL底物溶液、2.5 mL PBS缓冲液,于比色皿中混合均匀(需加有酶溶液的体系,在30 ℃恒温水浴锅中水浴15 min后,再加入酶溶液),分别测定4组体系475 nm处的吸光度A1、A2、A3、A4,每组测定3次取平均值,并计算酪氨酸酶抑制率:

2 结果与讨论
2.1 4-(3,5-二甲氧基苯乙基)-1,3-苯二酚的合成设计
通过对白藜芦醇衍生物的研究,确定了目标化合物TM的结构,即4-(3,5-二甲氧基苯乙基)-1,3-苯二酚。 本文采用逆合成分析法[27-30]得出合成TM所需要的起始中间体及相关原料:将TM添加官能团[28],变成中间体A(图2),对A进行双键切断[29]得到两类合成子(Synthon):2,4-二羟基苯甲叉基片段(Synthon 1和Synthon 3)和3,5-二甲氧基苯甲叉基片段(Synthon 2和Synthon 4)。
双键主要通过Wittig[31]、Grignard[32]及Wittig-Horner[33]反应构建。 Wittig 反应副产物三苯基磷氧化物难以除去,造成分离提纯困难,且所用的三苯基膦对环境污染较大; Grignard反应中,金属镁需要特殊处理,步骤复杂,在制备Grignard试剂时会因其自身偶联导致副产物增加; 相比之下,Wittig-Horner反应是用亚磷酸三乙酯代替三苯基膦制得磷叶立德,磷酸酯碳负离子的亲核性很强,在温和条件下即可与多种醛、酮进行亲核加成; 反应生成的副产物磷酸盐[(RO)2POO]-Na+易溶于水,使之极易从反应混合体系中迅速分离,后处理相对更为简单,因此Wittig-Horner反应更适合于化合物A的合成[34-35]。
通过以上分析,暂时得出Synthon 1~4分别对应等效化合物B、Ⅱ、Ⅳ、Ⅴ(图2a)。 经过结构分析,化合物B为一种常见原料,可直接购得; 化合物Ⅱ则可通过亚磷酸三乙酯与市售化合物C合成得到; 化合物Ⅳ因无法形成所需要的磷酸酯碳负离子(磷酸酯碳负离子的亲核性很强,酚羟基氢原子不能与之共存),而被舍弃; 化合物Ⅴ实际存在,因化合物Ⅳ无法形成对应的碳负离子,无研究价值。 由此确定由化合物B与化合物Ⅱ进行反应,但化合物B上的酚羟基依旧会对由化合物Ⅱ形成的磷叶立德结构产生干扰,为此,对化合物B分子中的酚羟基应该加以保护,结合中间产物A合成过程中的催化氢化影响,选择形成二苄基醚来保护羟基[36-37]。 由此形成TM最终合成路线(图2b)。

图2 目标分子的逆合成分析与合成路线Fig.2 Reverse synthetic analysis and synthesis of TM
2.2 合成工艺探讨
2.2.1 中间体Ⅰ合成条件确定 中间体Ⅰ的合成过程为酚羟基经苄基醚保护的过程,参考文献[38-39],合成过程可以按照SN2过程进行: 2,4-二羟基苯甲醛与碳酸钾作用形成芳氧基负离子,再从溴原子背面进攻苄溴中心碳原子,形成取代产物; 也可以按照SN1历程进行: 即2,4-二羟基苯甲醛与碳酸钾作用形成的芳氧基负离子与苄溴解离的苄基正离子直接作用形成苄基醚(保护基)。 故该合成过程中反应速率及收率与苯氧负离子、苄溴碳正离子的浓度都有很大关系。 本文考察了溶剂种类、投料比、碳酸钾用量等因素对中间体Ⅰ收率的影响,结果见表1~3。

表1 溶剂种类对中间体Ⅰ收率的影响Table 1 Effect of kinds of solvent on the yield of Intermediate Ⅰ
注:n(2,4-二羟基苯甲醛)∶n(苄溴)∶n(碳酸钾)=1.00∶1.00∶1.00,反应时间6 h,反应温度82 ℃; *作溶剂为回流反应。

表2 反应物投料比对中间体Ⅰ收率的影响Table 2 Effect of ratio of reagents on the yield of Intermediate Ⅰ
注:n(2,4-二羟基苯甲醛)∶n(碳酸钾)=1.00∶1.00,反应时间6 h,反应温度82 ℃。

表3 无水碳酸钾用量对中间体Ⅰ收率的影响Table 3 Effect of dosage of potassium carbonate on the yield of Intermediate Ⅰ
注:n(2,4-二羟基苯甲醛)∶n(苄溴)=1.0∶1.05,反应时间6 h,反应温度82 ℃。
由表1可知,丙酮作溶剂时中间体Ⅰ产率很低(27.80%),这是因为丙酮沸点仅56.5 ℃,即使回流反应,温度较低,反应不充分。 乙腈与DMF作溶剂时中间体Ⅰ的收率较高,分别为73.1%、79.5%,但使用DMF作溶剂时,后处理过程繁琐,产品中易夹带溶剂,不易除净,因此后续实验中均选择乙腈作为反应溶剂。
由表2可知,苄溴比例增加,中间体Ⅰ收率有所提高,但不太明显,苄溴易挥发,且对眼睛具有较强刺激性,结合经济因素,选择投料比为n(2,4-二羟基苯甲醛)∶n(苄溴)=1.00∶1.05比较合适。
由表3可知,随着无水碳酸钾用量的增加,中间体Ⅰ收率先增后降,主要原因是碳酸钾用量增加,酚氧基负离子增多有利于反应发生,但碳酸钾过多时,酚氧基负离子可能与自身醛基发生反应,形成副产物。 因此,选择碳酸钾的用量为n(2,4-二羟基苯甲醛)∶n(碳酸钾)=1.0∶1.2较为适宜。
2.2.2 中间体Ⅱ合成条件确定 亚磷酸三乙酯常温常压下为液体,因此在合成中间体Ⅱ过程中,使用过量亚磷酸三乙酯作为溶剂,有利于3,5-二甲氧基溴苄的完全反应。 合成反应为典型的Arbuzov重排反应[40],一般要求较高反应温度与较长反应时间。 因此,本文主要考察了反应温度、反应时间对中间体Ⅱ收率的影响,结果见表4~5。

表4 反应温度对中间体Ⅱ收率的影响Table 4 Effect of temperature on the yield of Intermediate Ⅱ
注: 反应时间8 h。

表5 反应时间对中间体Ⅱ收率的影响Table 5 Effect of reaction time on the yield of Intermediate Ⅱ
注: 反应温度135 ℃。
由表4可知,中间体Ⅱ收率随着温度的升高有所提高,但不太明显,温度高使热能损耗增加,工业化成本就越高; 温度过高还会影响回流平稳状态,生成的溴乙烷气体容易冲料,综合考虑,选择反应温度为135 ℃。
由表5可知,收率随着反应时间延长而提高,但是当反应时间达到12 h时,继续延长时间,收率提高不太明显,同时,高温反应持续时间越长热能损耗也越多,考虑工业化成本,选择反应时间为12 h比较合适。
2.2.3 中间体Ⅲ合成条件确定 中间体Ⅲ的合成过程中,中间体Ⅱ中与磷原子直接相连的亚甲基在强碱甲醇钠(大部分文献采用氢化钠作为碱)作用下,脱去质子,生成碳负离子,接着与中间体Ⅰ醛基发生亲核加成反应,其加成产物消除磷酸二乙酯形成中间体Ⅲ(一种烯烃)。 考察了溶剂种类、中间体Ⅰ与中间体Ⅱ不同投料比以及碱用量对中间体Ⅲ收率的影响,结果见表6~8。

表6 溶剂种类对中间体Ⅲ收率的影响Table 6 Effect of kinds of solvent on the yield of Intermediate Ⅲ
注:n(Ⅰ)∶n(Ⅱ)∶n(NaOMe)=1.00∶1.00∶1.00,反应温度0 ℃,反应时间12 h。

表7 反应物投料比对中间体Ⅲ收率的影响Table 7 Effect of ratio of reagents on the yield of Intermediate Ⅲ
注:n(Ⅰ)∶n(甲醇钠)=1.00∶1.00,反应温度0 ℃,反应时间12 h。

表8 甲醇钠用量对中间体Ⅲ收率的影响Table 8 Effect of dosage of sodium methoxide on the yield of Intermediate Ⅲ
注:n(Ⅰ)∶n(Ⅱ)=1.00∶1.05,反应温度0 ℃,反应时间12 h。
由表6可知,甲苯作溶剂时,收率较低,主要原因在于甲醇钠不溶于甲苯,致使碳负离子浓度很低,因此产率较低。 相比之下,THF与DMF作为溶剂时,中间体Ⅲ的收率较高,分别为78.1%和80.2%,但DMF作溶剂时,处理过程繁琐,产品中易夹带溶剂而不易除净,因此后续实验中均选择THF作为反应溶剂。
由表7可知,随着中间体Ⅱ比例增加,一定程度上会提高反应收率,但提高幅度不太明显,且中间体Ⅱ合成原料较为昂贵,综合考虑,本文选择投料比为n(Ⅰ)∶n(Ⅱ)=1.00∶1.05。
由表8可知,随着甲醇钠用量的增加,反应收率先增后降,可能是由于甲醇钠过量会破坏中间体Ⅱ的结构,因此选择甲醇钠的用量为n(Ⅰ)∶n(甲醇钠)=1.0∶1.2。
2.2.4 目标化合物(TM)合成条件确定 将中间体Ⅲ中苄基脱去,同时将苯环之间的乙烯双键还原为单键。 催化氢化脱苄基反应用5% Pd/C作催化剂,在温和条件下即可实现,且不会对原料中甲氧基造成影响。 此类型反应多为吸热和分子数增加的反应,较高温度和较低压力对反应有利,用Pd/C、H2脱苄基同时会将乙烯双键还原,简化了合成工艺[41]。 实验发现,溶剂的极性、反应温度与催化剂用量对催化氢化反应的影响非常大。 因此,考察了溶剂种类、反应温度及催化剂用量对收率的影响,结果见表9~11。

表9 溶剂种类对TM收率的影响Table 9 Effect of kinds of solvent on the yield of TM
注:m(5%Pd/C)∶m(Ⅲ)=1∶2,反应温度50 ℃,反应时间12 h。

表10 反应温度对TM收率的影响Table 10 Effect of temperature on the yield of TM
注: 溶剂为丙酮/甲醇(V/V=4/1),m(5%Pd/C)∶m(Ⅲ)=1∶2,反应时间12 h。

表11 催化剂用量对中间体TM收率的影响Table 11 Effect of dosage of Pd/C on the yield of TM
注: 反应温度60 ℃,反应时间12 h。
由表9可知,随着混合溶剂中丙酮用量增加,目标产物收率提高,这可能是因为原料在丙酮中溶解性较大,混合溶剂中加入丙酮提高了原料的溶解,产物的收率增大。 但当丙酮与甲醇体积比超过4∶1时,TM收率反而下降, 这可能是由于丙酮用量过大,会被催化氢化,造成催化剂额外消耗,因此本文选择混合溶剂丙酮/甲醇=4/1(体积比)作为后续研究的反应溶剂。
由表10可知,随着反应温度的升高,TM收率也逐渐升高,60 ℃以后,收率升高幅度趋于平缓,因此本文选择反应温度为60 ℃。
由表11可知,随着催化剂用量增加,TM收率也随之增高,当催化剂用量为m(5%Pd/C)∶m(Ⅲ)=1.00∶10.0时,TM收率最高,达到71.8%,继续增加催化剂用量,TM收率增高的幅度较小,考虑经济成本,本文选择催化剂用量为m(5%Pd/C)∶m(Ⅲ)=1.00∶10.0。
2.2 性能研究
2.2.1 目标化合物(TM)对DPPH自由基的清除作用 TM与阳性对照组清除DPPH自由基的IC50如表12所示,清除DPPH自由基能力的强弱顺序为:TM>PR>AA>GLA,PR、AA、GLA作为现在市场上美白效果较为优良的美白剂,都表现出较强的DPPH自由基清除活性。 即具有较强的抗氧化性,TM经过与这几种美白剂进行对比,表现出更强的抗氧化性。
2.2.2 目标化合物对酪氨酸酶活性的抑制作用 以L-酪氨酸为底物时,TM与阳性对照组对酪氨酸酶单酚酶抑制活性的IC50见表13。 TM与阳性对照组对酪氨酸酶单酚酶都表现为抑制作用。抑制活性强弱顺序为:TM>GLA>PR>AA,通过对比,证明了TM对酪氨酸酶单酚酶优良的抑制活性。

表12 TM对DPPH自由基的清除效应Table 12 Effects of synthetic products on DPPH free radical scavenging

表13 TM对酪氨酸酶单酚酶抑制效应Table 13 Effects of synthetic products on the monophenolase activity of mushroom tyrosinase
以L-多巴为底物时,TM与阳性对照组对酪氨酸酶二酚酶抑制活性的IC50见表14。 TM与阳性对照组中PR、GLA对酪氨酸酶二酚酶都表现为抑制作用,抑制活性由强到弱的顺序为:GLA>TM>PR,而AA没有抑制活性,对酪氨酸酶二酚酶表现为激活作用。 通过对比,也证明了TM对酪氨酸酶二酚酶具有比较强的抑制活性。

表14 TM对酪氨酸酶单酚酶抑制效应Table 14 Effects of synthetic products on the diphenolase activity of mushroom tyrosinase
3 结论与展望
本文以2,4-二羟基苯甲醛、3,5-二甲氧基苄溴为原料,设计合成了目标产物4-(3,5-二甲氧基苯乙基)-1,3-苯二酚。 目标产物合成路线简单,虽然用到了氢气,但是在常压状态下进行反应,条件温和、实验操作简便。 经过核磁、质谱等分析方法鉴定,最终产物结构符合目标产物。
经过DPPH自由基清除活性与酪氨酸酶抑制活性测定实验,目标产物与阳性对照组都呈现出较好的DPPH自由基清除活性与较好的酪氨酸酶抑制活性。 在实验过程中,目标化合物清除 DPPH 自由基能力最强,其 IC50为0.011 mmol/L; 对酪氨酸酶单酚酶抑制活性也最强,其 IC50为0.001 37 mmol/L。 苯乙基间苯二酚(PR)、α-熊果苷(AA)、光甘草定(GLA)[42-45]已经被证实是美白效果优良的美白剂,可知,目标化合物不仅具有优良的美白活性,而且同时具备更强的抗氧化性。 4-(3,5-二甲氧基苯乙基)-1,3-苯二酚(TM)的合成为具有酪氨酸酶抑制活性、抗氧化性协同作用的新型美白剂设计合成提供了参考,但能否作为化妆品美白功效成分和药物成分,还需对其细胞毒性作更深入的研究。
