2种养殖模式下蛋鸭大肠埃希菌毒力基因和耐药特征分析
2020-06-01赵燕金俊杰任敏敏侯凤香刘素贞薛成俊肖英平
赵燕,金俊杰,任敏敏,侯凤香,刘素贞,薛成俊,肖英平*
(1.温州市农业科学研究院动物科学研究所,浙江 温州 325000;2.浙江省农业科学院农产品质量标准研究所,杭州 310021;3.苍南县畜牧兽医局,浙江 苍南 325800)
我国传统的水禽养殖模式主要是大水面放养或者是水面圈养,这不仅对水资源造成严重的污染和破坏,也使水禽产业自身的发展受到水资源承载力的约束,同时也给食品安全管控带来严峻的挑战[1]。因此,近年来我国的水禽养殖逐渐转变成了以旱养为主的养殖模式。目前,蛋鸭饲养以蛋鸭舍内地面加水域圈养、网床饲养和笼养等多种养殖模式并存,饲养水平参差不齐,疫病发生情况也存在一定的差异[2]。
大肠埃希菌(Escherichia coli)是革兰氏阴性菌,属于肠杆菌科埃希菌属,是在人和动物肠道中大量分布的一种细菌。鸭大肠埃希菌病是由致病性大肠埃希菌引起的感染性疾病,其主要发病特征为心包炎、肝周炎和急性败血症等。由于大肠埃希菌种类繁多,交叉保护性差,血清型较复杂,给免疫防治带来一定的困难,因此,药物防治是目前控制该病的主要手段[3]。但随着药物大量和不合理的使用,加快了大肠埃希菌耐药性的产生[4-5],不仅影响抗菌药物在兽医临床上的疗效,而且其耐药基因可通过食物链进入人体,对人类的健康安全造成威胁。
目前,对于水禽中大肠埃希菌的研究主要集中于从病料中分离获得大肠埃希菌,开展其致病性和耐药性研究[6-8],而对于从不同养殖模式下健康鸭群体中获得大肠埃希菌,分析其耐药情况的研究甚少。基于此,本文分析比较了在水养与旱养条件下蛋鸭肠道大肠埃希菌的耐药特征,探讨了其耐药基因多态性和遗传多样性,以期为耐药菌株流行病学研究提供理论依据。
1 材料与方法
1.1 实验试剂和仪器
大肠埃希菌分离培养基:缓冲蛋白胨水(buffered peptone water,BPW)、麦康凯培养基、伊红美蓝琼脂培养基、LB琼脂和肉汤(北京陆桥技术股份有限公司)。大肠埃希菌鉴定卡和药敏卡(法国梅里埃公司)。聚合酶链式反应(polymerase chain reaction,PCR)试剂[生工生物工程(上海)股份有限公司]。
烘箱、恒温培养箱(上海一恒科学仪器有限公司);-80℃超低温冰箱(美国Thermo公司);VITEK 2 COMPACT全自动细菌鉴定及药敏分析系统(法国梅里埃公司)。
1.2 样品采集与菌株分离鉴定
在浙江省温州地区分别选择3家网床水面圈养和3家网床全旱养的蛋鸭场,饲养规模均为5 000只左右,蛋鸭为250~300日龄绍兴麻鸭,自由饮水和采食。全旱养蛋鸭饮用相对流动的自来水,水面圈养蛋鸭饮用游泳池水,其中游泳池水按夏天3~5 d、冬天7~9 d更换一次。依据当地小型养殖场的饲养习惯和经验,水面圈养蛋鸭通常在产蛋量下降时使用药物,而全旱养蛋鸭通常每月用药一次,用药方式均为拌料饲喂,常用药物为阿莫西林(β-内酰胺类抗生素)。
从每个鸭场选取10只蛋鸭,用棉拭子采集其直肠中的微生物,置于灭菌的BPW前增菌液中,参照GB 4789.6—2016[9]的方法,分离大肠埃希菌。采用VITEK 2 COMPACT全自动细菌鉴定仪器对分离菌株进行鉴定。质控菌株为大肠埃希菌ATCC25922。
1.3 耐药谱测定
大肠埃希菌的耐药谱采用VITEK 2 COMPACT全自动细菌鉴定及药敏分析系统进行测定。
1.4 基因组DNA提取
采用煮沸法[10]提取大肠埃希菌基因组DNA,用于PCR反应。
1.5 毒力基因检测
以提取的大肠埃希菌基因组DNA为模板,采用GB 4789.6—2016[9]中大肠埃希菌紧密黏附素基因(gene encoding intimin for attaching and effacingEscherichia coli,eae)、侵袭性质粒抗原H基因(invasive plasmid antigen H-gene,ipa H)、侵袭性质粒调节基因(invasive plasmid regulator,invE)、热不稳定性肠毒素基因(heat-labile enterotoxin,lt)、集聚黏附菌毛调节基因(aggregative adhesive fimbriae regulator,aggR)、肠定殖因子基因(protein involved in intestinal colonization,pic)等毒力基因的引物序列(表1)进行PCR扩增。PCR扩增反应程序:95℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共32个循环。PCR产物经1.5%琼脂糖凝胶电泳检测后,在凝胶成像系统上观察扩增结果。

表1 毒力基因引物信息Table 1 Information of virulence gene primers
1.6 耐药基因检测
本实验从9类抗生素耐药基因中共选取23种,包括2种磺胺类基因(sulⅠ和sulⅡ),5种喹诺酮类基因(qnrA、qnrD、qnrS、qepA和oqxB),4种四环素类基因(tetC、tetB、tetK和tetA),3种氯霉素类基因(cmlA、floR和cfr),3种大环内酯类基因(ereA、ermB和mef),2种青霉素类基因(mecA和mecC),1种氨基糖苷类基因(aadA1),3种多黏菌素类基因(pmrA、pmrB和mcr-1)。所用引物信息[11]见表2。PCR扩增反应程序:95℃预变性5 min;94℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共32个循环。PCR产物经1.5%琼脂糖凝胶电泳检测并成像。
针对产超广谱β-内酰胺酶(extended-spectrumβ-lactamases,ESBLs)的大肠埃希菌,特异性地进行β-内酰胺酶基因分析。参照文献[12]设计引物,具体引物信息见表3。
1.7 Ⅰ型整合酶基因和Ⅰ型整合子基因盒检测
以大肠埃希菌基因组DNA为模板,参照文献[6]所述的引物进行PCR扩增:Ⅰ型整合酶基因(Intl)引物为5´-CCTCCCGCACGATGATC-3´和5´-TCCACGCATCGTCAGGC-3´;Ⅰ型整合子基因盒引物为 5´-GGCATCCAAGCAGCAAG-3´和 5´-AAGCAGACTTGACCTGA-3´。PCR 扩增反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃(Intl)或55℃(Ⅰ型整合子基因盒)退火30 s,72℃延伸1 min,共30个循环;最后,72℃再延伸10 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测。

表2 耐药基因引物信息Table 2 Information of drug-resistant gene primers
基因盒插入区PCR扩增产物经电泳分离后,用AxyPrepDNA凝胶回收试剂盒回收纯化,然后连接到pMD18-T载体上并转入到感受态细胞中,送至生工生物工程(上海)股份有限公司测序,测序结果通过在线网站NCBI(https://www.ncbi.nlm.nih.gov)的Blast搜索进行比对分析。

表3 β-内酰胺酶基因引物信息Table 3 Information of β-lactamase gene primers
2 结果与分析
2.1 毒力基因分析
图1为以毒力基因eae为代表的电泳结果。在检测的6个毒力基因中,毒力基因eae、ipa H、pic在网床水面圈养和网床全旱养蛋鸭肠道大肠埃希菌中均有携带,检出率较高的是eae和pic,二者在网床水面圈养和网床全旱养蛋鸭肠道大肠埃希菌的检出率分别为6.67%、10.00%和6.67%、16.67%(图2)。其中,网床全旱养蛋鸭肠道的大肠埃希菌毒力基因eae、ipa H、invE、aggR和pic检出率均高于网床水面圈养蛋鸭,以pic为最高。
图1 eae毒力基因的PCR产物电泳结果Fig.1 Electrophoretogram of PCR products of eae gene

图2 大肠埃希菌的毒力基因检出率Fig.2 Detection percentage of virulence genes in E.coli
2.2 大肠埃希菌耐药表型分析
通过VITEK 2 COMPACT全自动细菌鉴定及药敏分析系统对蛋鸭肠道大肠埃希菌进行分析发现,大肠埃希菌对抗生素表现出不同程度的耐药,特别是对青霉素类、头孢菌素类、单环β-内酰胺类、喹诺酮类和磺胺类抗生素。不同养殖模式下蛋鸭肠道大肠埃希菌的耐药性呈现一定的差异,总体表现为网床全旱养的蛋鸭分离株耐药性强于网床水面圈养,主要体现于氨苄西林(网床全旱养,80%;网床水面圈养,56.67%)、环丙沙星(23.33%,6.67%)、头孢唑啉(20%,10%)、头孢曲松(16.67%,6.67%)、氨曲南(16.67%,6.67%)、左旋氧氟沙星(16.67%,3.33%)、头孢匹美(6.67%,0)、庆大霉素(3.33%,0)和复方新诺明(36.67%,23.33%)。
2种不同养殖模式下蛋鸭大肠埃希菌多重耐药现象普遍存在,其中:在网床全旱养蛋鸭肠道中分离的大肠埃希菌耐药种类较多,耐药性更为复杂,同时耐药数≥3的菌株比例为23.33%;而在网床水面圈养蛋鸭肠道中分离的大肠埃希菌耐药数≥3的菌株比例为10.00%(图3)。
2.3 耐药基因分析
对23种耐药基因进行分析发现,蛋鸭中大肠埃希菌磺胺类药物耐药基因sulⅠ和sulⅡ、喹诺酮类基因qnrA和qnrS、四环素类基因tetA及氨基糖苷类基因aadA1检出率较高,在网床水面圈养和网床全旱养蛋鸭中均在20%以上(图4)。比较分析2种养殖模式下耐药基因的总体检出率发现,网床全旱养总体上高于网床水面圈养。
2.4 β-内酰胺酶耐药基因分析
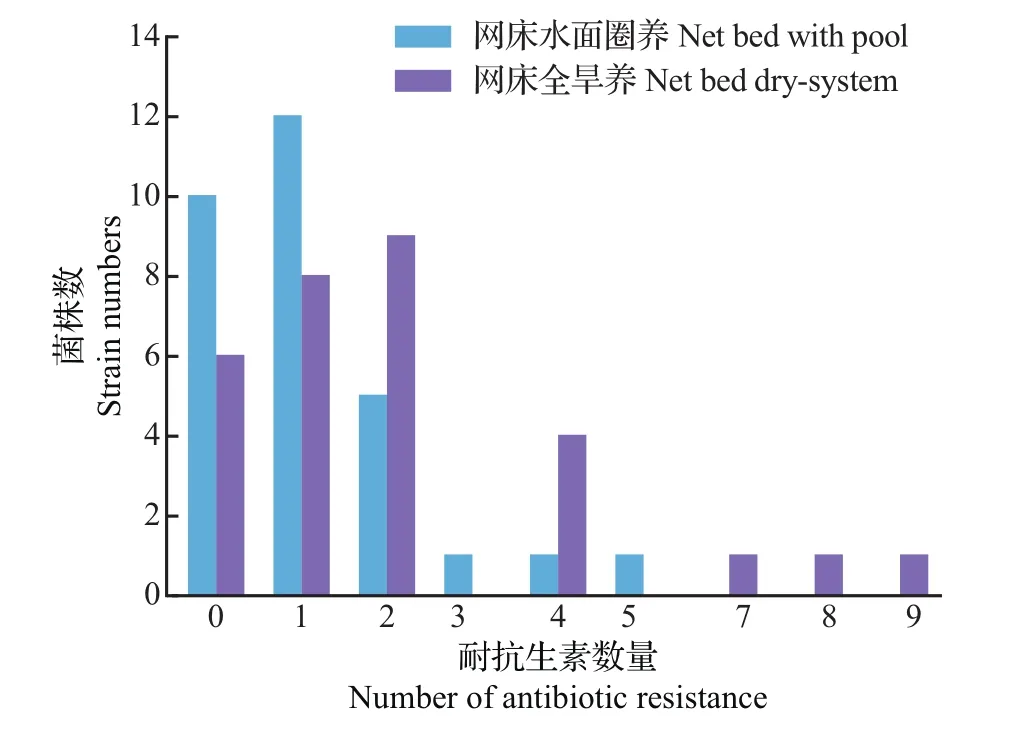
图3 网床水面圈养和网床全旱养蛋鸭中大肠埃希菌耐药菌株分布情况Fig.3 Drug-resistant strains of E.coli in laying ducks under net bed with pool and net bed dry-system
在分离的60株蛋鸭肠道大肠埃希菌中,7株产ESBLs,包括网床水面圈养蛋鸭2株,网床全旱养蛋鸭5株。为了进一步分析其耐药基因携带情况,对所有产ESBLs分离株的β-内酰胺耐药基因进行PCR检测。图5为部分耐药基因CTX-M的电泳结果。从图6可以看出:TEM和CTX-M耐药基因的检出率均为100%(7/7),CTX-M-1、CTX-M-2和CTX-M-9检出率分别为57.14%(4/7)、14.29%(1/7)和71.43%(5/7),未检出SHV、CTX-M-8和CTX-M-25。
2.5 Ⅰ型整合子和基因盒分析
在60株大肠埃希菌中,10株含有Ⅰ型整合子,阳性检出率为16.67%,其中网床全旱养蛋鸭肠道大肠埃希菌Ⅰ型整合子检出率为23.33%,高于网床水面圈养(10.00%)(图7)。

图4 网床水面圈养和网床全旱养蛋鸭中大肠埃希菌耐药基因检出率Fig.4 Detection percentage of drug-resistant genes of E.coli in laying duck under the net bed with pool and net bed dry-system
图5 CTX-M耐药基因的PCR产物电泳结果Fig.5 Electrophoretogram of PCR products of CTX-M gene

图6 ESBLs阳性大肠埃希菌β-内酰胺酶基因检出率Fig.6 Detection percentage of β-lactamase drug-resistant genes in ESBLs-positive E.coli

图7 大肠埃希菌的Ⅰ型整合子检出率Fig.7 Detection percentage of classⅠintegron in E.coli
对10株Ⅰ型整合子阳性大肠埃希菌基因盒扩增产物进行电泳分析发现,4株携带基因盒插入片段,其中:1株来源于网床水面圈养蛋鸭,其大肠埃希菌Ⅰ型整合子基因盒插入的为dfrA12-aadA2;3株来源于网床全旱养蛋鸭,均为dfrA1-aadA1。
3 讨论
通过蛋鸭肠道大肠埃希菌的毒力基因分析发现,水面圈养的毒力基因eae携带率为6.67%、全旱养为10.00%。定殖因子pic使大肠埃希菌粘附于宿主肠黏膜而不被肠蠕动和肠分泌液所清除,是大肠埃希菌致病的首要因素[13]。本研究中网床全旱养蛋鸭肠道大肠埃希菌肠定殖因子基因pic携带率为16.67%,说明蛋鸭携带的大肠埃希菌具有一定的潜在致病性。
本研究对2种不同养殖模式下分离的60株蛋鸭肠道大肠埃希菌的耐药表型分析表明,分离株对氨苄西林、复方新诺明和环丙沙星的耐药率较高,而对头孢西丁、亚氨培南和阿米卡星等抗生素敏感。这些结果与SOUFI等[14]从突尼斯家禽肉中分离出来的大肠埃希菌耐药表型一致。而邓伯雄等[15]对鸭致病性大肠埃希菌耐药研究表明,较为敏感的环丙沙星和左旋氧氟沙星可以选择作为鸭场的首选药物,本结果与其相反,可能与养殖过程中使用的药物情况有关。综合比较网床水面圈养和网床全旱养蛋鸭大肠埃希菌耐药表型和耐药基因发现,网床全旱养蛋鸭大肠埃希菌的耐药性和耐药基因的检出率均高于网床水面圈养。通过对2种养殖场的调研分析发现,确实存在网床全旱养用药量和用药种类多于网床水面圈养的情况,因为中小养殖户认为,蛋鸭需要生活在水中,如果养殖过程中缺少水面,易导致蛋鸭生病,故盲目地增加了药物的使用量和种类。
对鸭源大肠埃希菌的多重耐药性分析表明,在本试验中网床全旱养蛋鸭肠道中分离的大肠埃希菌耐药数≥3的菌株比例为23.33%,而网床水面圈养蛋鸭肠道中分离的大肠埃希菌耐药数≥3的菌株比例为10.00%,显著低于从鸭病料中分离的大肠埃希菌的耐药数[6-9]。
ESBLs是一类能水解青霉素类、头孢菌素类及单环类抗生素的β-内酰胺酶,其活性能被β-内酰胺酶抑制剂抑制,能产生ESBLs的细菌,可对上述多种抗生素产生耐药性。产ESBLs的大肠埃希菌在法国、加拿大和日本等国家均有报道,尤其是CTX-M型ESBLs传播较快[16-18]。本试验检测出的β-内酰胺酶耐药基因主要是CTX-M型,包括CTX-M、CTXM-1、CTX-M-2、CTX-M-9;水养和旱养蛋鸭 产ESBLs的大肠埃希菌阳性率为11.67%,低于吴华等[19]对国内7个省份临床分离的32株鸭大肠埃希菌产ESBLs的检出率(21.87%)和刘保光等[20]分离的12株鸭大肠埃希菌产ESBLs的检出率(33%)。
大肠埃希菌的耐药机制主要是获得性耐药,而获得性耐药的大肠埃希菌通常借助于整合子、转座子和质粒等可移动元件进行耐药基因的传播[21]。整合子为运动性的DNA分子,位于染色体和质粒或转座子等可移动元件上,可以通过整合酶捕获或者整合耐药基因和介导多重耐药的形成[6]。大肠埃希菌中最常见的是Ⅰ型整合子[22],因此本研究着重分析了Ⅰ型整合子的携带状况,发现蛋鸭肠道大肠埃希菌Ⅰ型整合子阳性率为16.67%,但网床全旱养蛋鸭大肠埃希菌Ⅰ型整合子阳性率为23.33%,高于网床水面圈养的阳性率(10.00%)。4株Ⅰ型整合子阳性大肠埃希菌含有基因盒,分别为dfrA1-aadA1和dfrA12-aadA2。dfrA编码二氢叶酸还原酶,该酶能竞争性抑制磺胺类药物,使细菌对磺胺类药物耐药[6];aadA编码氨基糖苷腺苷酸转移酶,对氨基糖苷类药物关键位点具有化学修饰作用,阻断了药物与细菌16S rRNA结合,使细菌对氨基糖苷类药物产生耐药性。
4 结论
本研究结果显示,网床全旱养蛋鸭肠道大肠埃希菌的毒力基因携带率、耐药性表型及耐药基因携带率均高于网床水面圈养蛋鸭,表明不同养殖模式的用药情况差异会对蛋鸭肠道微生物耐药性产生一定的影响。
