小儿厌食症临床试验设计与评价技术要点的文献研究*
2020-06-01仇雅朋李晓璇蔡秋晗胡思源
仇雅朋,李晓璇,蔡秋晗,胡思源
(1.天津中医药大学第一附属医院,天津 300381;2.天津市滨海新区妇女儿童保健和计划生育服务中心,天津 300459)
厌食症是国内中、西医儿科共用的病名。《诸福棠实用儿科学》认为,本病首先是一种摄食行为异常的表现,临床可伴或不伴胃肠道功能的异常[1]。近年来,国外对于本病的分类诊断认识逐步深化,如Chatoor的“婴儿和儿童早期喂养障碍”中[2]的“婴幼儿厌食症”,《精神障碍诊断与统计手册(第五版)》(DSM-5)[3]的“回避性/限制性摄食障碍”,《疾病和有关健康问题的国际统计分类第十次修订本》(ICD-10)[4]的“婴儿和儿童期喂养障碍”,以及以色列Edith Wolfson医疗中心的“婴幼儿喂养障碍”[5]等,均以缺乏进食兴趣/甚至拒食、食物摄入不足为主要临床特征,近似或涵盖本病。
近年来,有关小儿厌食症及其相关疾病的临床研究文献虽逐渐增多,但试验设计差异较大,文献质量大多不高,影响了试验结果评估及二次文献研究。文章通过文献检索,选择2000—2019年国内外、中英文的高质量随机对照临床试验(RCT)文献,分析、归纳、提炼小儿厌食症临床试验设计与评价的技术要点,期望能为本病的临床试验设计提供借鉴与参考。
1 资料与方法
1.1 文献的纳入标准与排除标准
1.1.1 纳入标准 1)2000—2019年的中、英文文献。2)研究类型为临床RCT。3)具有/符合小儿厌食症及其相关疾病(喂养障碍、回避性/限制性摄食障碍)的诊断标准。4)干预措施为中医药、化学药或行为治疗。5)改良Jadad量表评分≥4分。
1.1.2 排除标准 1)半随机对照试验。2)会议文献、综述、文摘及无法获取全文信息的文献。3)神经性厌食。4)重复发表的文献。5)内容有明显错误的文献。
1.2 文献的检索方法及策略 检索的数据库,包括中国知网数据库(CNKI)、中国生物医学文献数据库(CBM)、维普中文科技期刊数据库(VIP)及万方数据库(WF)、中国临床试验注册中心、Pubmed、Embase、CochraneLibrary及Clinicaltrials。检索年限为2000—2019年。中文检索词包括小儿、儿童、幼儿、学龄前;厌食、厌食症;喂养障碍;摄食障碍;临床试验、临床疗效、随机。英文检索词包括infantile、chlid*、teen*、pedia*;Anorexia;feeding disorders;avoidant/restrictive food intake disorder;intake disorder;RCT、random。根据每个数据库的具体情况选择主题词、关键词、摘要、全文等多种检索方式以保证检索的系统性。
1.3 文献筛选及资料提取
1.3.1 文献筛选 参考Cochrane协作网系统评价员手册制定研究入选方法:1)将不同数据库的检索结果分别导入文献管理软件NoteExpress中。2)对文献进行查重。3)对查重后的文献逐篇阅读题目与摘要,剔除明显不相关的文献。4)获取相关文献的全文。5)逐篇阅读全文剔除不符合纳入标准的文献。6)对阅读全文剩余的文献运用改良Jadad量表评分,剔除评分≤3分的文献。
1.3.2 资料提取 应用Excel制作信息提取表,由两位研究者独立提取纳入文献的主要信息。对于存在分歧的资料,两名研究者可讨论协商解决,或咨询第三方评价者帮助解决。主要提取内容包括:题目、作者、试验设计(随机、对照、盲法、样本量估算、检验类型、多中心等)、诊断标准、纳入标准、排除标准、干预措施、合并治疗与用药、疗程、有效性指标及评价方法、安全性指标及评价方法、导入期及随访等。
1.3.3 文献质量评价 参考Cochrane协作网系统评价员手册RCT的偏倚风险评估工具,对纳入研究的文献进行严格的偏倚风险评估。评价偏倚风险的具体内容包括6个方面7个条目:1)选择性偏倚(随机序列的生成、分配方法隐匿)。2)对受试者和研究人员实施盲法(实施偏倚)。3)结局评价者盲法(测量性偏倚)。4)结果数据不完整(随访偏倚)。5)选择性报告(报告偏倚)。6)其他潜在来源的偏倚。
2 结果
2.1 检索结果 共检索文献1 321篇,排除重复或重复发表的文献458篇,阅读题目、摘要排除文献203篇,阅读全文排除文献174篇,以改良Jadad量表评分<4分排除文献465篇,最终共纳入14篇中文文献和7篇英文文献[6-26]。文献筛选流程,见图1。
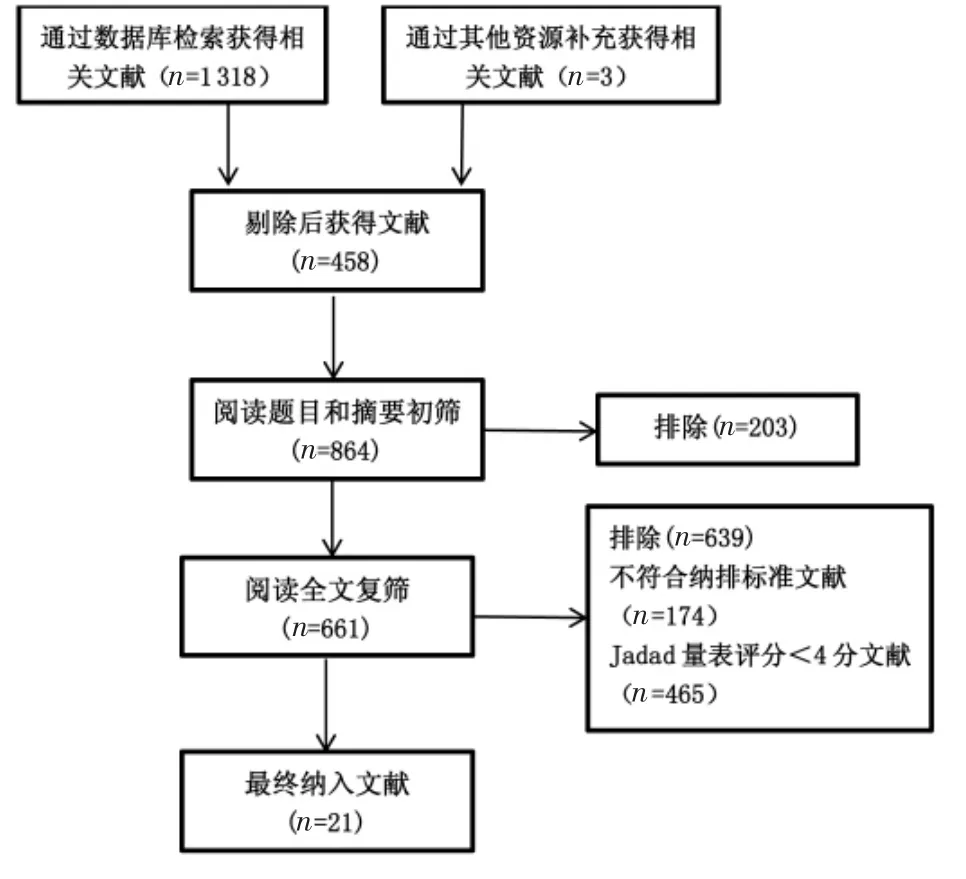
图1 文献筛选流程Fig.1 Literature screening process
21项研究中,共纳入2 708例受试者,试验组1 356例,对照组1 132例,样本量最大451例,最小16例(其中3项研究未明确试验组与对照组例数[21,25-26])。
2.2 纳入研究的质量评价 采用Cochrane协作网提供的偏倚风险评估工具,对纳入研究的21篇文献进行偏倚风险分析,其总体偏倚风险较低,纳入文献质量较高。见图2。

图2 纳入研究的偏倚风险总结Fig.2 Summary of bias risk of included studies
3 结果分析
3.1 临床定位 纳入的全部21项研究中,国内研究 14项(66.67%),国外研究7项(33.33%)。14项国内研究中,均以改善食欲不振症状或和增加食量为主要目的,同时探讨改善生长和营养状况3项(21.43%);7项国外研究中,以改善摄食行为、食欲不振症状、摄食量、小儿生长和营养状况为主要目的,分别为 4项(57.14%)、1项(14.29%)、1项(14.29%)、1项(14.29%)。
3.2 研究总体设计 主要包括随机、对照、盲法、样本量估算、检验类型等内容。21项研究中,选择阳性药、安慰剂、行为治疗和空白对照,分别为14项(66.67%)、4项(19.05%)、1项(4.76%)、2项(9.52%);采用双盲法设计10项(47.62%),未设计盲法11项(52.38%);多中心研究9项(42.86%),单中心研究12项(57.14%);有样本量进行估算研究1项(4.76%);选择差异性检验设计19项(90.48%),非劣效检验、优效性检验设计各1项(4.76%)。
3.3 诊断标准及辨证标准 21项研究的西医诊断标准中,具有明确来源者16项(76.19%),符合者5项(23.81%)。有明确来源的16项研究,包括各版《诸福棠实用儿科学》[1,27-28]“厌食症”9项(56.25%),DSM-5[3]“回避性/限制性摄食障碍”3项(18.75%),《中药新药临床研究指导原则(试行)》[29]2项(12.5%),以色列Edith Wolfson医疗中心“婴幼儿喂养障碍”[5]、Chatoor“婴幼儿厌食症”各1项(6.25%)[2]。
14项国内中医药研究中,有明确的中医诊断标准5项(35.71%),其中,《中医病证诊断疗效标准》[30]4项(80%),参考《中药新药临床研究指导原则》[29]1项(20%)。有明确的中医辨证标准的研究11项(78.57%),其中,各版《中医儿科学》[31-32]7项(63.64%),《中医儿科常见病诊疗指南》[33]《中药新药临床研究指导原则(试行)》[29]各 2项(18.18%),《中医病证诊断疗效标准》[30]1项(9.09%)。
3.4 受试者的选择与退出
3.4.1 纳入标准 21项研究均设计了纳入标准。1)全部研究均符合厌食症及其相关疾病(喂养障碍、回避性/限制性摄食障碍)诊断标准。2)限定年龄范围19项(90.48%),下限为9个月~5岁,上限为5.5~14岁。3)进一步限定病程 10项(47.62%),其中,≥1个月和≥2个月各4项(40%),≥3个月2项(20%)。4)有诊前治疗规定 7项(33.33%),其中,近期未服用药物或未接受其他治疗者6项,近期未使用任何补充剂1项(14.29%)。5)明确规定签署知情同意书者9项(42.86%)。
3.4.2 排除标准 21项研究中,设计了排除标准18项(85.71%)。1)与病种有关的排除标准12项(57.14%),包括消化系统疾病(如急慢性胃肠炎、消化性溃疡、肝炎)、精神性疾病(如神经性厌食)、呼吸道感染、肿瘤等。2)与干预措施相关排除标准8项(38.1%),包括过敏体质患儿及对试验用药或其成分过敏者。3)设计了通用排除标准14项(66.66%),包括合并其他系统严重疾病(如心肌炎、肾病综合征、胆囊炎),中、重度营养不良,近期服用过药物或接受过其他治疗,以及实验室指标异常者。
3.4.3 退出(脱落)标准 21项研究中,其中设计退出(脱落)标准7项(33.33%),但15项(71.43%)有退出/脱落病例的表达。1)研究者决定退出7项(100%),包括失访或者资料不全,对试验药物过敏或出现不良事件,试验过程中罹患其他疾病,依从性差,各种原因的中途破盲病例,病例入选后违反纳排标准等。2)受试儿童自行退出7项(100%),包括不再接受用药及检测而失访者,不愿意或不可能继续进行临床试验者。
3.5 干预措施 纳入的21项研究中,干预措施为中医药者11项(52.38%)、化学药4项(19.05%)、行为治疗3项(14.28%)、中药化药联合应用2项(9.52%)、行为治疗联合化药1项(4.76%)。中医药干预的11项中,中成药8项(72.73%),推拿、针灸、中药敷贴各1项(9.09%)。疗程4周8项(38.10%),2周 6项(28.57%),1周、8周各 2项(9.52%),10 d、3周、6个月各1项(4.76%)。有基础治疗设计3项(14.29%),均要求改变不良饮食习惯及制定合理的喂养计划;有合并用药设计1项(4.76%)。
3.6 导入期与随访 21项研究中,均未设计导入期;有随访设计了1项(4.6%),随访时间为6个月,目的为观察小儿厌食的复发情况。
3.7 有效性评价
3.7.1 有效性指标 纳入的21项研究均设计了2~4项有效性指标。14项国内研究中,以食欲食量改善综合评价(以厌食疾病疗效为主要指标)为主8项(57.14%);以中医症状整体评价(以中医症状/证候疗效为主要指标)为主6项(42.86%);其中含有体质量、身高指标评价3项(21.43%)。7项国外研究中,以喂养/摄食行为评价(以量表评分为主要指标)为主要指标4项(57.14%);以食欲不振改善、管饲喂养与口服卡路里的比例、体质量为主要指标各1项(14.29%),其中以营养状况改善为次要指标2项(28.57%),如身高、体质量及其Z评分,以及体重指数(BMI)、皮肤皱褶厚度等。
3.7.2 评价标准 1)食欲食量改善综合评价标准,主要参考《中药新药临床研究指导原则(试行)》[29]制定。采用尼莫地平法,将疗效分为痊愈、显效、有效、无效4级。2)中医症状/证候整体改善评价标准,主要参考《中药新药临床研究指导原则》及《中医病证诊断疗效标准》[29-30]制定。在中医症状体征积分分级量化的基础上,采用尼莫地平法,按中医症状/证候积分减少≥95%、70%~95%、30%~70%、<30%,将疗效分为痊愈、显效、有效、无效4级。3)喂养/摄食行为改善情况评价标准,主要通过Likert量表评分对进餐时间、症状严重程度进行评价。主要量表包括进餐时间行为问卷(MBQ)、儿童饮食行为量表(CEBQ)及儿童饮食态度测验量表(ChEAT)[24-25,34]等。4)小儿生长和营养状况评价,参照美国疾病控制中心(Center for Disease Control metrics)绘制的增长图表标准[35]。
3.8 安全性评价 主要包括选择不良事件/不良反应、实验室检查等。21项研究中,有不良事件/不良反应观察设计12项(57.14%),实验室安全性指标检查设计7项(33.33%)。
3.9 伦理学要求 纳入的21项研究中,有伦理批件号说明者仅1项(4.76%)。
4 讨论
本研究系统收集了近20年来中、西医治疗小儿厌食症临床随机对照试验的中、英文文献,所纳入的21篇文献,质量较好。通过归纳和提炼,分析出临床试验设计与评价相关的技术要点,主要包括:1)临床定位,应以改善食欲症状或和增加进食量为主要目的,而最终目标应是改善患儿生长和营养状况,保证小儿正常的生长发育。2)试验总体设计,应采用随机、对照、盲法、多中心的方法,推荐采用安慰剂对照,但也可选择阳性药对照。3)西医诊断标准,建议采用Chatoor《婴儿及年幼儿童喂养障碍的诊断与治疗》中的“婴幼儿厌食症”[2]、DSM-5“回避性/限制性摄食障碍”等诊断标准[3];中医诊断和辨证标准,可参考《中医儿科常见病诊疗指南》、各版《中医儿科学》教材[31-33]。4)受试者的选择,建议在纳入标准中对病程进行限定,至少1个月;在排除标准中将神经性厌食,中、重度营养不良患儿予以排除。5)试验流程,疗程一般应设为4~8周,以体质量为重要有效性指标者,应考虑设计更长的疗程;可不设导入期,但根据研究目的,可设计4周或更长时间的随访。6)有效性评价,应建立针对试验目标的指标体系,可以选择食欲症状或和摄入量、喂养/摄食行为量表评分、体质量等儿童生长发育指标中的1~2个,作为主要评价指标;对于中药,可以增加中医症状/证候类指标。7)安全性评价,主要选择临床不良事件/不良反应、实验室检查等常规指标,重点观察试验用药相关的不良反应。8)伦理学要求,任何试验启动前,均应获得伦理委员会的批准。这些技术要点,基本包括了小儿厌食症RCT设计的核心内容,具有较高的借鉴价值。
研究纳入的21篇文献,时间跨度长达20年,没能全部涵盖儿童临床试验的新要求,小儿厌食症及其相关疾病的最新研究进展也不突出。因此,在未来小儿厌食症临床RCT设计中,临床诊断应参照疾病的新分类和新标准;重要评价量表,试验前应进行研究者判断的一致性培训;测量体质量,也要制定标准操作规程等。此外,还应充分重视儿童临床试验的伦理学新要求,年满8岁儿童应同时签署知情同意书,发表论文应突出表达伦理审批的过程和结果。
