过表达骨形态发生蛋白4 对兔骨髓间充质干细胞增殖与成软骨的影响
2020-05-30薛来恩温福利郑和平胡德庆
张 飞, 党 源, 薛来恩, 温福利, 郑和平, 胡德庆
[1.蚌埠医学院福总教学医院(联勤保障部队第九〇〇医院), 福州 350025;2.福建医科大学附属第一医院骨科, 福州 350004]
关节软骨为高度组织化结构,缺乏未分化细胞和营养支持,且软骨细胞受致密胶原-蛋白多糖基质的影响,无法有效增殖和迁移。故关节软骨一旦损伤很难自身修复。临床上修复关节软骨损伤的方法都存在相应局限性,如微骨折术后产生纤维软骨;自体软骨移植术对供区造成二次损害,以及软骨细胞去分化;异体软骨移植术存在疾病传播和免疫排斥风险等。
组织工程软骨化是目前修复关节软骨损伤最具潜力的方法,其三大基本要素为种子细胞、支架、细胞因子。骨髓间充质干细胞(BMSCs)来源于中胚层,可分化为同一胚层的组织,包括骨、软骨、肌肉、神经等。BMSCs 易获取,增殖更新快,是软骨组织工程中应用最广泛的种子细胞。骨形态发生蛋白(bone morphogenetic protein,BMP)属于转化生长因子β(transforming growth factor-β,TGF-β)超家族成员,是目前发现的能单独诱导骨形成的蛋白质分子。研究证实,BMP-4在体内外均能促进BMSCs软骨特异性基质Ⅱ型胶原、蛋白多糖的合成,加强成软骨能力,促进关节软骨的修复[1]。然而BMSCs 在骨髓中含量极低,BMP 在体内很容易被扩散稀释或降解。
本研究通过全骨髓贴壁法体外提取、扩增培养兔BMSCs,并通过腺病毒(Ad)载体将BMP-4感染至BMSCs,研究过表达BMP-4 对BMSCs 增殖和软骨分化的作用,为软骨组织工程治疗软骨损伤提供实践基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 1月龄普通级雄性新西兰兔4只,体质量(700±50) g,由福建省连江玉华山自然生态农业试验场[SCXK(闽)2014-0001]提供,饲养于解放军福州总医院比较医学科普通环境[SYXK(军)2013-0004]。
1.1.2 药品试剂 L-DMEM、PBS均购自HyClone公司;0.25%胰蛋白酶(含EDTA)购自Genview 公司;鼠抗兔CD34-FITC、CD29-FITC、CD44-FITC、IgG-FITC、CD45-FITC、CD90-FITC 均购自北京博奥森生物技术有限公司;腺病毒(Ad)介导BMP-4(Ad-BMP-4)载体购自上海吉玛制药技术有限公司;兔细胞分泌Ⅱ型胶原(COLL Ⅱ)、性别决定基因盒9(Sox9)、BMP-4 ELISA 免疫试剂盒购自江苏晶美生物科技有限公司;BMSCs成骨、脂肪、软骨诱导分化培养液均购自美国Cyagen公司;山羊抗兔GAPDH、Sox9、COLL Ⅱ、BMP-4 多克隆抗体,以及HRP 标记的山羊抗兔IgG 均购自北京鼎国生物科技有限公司。
1.2 方法
1.2.1 BMSCs分离和培养 用体积分数3%的戊巴比妥(30 mg/kg)过量麻醉处死新西兰兔,膝关节脱毛,温水洗净,仰卧位固定。双下肢膝关节髌骨旁做横切口,逐层剥离股骨、胫骨,去除表面肌肉、筋膜后置于75%乙醇溶液中,立即移至超净工作台中。去除上下干骺端,暴露骨髓腔,10 mL 注射器抽取含体积分数为10% 胎牛血清(FBS)的L-DMEM完全培养液(含青霉素和链霉素各100 U/mL),冲刷骨髓腔,至骨髓腔通透为止。骨髓液经200 目筛网过滤2 遍,水平离心机上以800×g 离心5 min。弃去上清液,用5 mL 10% FBS 完全培养液重悬细胞,按1×109/mL的密度接种于25 cm2细胞培养瓶中,置于5%CO2、37 ℃细胞培养箱中,记为原代(P0 代)细胞。8 h 后全定量换液,去除未贴壁的红细胞,以后每3 d 全定量换液1 次。待细胞铺满瓶壁85%~90%时,用0.25%含EDTA 胰蛋白酶消化,按1∶2 至1∶3 比例传代培养,留取P2 代细胞用于实验。
1.2.2 细胞形态学及表面分子标志物鉴定 每日在倒置显微镜下观察并记录细胞生长、形态变化和族群分布状况。取生长状态良好的P2 代细胞,用0.25%含EDTA的胰蛋白酶1 mL消化,PBS洗涤细胞1 次。每1×106细胞用2 mL质量分数 4%的多聚甲醛溶液固定10 min,PBS 洗涤细胞1 次,调整细胞密度至1×106/mL。取3 个1.5 mL 离心管,每管移入细胞液100 μL,依次加入1 μL 单克隆抗体CD34-FITC、CD29-FITC、CD44-FITC、CD45-FITC、CD90-FITC,同时设立各抗体同型对照IgG-FITC 组,以消除非特异性结合对结果的影响。4 ℃避光孵育30 min,PBS 洗涤1 次,1 mL PBS 重悬细胞,200 目筛网过滤1 次,振荡混匀后上机检测。
1.2.3 成骨、脂肪、软骨诱导分化 超净工作台内依次配制好成骨、脂肪、软骨诱导分化液,取生长状态良好的P2 代细胞,用0.25% 含EDTA的胰蛋白酶1 mL 消化,行锥虫蓝细胞计数,确保细胞密度在1×106/mL,铺于6 孔板内,每2~3 d 更换1 次诱导分化液。21~28 d 后,视细胞生长状态,用2 mL 4%预冷多聚甲醛溶液固定15 min,分别行茜素红、油红O 及阿尔新蓝染色。显微镜下观察染色情况并拍照。
1.2.4 Ad-BMP-4 载体构建 从含有BMP-4 基因的质粒克隆模板中,利用PCR 方法扩增目的基因。将载体进行酶切,纯化的PCR 产物与线性化的载体连接,将连接产物转化感受态细胞,对长出的克隆先进行酶切鉴定,证明目的基因已经定向连入目的载体,再对阳性克隆进行测序和分析比对。将构建好的Ad 过表达质粒载体进行超纯去内毒素抽提。
1.2.5 Ad-BMP-4 感染BMSCs 梯度及效率分析取P2 代细胞,消化后铺于6 孔板中,待细胞铺满瓶壁约80%,消化1 孔细胞,500 μL 完全培养液重悬,吸取50 μL 细胞悬液与150 μL 锥虫蓝染液,充分混合,行细胞计数。取5 个1.5 mL离心管,设立感染复数(multiplicity of infection,MOI)为0、25、50、100、200 的病毒梯度组,根据MOI=(病毒滴度×病毒体积量)/细胞总数,计算出对应病毒体积量,加入1 mL 含2% FBS、无双抗的维持液,于对应组中换液,锡箔纸包裹后放入5% CO2、37℃培养箱。48 h 后至荧光显微镜下观察绿色荧光并拍照。用500 μL 0.25%胰蛋白酶(含EDTA)消化感染后细胞,PBS 洗涤1 次,1 mL PBS 重悬,200 目筛网过滤1 次,充分振荡混匀行流式细胞术,检测绿色荧光蛋白表达量以确定梯度感染效率及最佳MOI。
1.2.6 感染后的细胞蛋白收集 取P2 代细胞,消化,计数,铺于6 孔板内。设立空白对照组、空载病毒组、实验组,同时每组分别设立0 d、1 d、3 d、5 d 和7 d 共5 个时间梯度。相应时间点消化细胞,离心,弃上清液,加入预先配制好的蛋白裂解液(99 μL RIPA+1 μL PMSF),充分吹匀,-20 ℃冷藏备用。
1.2.7 ELISA 测定感染后相关蛋白表达量 将提取的蛋白液解冻,于4 ℃、10 000×g 高速离心5 min,将离心后的蛋白液转移至新的1.5 mL离心管中。按照试剂盒说明进行成软骨相关蛋白COLL Ⅱ、Sox9、BMP-4 的测定。
1.2.8 Western blotting 测定感染后相关蛋白表达量 将实验组0 d、1 d、3 d、5 d 和7 d 的蛋白液解冻,于4 ℃、10 000×g 高速离心2 min,收集上清液,-80 ℃分装保存。配制浓缩胶及分离胶,每孔加等量蛋白样品,经SDS-PAGE 将蛋白转移至PVDF 膜上,加入脱脂奶粉溶液并置于摇床上封闭1h,分别加入山羊抗兔GAPDH、Sox9、COLL Ⅱ、BMP-4 多克隆抗体(稀释比例分别为1 ∶2 0 0 0、1 ∶1 0 0 0、1∶1 000、1∶1 000),于4 ℃冰箱过夜,1×TBS/T 洗涤3 次,再与HRP 标记的山羊抗兔IgG(稀释比例为1∶3 000)室温反应1 h,1×TBS/T 洗涤3 次,封膜后进行曝光。采用Image J 软件对曝光结果进行定量分析,结果以目的蛋白与GAPDH 的累积吸光度比值表示。
1.2.9 感染细胞增殖实验 以确定的最佳MOI感染细胞,并设立空白对照组、空载病毒组。消化P2 代细胞,计数细胞,确定细胞密度。配制细胞悬液,每100 μL 细胞悬液中包含3 000 个细胞。在96 孔板中每孔加入100 μL 细胞悬液,同时每组设立5 个重复孔。铺板后0 d、1 d、3 d、5 d 和7 d,每孔加入10 μL CCK-8 溶液,振荡15 s,置于5%、37 ℃培养箱孵育1 h。酶标仪490 nm 波长处读取吸光度(A)值并取平均值,绘制各组细胞生长曲线。
1.3 统计学分析
2 结果
2.1 BMSCs 鉴定
2.1.1 细胞形态学鉴定 72 h 换液,大部分细胞已贴壁,呈短梭形(图1A)。前期BMSCs 生长缓慢,10~12 d 可长满瓶壁90%,呈簇状或漩涡状生长,细胞为短细梭形(图1B)。传代培养至第2 代,5~6 d 细胞融合可达瓶壁90%,呈典型漩涡状分布,细胞呈长梭形,形态均一,未见明显接触抑制(图1C),符合BMSCs 的形态学特点。

图1 新西兰兔BMSCs 形态学观察 (×100)Figure 1 Morphology of the cultured BMSCs from New Zealand rabbits (× 100)
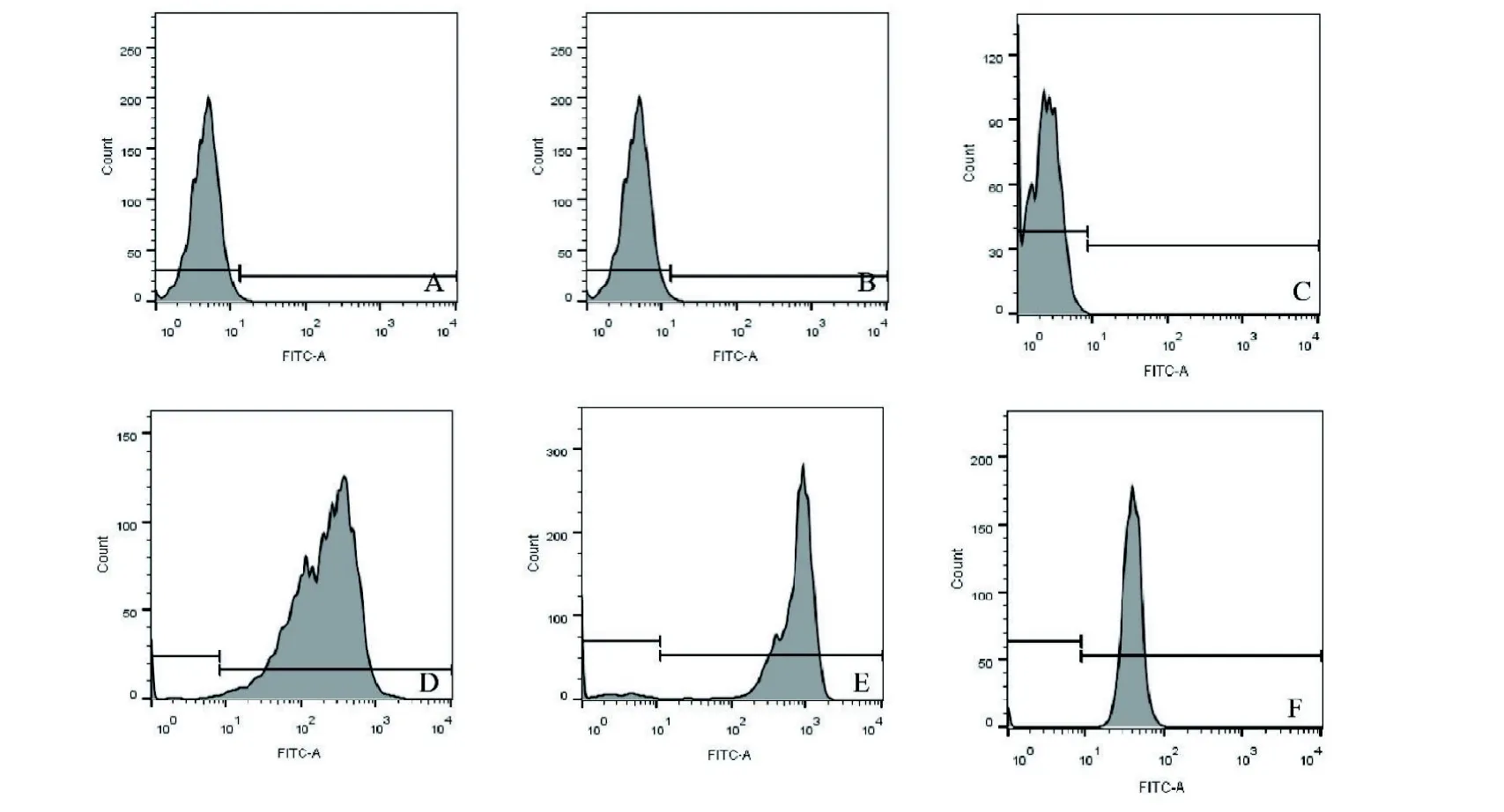
图2 新西兰兔BMSCs 表面分子标志物Figure 2 Surface molecular markers of BMSCs from New Zealand rabbits
2.1.2 细胞表面分子标志物鉴定 流式细胞术测定, 所获细胞低表达CD34(1.94%)和CD45(2.13%),高表达CD44(98.2%)、CD29(99.7%)和CD90(98.8%)(图2),可见通过全骨髓贴壁法培养可获得较高纯度的BMSCs。
2.1.3 成骨、脂肪、软骨诱导分化 对P2代细胞成功进行三系诱导分化,即成骨、成脂肪、成软骨诱导分化。经茜素红染色,成骨诱导分化组中可见大量红色钙盐结节的形成(图3A)。经油红O 染色,成脂肪诱导分化组中可见细胞变大、变圆,同时伴有大量橘红色脂肪空泡的形成(图3B)。经阿尔新蓝染色,成软骨诱导组中可见大量蓝色颗粒形成(图3C)。
2.2 Ad-BMP-4 感染BMSCs 梯度及效率分析
荧光显微镜下,随着MOI 梯度(0、25、50、100、200)的增加,绿色荧光强度不断加强(图4),但病毒载体对细胞具有一定的损害,尤其MOI为200 时最为明显。通过流式细胞术检测感染效率(图5)及各病毒MOI下绿色荧光蛋白表达量(表1),综合比较,MOI 为100 时,感染效率适宜,且对细胞损害最小,为最适MOI。
2.3 ELISA 及Western blotting 检测软骨相关蛋白表达
Ad介导BMP-4感染BMSCs组中Sox9(图6A)、COLL Ⅱ(图6B)和BMP-4(图6C)表达量明显高于空载病毒感染组和空白对照组(P<0.05),空载病毒组和空白对照组间无明显差异(P>0.05)。可见,感染后的BMSCS能持续高效表达BMP-4蛋白,并分泌软骨细胞特有的COLL Ⅱ和Sox9 蛋白,促进BMSCs 向软骨细胞分化。Western blotting检测可见Sox9 在感染后5 d 表达量增加明显,COLLⅡ和BMP-4 在感染后7 d 表达量增加较明显(图6D、6E)(P<0.05)。
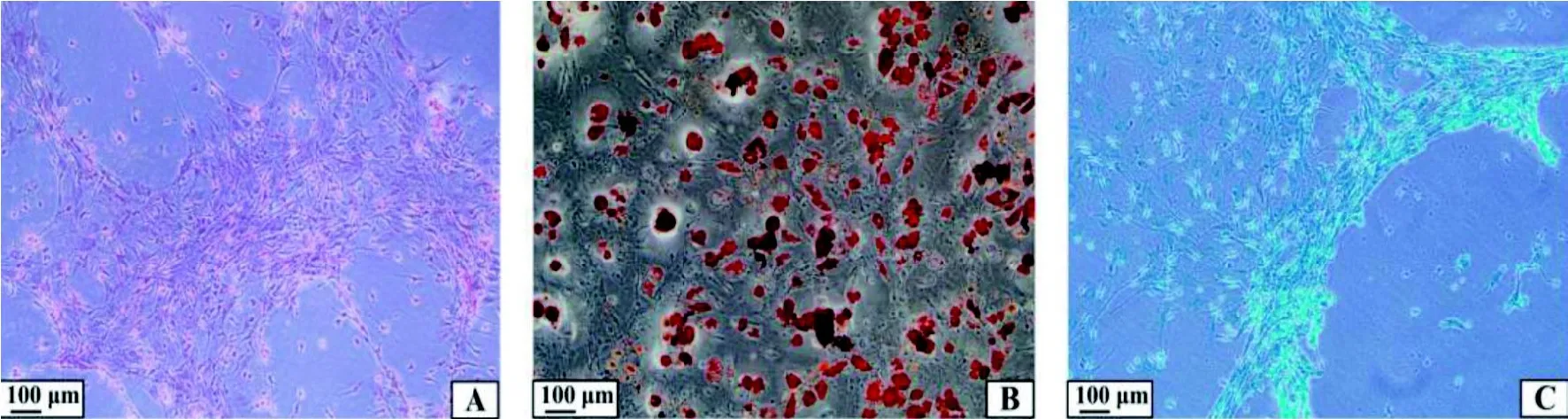
图3 新西兰兔原代BMSCs 成骨、脂肪、软骨诱导分化Figure 3 Osteogenic, adipogenic and chondrogenic differentiation of BMSCs from New Zealand rabbits

图4 新西兰兔BMSCs 在不同MOI 的病毒感染下荧光显微镜表现Figure 4 Fluorescence microscopic observation of BMSCs from New Zealand rabbits infected with different MOI of virus

图5 流式细胞术检测不同MOI 的病毒感染新西兰兔BMSCs 效率Figure 5 Detection of BMSCs in New Zealand rabbits infected with different MOI of virus by flow cytometry
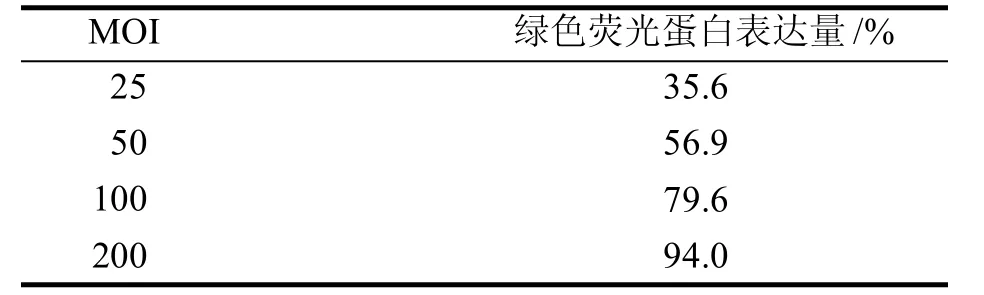
表1 不同MOI 的病毒感染BMSCs 后绿色荧光蛋白表达量Table 1 The expression of green fluorescent protein in BMSCs infected with different MOI of virus
2.4 过表达BMP-4 对细胞增殖的影响
应用CCK-8法检测过表达BMP-4对细胞增殖的影响(表2),各组细胞增殖活性随时间推移都呈现增长趋势。其中空白对照组和空载病毒组差异无统计学意义(P>0.0 5),可见MOI=100 时,病毒对细胞的增殖几乎没有影响。实验组增长趋势与其他两组差异具有统计学意义(P<0.05),可见过表达BMP-4 能够促进体外BMSCs 增殖。
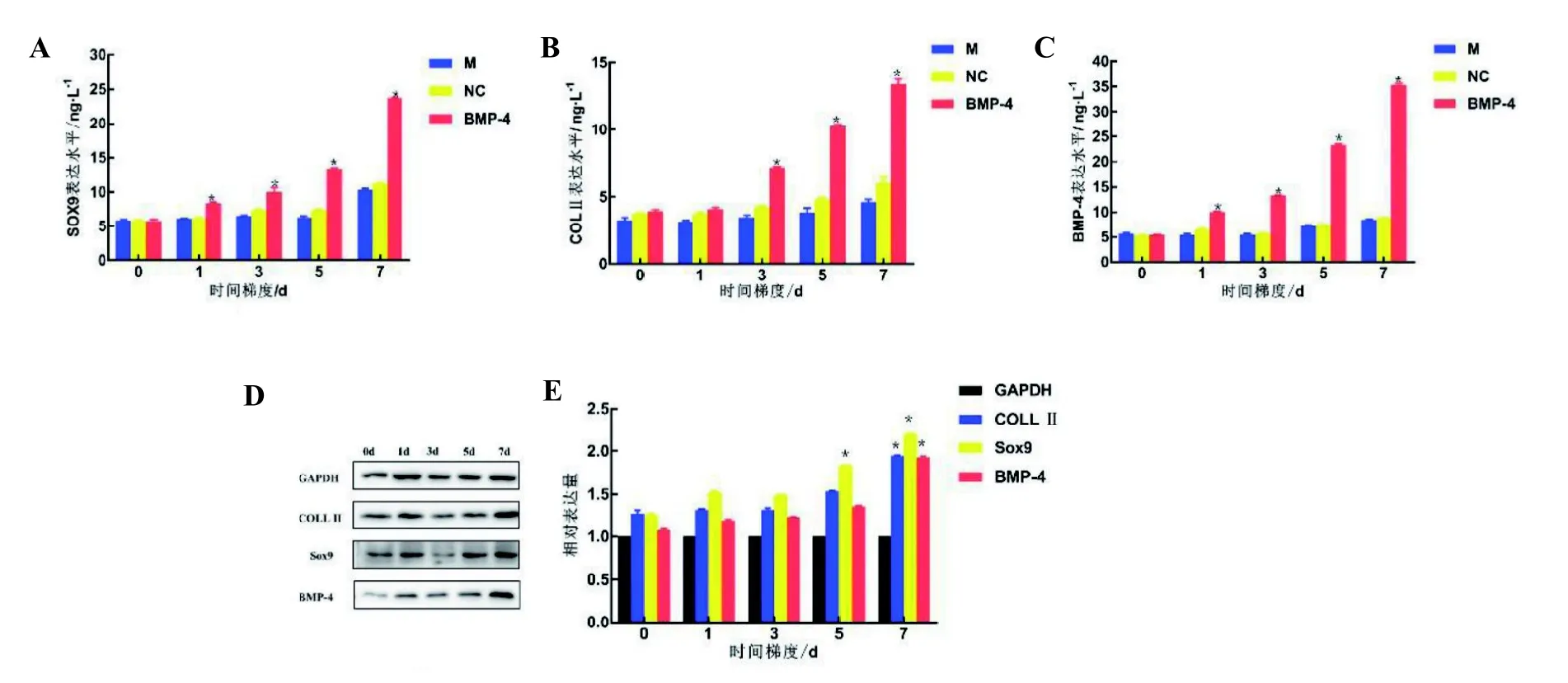
图6 ELISA 及Western blotting 检测新西兰兔原代BMSCs 相关成软骨蛋白表达Figure 6 Detection of chondrogenic protein expression related to primary BMSCs in New Zealand rabbits by ELISA and Western blotting
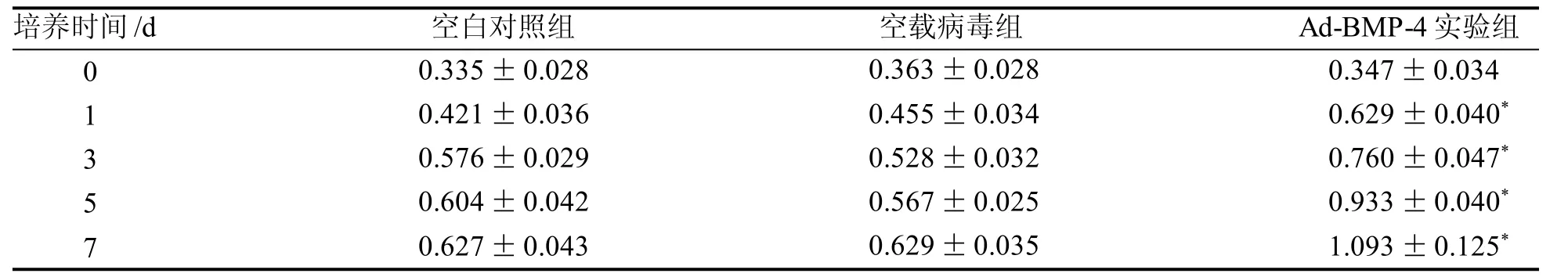
表2 过表达BMP-4 对新西兰兔原代BMSCs 增殖的影响Table 2 Effect of BMP-4 overexpression on the proliferation of BMSCs
3 讨论
应用于软骨组织工程的间充质干细胞主要为脐带间充质干细胞、脂肪间充质干细胞、滑膜间充质干细胞和BMSCs。相对于其他间充质干细胞而言,BMSCs 取材方便、来源充足、增殖分化能力强,自体和同种异体的BMSCs具备免疫抑制能力,是组织工程理想的种子细胞来源[2-3]。但BMSCs 在体内含量极低,仅占骨髓单核细胞的0.001%~0.010%[4]。现有的体外扩增培养方法主要有全骨髓贴壁法、密度梯度离心法、流式细胞法和免疫磁珠法[5]。其中流式细胞法和免疫磁珠法对实验条件及操作要求高,需骨髓量大,且对于早期细胞贴壁及后期细胞增殖有一定影响;密度梯度离心法在细胞生长早期就能获得高纯度的单核细胞,但细胞易出现老化、增殖能力降低等情况;全骨髓贴壁法根据BMSCs 具有贴壁生长的特性,而红细胞等杂细胞悬浮生长,通过换液传代方式分离BMSCs,对细胞损害小,增殖能力在传代中可保持稳定,且早期培养液中存在的各种细胞及其分泌的相关细胞生长因子有利于保持BMSCs 生长微环境,促进BMSCs 生长存活[6]。本实验应用全骨髓贴壁法,通过换液传代成功实现了BMSCs 的体外扩增。对于BMSCs 的鉴定,目前主要通过流式细胞技术检测表面分子标志物来实现[7],常用的表面因子包括呈阳性表达的CD44和CD29,以及阴性表达的CD34 和CD90[8-9]。本实验中CD29 和CD44 均呈高表达,CD34 和CD90 呈低表达;同时通过三系诱导分化证实,培养细胞具备间充质干细胞多向分化潜能,进一步证实通过全骨髓贴壁法能够体外扩增培养纯度较高的BMSCs。
BMSCs 在向软骨组织定向分化的过程中,需要多种细胞因子的共同调控,但单纯加入细胞因子发挥作用的时间短,稳定性差。此外,软骨细胞体外培养时间过长,存在去分化现象。基因治疗与骨组织工程相结合技术在临床应用中有广阔前景[10-11]。基因治疗最大优点在于感染后的细胞自身可以持续、高效分泌目的蛋白,且分泌的蛋白含量接近人体生理需求量,克服了重组蛋白价格昂贵、半衰期短及存在细胞毒副作用的缺陷。有研究证实,利用缝隙连接蛋白43(CX43)基因重组慢病毒表达载体转染大鼠BMSCs,细胞CX43 表达量明显增加[12]。基因治疗的重要物质基础是载体,目前用于软骨组织工程中的基因载体主要有Ad 载体、慢病毒载体及逆转录病毒载体。逆转录病毒载体针对的靶细胞为增殖期细胞,存在插入突变的风险[13];慢病毒载体虽然能持续稳定表达目的基因,但存在基因突变、随机插入的风险[14];而Ad 载体感染率高,毒性低,靶细胞范围广泛,不与靶细胞发生基因整合。本研究在重组缺陷型Ad 载体介导下将BMP-4 基因导入BMSCs,在克服BMP-4 半衰期短的缺陷的同时,实现了高活性成软骨蛋白的持续高效释放。
已有众多研究证实,BMP 能作为起始信号,促使未分化的间充质干细胞向骨、软骨细胞分化,诱导骨、软骨[15]及神经组织[16]的生成。其中除成软骨因子BMP-2 外,BMP-4 能通过信号转导进入细胞核进行转录调控,诱导软骨生成[17]。本实验将BMP-4作为主要调控因子,诱导BMSCs向软骨分化,通过ELISA 及Western blotting 法证实了BMP-4 过表达可以促进COLL Ⅱ、Sox9等特异性成软骨蛋白的表达,促进细胞向软骨组织分化。
综上所述,Ad 介导BMP-4 感染BMSCS 后,细胞能够持续稳定地表达BMP-4、COLL Ⅱ及Sox9,促进BMSCs 向软骨细胞增殖及分化。但在实验中仍然发现一些问题:①BMSCs表面特异性标志、多向分化的机制不明;②基因调控表达最佳量;③实验动物与人的差异性;④从动物模型到临床应用等。这些问题都有待进一步研究。
