土壤渗滤处理老龄养猪废水堵塞的光谱学和微生物学分析
2020-05-29吕晶晶龚为进窦艳艳段学军刘海芳张列宇席北斗于水利侯立安
吕晶晶, 龚为进, 窦艳艳, 段学军, 刘海芳, 张列宇, 席北斗, 于水利, 侯立安,4
1. 中原工学院能源与环境学院, 河南 郑州 450007 2. 同济大学环境科学与工程学院, 上海 200092 3. 中国环境科学研究院, 北京 100012 4. 火箭军后勤科学技术研究所, 北京 100190
引 言
广大的农村地区,小规模的生猪养殖会产生养猪废水,这类养猪废水大多露天存放在泥坑塘中,从而变为老龄养猪废水,老龄养猪废水如果处理不当会引发水体富营养化。人工湿地、氧化塘和土壤渗滤等生态法是处理老龄养猪废水的比较理想的模式,但是也存在易堵塞、不稳定等问题。
土壤渗滤系统发生堵塞,会导致系统水力传导系数降低,处理能力下降,影响出水水质[1]。堵塞问题的产生大大降低了土壤渗滤系统的大范围推广和应用[2]。堵塞已经引起了国内外学者的广泛关注,成为研究土壤渗滤、人工湿地等生态处理方法的热点问题之一。本研究主要运用紫外、红外、三维荧光等光谱学分析方法和高通量测序的微生物学方法探讨堵塞形成的机理,以期为解决土壤渗滤处理老龄养猪废水时的堵塞问题提供科学依据,扩展土壤渗滤推广应用范围。
1 实验部分
1.1 材料与方法
采用日立F-7000型荧光分光光度计扫描污水中溶解性有机物(dissolved orgainic matter, DOM)的三维荧光图谱前,首先根据所测污水中的总有机碳浓度(TOC)浓度,再对该TOC浓度对样品进行一定倍数的稀释,使测定水样的TOC处于一个合适的范围(TOC=10 mg·L-1左右),从而得到比较有效的三维荧光图谱。得到的三维荧光数据在进行深度处理之前进行归一化处理,即原始数据除以TOC值。仪器参数设置: 激发光源为150 W氙弧灯,光电倍增管电压为700 V,信噪比>110,扫描速度12 000 nm·min-1,激发和发射单色仪的狭缝宽度均为10 nm,响应时间为自动。测定时狭缝宽度均为5 nm,激发波长范围设为200~400 nm,发射波长范围设为280~500 nm,激发和发射光谱增量5 nm[3]。取适量进出水滤液样品在-20 ℃冷冻成冰块后,-60 ℃抽真空冷冻干燥,将所得固体粉末样品以质量比1∶100与KBr(光谱纯)混合均匀,在红外灯下研磨,再于50~100 MPa下压片测红外光谱。采用美国Nicolet5DX傅里叶红外光谱仪,扫描范围在4 500~400 cm-1,分辨率4 cm-1,扫描次数16次[3]。采用UNICO/UV-4802型紫外分光光度计,扫描波长范围为190~700 nm,扫描间距为1 nm。
试验装置如图1所示。反应器为高50 cm,内径为4 cm的有机玻璃管,其中填充的土壤为北京市顺义区试验基地内表层土。

图1 反应装置示意图Fig.1 Schematic diagram of reaction device
1.2 进水水质
试验用水为稀释了10倍的老龄养猪废水,进水水质情况如表1所示。废水通过蠕动泵提升进入反应器,水力负荷为6 cm·d-1,系统前端未加预曝气系统。反应器的初始水力传导系数为3 m·d-1,随后逐渐减小,运行了10 d之后,水力传导系数降为0.005 m·d-1,并且土壤表层存在积水,

表1 稀释老龄养猪废水水质Table 1 The water quanlity of synthetic highammonia nitrogen waste water
土壤渗滤系统发生了堵塞。实验中取堵塞前、堵塞时和堵塞后的三次进出水水样,进行光谱学分析,并取堵塞时的表层土壤、底层土壤和原位土壤做细菌和真菌的DNA编码分别为16S,18S rDNA。
2 结果与讨论
2.1 堵塞的光谱学分析
图2(a)—(f)分别为用MATLAB R2009a处理过之后去除了拉曼散射和瑞利散射之后的DOM三维荧光图谱。由图2(a)—(f)可以直观的看到,堵塞前后,土壤渗滤系统对DOM的转化产生了很大影响。进水中的DOM主要为类酪氨酸、类色氨酸和溶解性微生物副产物[见图2(a),(c),(e)],属于类蛋白物质,系统完全堵塞之前,经过处理之后,DOM转变为类富里酸,属于类腐殖质类物质。而当系统发生了堵塞,DOM的组成基本不变,只是进水中原本存在的类蛋白峰发生了微弱的红移,有发生转化的趋势,荧光峰的相对强度减弱,表明DOM的浓度减小。
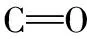
研究表明,紫外-可见吸收光谱可以揭示DOM组成的宏观信息。图4为堵塞前后DOM的紫外-可见吸收特征光谱图。表3为堵塞前后DOM的紫外-可见吸收光谱特征参数。a355m-1为波长为355 nm处的吸光系数[9],通过公式a355=A355×2.303/L计算,其中A355为波长355 nm对应的吸光度,L为光程即比色皿宽度0.01 m;E253/E203为波长253 nm处的吸光度与203 nm处的吸光度比值;SR为ln(275)~ln(295)和ln(350)~ln(400)拟合直线斜率的比值; SUVA254为波长254 nm处单位DOC浓度的吸光度,通过公式SUVA254=100×A254/DOC计算;A226~250和A260~400分别为对波长226~250 nm和波长260~400 nm范围内的吸光度做面积积分所得的值[1]。

图3 堵塞前后溶解性有机物傅里叶变换红外光谱Fig.3 FTIR spectra of DOM before and after cloggings
a355为表征有色DOM浓度的重要指标,堵塞前、堵塞时及堵塞后系统对a355的去除率分别为17.26%,37.24%和48.08%,可见堵塞的发生对去除有色DOM浓度是有利的,这是由于堵塞使进水的水力停留时间变长所导致的。E253/E203可以代表有机质芳香环上的取代基种类和程度,当取代基中脂肪链含量越多时其值越小,当取代基中羰、羟基、羧基及酯类含量增多时,该值则变大,堵塞过程中,该值变小,表明DOM芳香环取代基中脂肪链的含量增多。SR值的大小与有机物分子量有关,此值越大,有机物分子量越小,堵塞过程中,该值变小,表明有机物分子量变大。SUVA254值越大,EOM的芳香性就越大[2],其组分中包含的含苯环化合物就越多,堵塞发生后,该值变小,表明出水组分中含苯化合物减少。波长226~250 nm处的吸收带主要由不饱和π—π键产生,波长260~400 nm处吸收带主要由苯环结构产生,因此该波段吸收峰面积积分大小A226~250和A260~400能体现大分子苯环结构变化信息,堵塞发生时这两个值均变小,表明出水中大分子苯环结构减少,这与其他几个紫外吸收特征指标结果相一致。
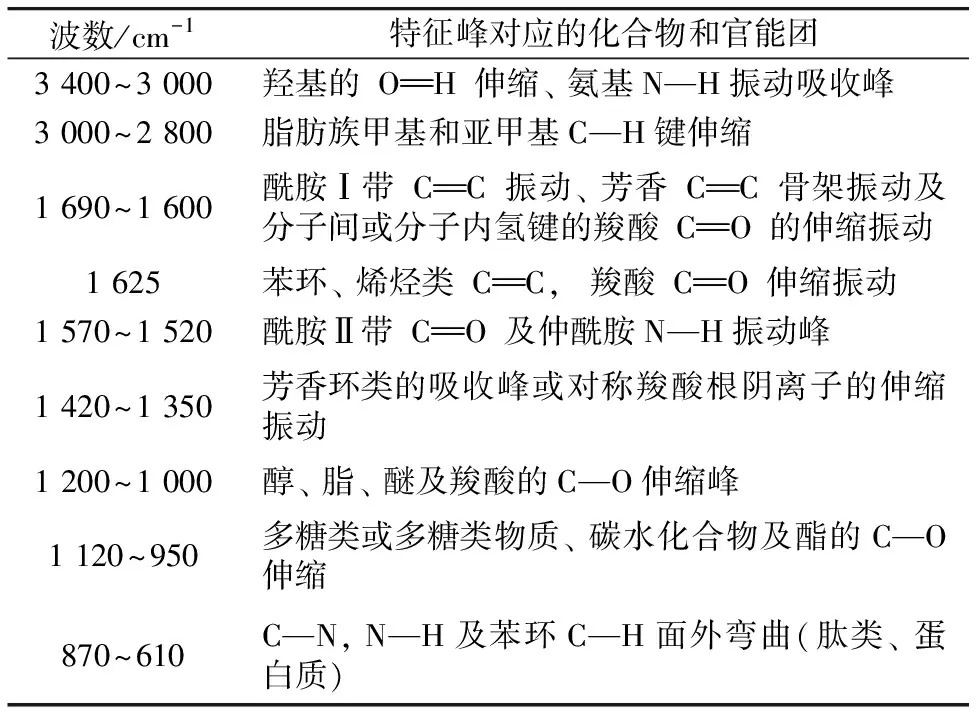
表2 堵塞前后傅里叶红外光谱特征峰对应的化合物和官能团Table 2 Compounds and functional groups correspondingto the FTIR peaks before and after cloggings
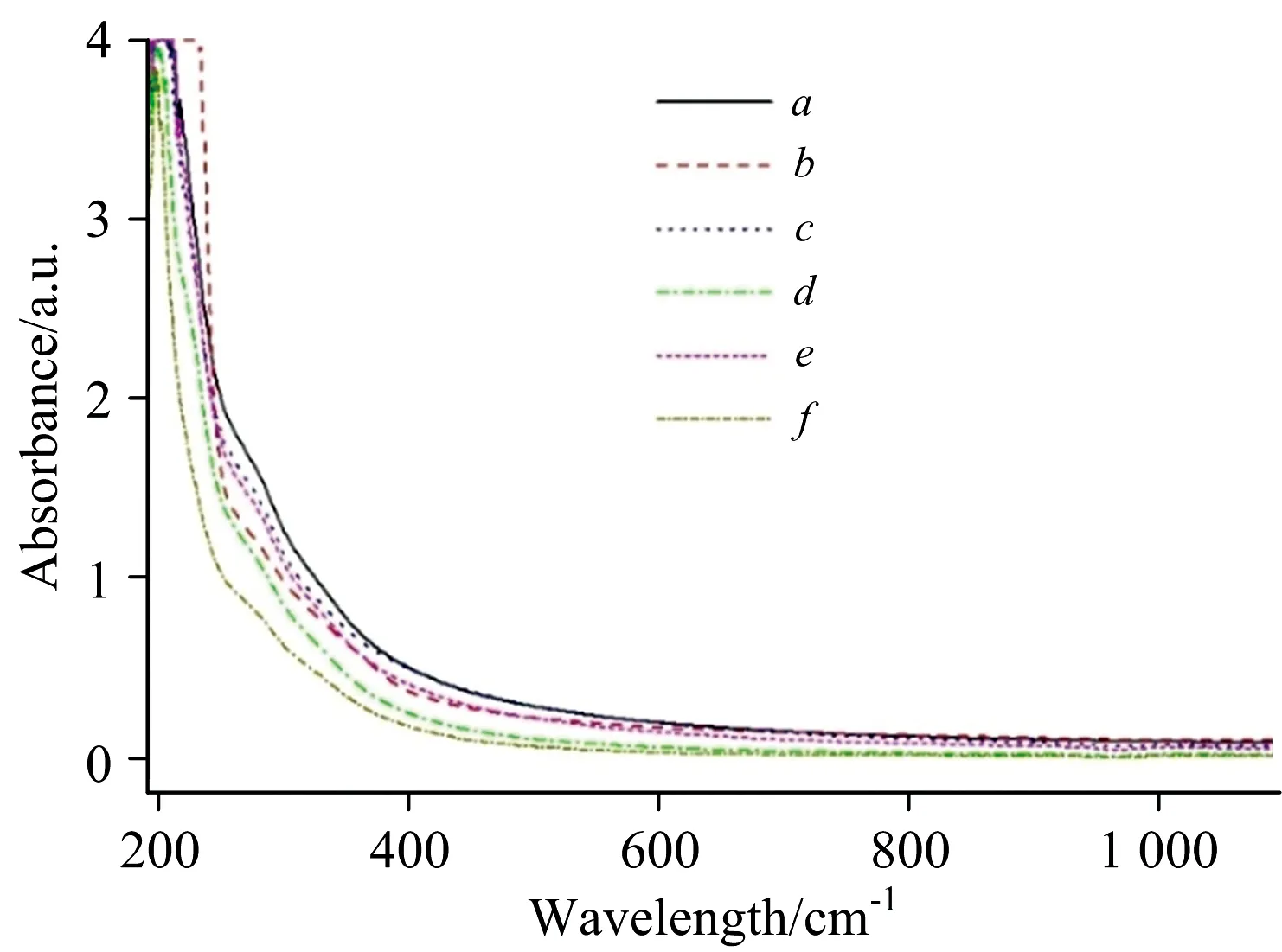
图4 堵塞前后DOM紫外-可见吸收特征光谱Fig.4 UV-Vis absorption spectra of DOMbefore and after cloggings
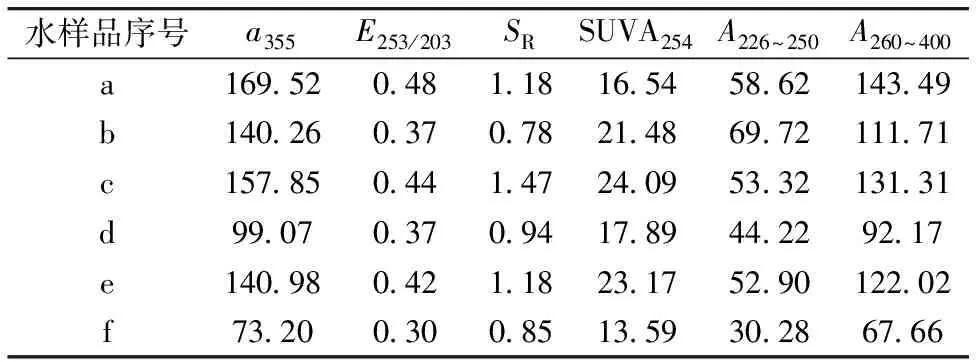
表3 堵塞前后溶剂性有机物的紫外-可见吸收光谱特征参数Table 3 UV-Vis absorption spectral characteristicparameters of DOM
注: a和b分别表示堵塞前进、出水,c和d分别表示堵塞时进、出水,e和f分别表示堵塞后进、出水
2.2 堵塞的微生物学分析
为了阐释堵塞发生的微生物学机理,取堵塞时的表层土壤S1、底层土壤X1,做了细菌和真菌的16S rDNA和18S rDNA,同原位土壤Y1的菌群进行微生物多样性分析比较。细菌16S样品PCR扩增引物为338F_806R,真菌18S样品PCR扩展引物为SSU0817F_1196R。PCR扩增完成后进行纯化,并用Picogreen染料荧光计对PCR产物进行定量并均一化混匀,而后对PCR产物进行测序,测序平台为Illumina MiSeq,测序工作由上海美吉生物医药科技有限公司完成,部分生物信息分析在该公司的I-Sanger云平台上完成。
本研究通过Simpson指数和Shannon指数来研究环境中微生物的多样性。Simpson指数值越大,表明群落多样性越低。Shannon值越大,表明群落多样性越高。计算出细菌16S rDNA在OUT水平下原位土壤Y1、表层土壤S1、底层土壤X1的Simpson指数分别为0.004 4,0.057 3和0.004 0,Shannon指数分别为5.877 0,4.560 8和6.037 4; 真菌18S rDNA在OUT水平下原位土壤Y1、表层土壤S1、底层土壤X1的Simpson指数分别为0.105 2,0.328 8和0.097 9,Shannon指数分别为2.794 9,1.506 8和2.879 8。从Simpson指数来看,细菌16S rDNA的群落多样性为X1>Y1>S1; 真菌18S rDNA的群落多样性也为X1>Y1>S1。并且细菌的群落多样性大于真菌的群落多样性。堵塞时表层土壤S1的群落多样性最低,分析认为由于表层土壤受到进水的冲击负荷最大。底层土壤X1的群落多样性最大,比原位土壤Y1的群落多样性要大,表明土壤渗滤系统中的污水进入土壤之后微生物群落多样性增加,比较三者微生物群落组成特性,有可能揭示引发堵塞的主要微生物群落。
真菌中,S1样品中纲一级的优势菌主要包括Gammaproteobacteria(相对丰度36.5%)γ-变形杆菌纲,Betaproteobacteria(13.4%)β-变形菌纲,Actinobacteria(11.5%)放线菌纲和Alphaproteobacteria(8.5%)α-变形菌纲; Y1样品中纲一级的优势菌主要包括Actinobacteria(36.2%)放线菌纲,Alphaproteobacteria(18.7%)α-变形菌纲,Acidobacteria(8.7%)酸杆菌纲和Betaproteobacteria(7.2%)β-变形菌纲; X1样品中纲一级的优势菌主要包括Actinobacteria(22.8%)放线菌纲,Acidobacteria(15.5%)酸杆菌纲,Alphaproteobacteria(12.8%)α-变形菌纲和Clostridia(10.4%)梭状芽孢杆菌纲。可见,三样品在纲一级的优势细菌都含有Actinobacteria和Alphaproteobacteria两类。S1样品中属一级的优势菌主要有Arenimonas(22.2%)铁矿沙单孢菌,Ramlibacter(4.6%)分枝杆菌和Nannocystis(3.4%)纳囊藻属; Y1样品中属一级的优势菌主要有norank _c_Acidobacteria(6.0%)酸杆菌纲,norank _f_Nitrosomonadaceae(3.6%)亚硝化单胞菌属和Gaiella(2.6%); X1样品中属一级的优势菌主要有norank_c_Acidobacteria(11.4%)嗜酸细菌属,norank _c_KD4-96(3.7%)和Gracilibacter(2.8%)纤细杆菌属。
细菌中,S1样品中纲一级的优势菌主要包括unclassified_d_Eukaryota(相对丰度49.8%)真核生物纲,Intramacronucleata(40.0%)髓内核瘤纲,Sordariomycetes(3.4%)粪壳菌纲和Eurotiomycetes(2.1%)散囊菌纲; Y1样品中纲一级的优势菌主要包括Sordariomycetes(37.2%)粪壳菌纲,Dothideomycetes座囊菌纲(30.5%),Eurotiomycetes(10.0%)散囊菌纲和norank_k_Fungi(5.4%)真菌纲; X1样品中纲一级的优势菌主要包括Sordariomycetes(45.6%)粪壳菌纲,norank_k_Fungi(13.6%)真菌纲,Dothideomycetes(11.6%)座囊菌纲和Eurotiomycetes(10.4%)散囊菌纲。可见,样品Y1和X1在纲一级的优势真菌完全相同。S1样品中属一级的优势菌主要有unclassified_d_Eukaryota(49.8%)真核生物,norank_f_Colpodea(22.3%)有足类纤毛虫和Pseudoplatyophyra(17.4%)假盘藻; Y1样品中属一级的优势菌主要有unclassified_o_Pleosporales(25.4%)格孢腔菌,norank _o_Sordariales(17.2%)粪壳菌和Fusarium(14.5%)镰刀菌; X1样品中属一级的优势菌主要有norank _o_Sordariales粪壳菌(21.5%),unclassified_o_Sordariales粪壳菌(13.9%)和norank_k_Fungi(13.6%)真菌。
3 结 论
(1)系统完全堵塞之前,经过处理之后,DOM转变为类富里酸,属于类腐殖质类物质。而当系统发生了堵塞,DOM的组成基本不变,只是进水中原本存在的类蛋白峰发生了微弱的红移,有发生转化的趋势,荧光峰的相对强度减弱,表明DOM的浓度减小。
(2)进出水DOM主要成分为糖类、酚类、脂类、有机酸及芳香类有机物。堵塞的发生对去除有色DOM浓度是有利的,并且出水中大分子苯环结构减少。
(3)反应器发生堵塞时,下层土壤样品微生物多样性要大于上层,细菌的群落多样性要大于真菌的群落多样性。土壤样品中纲一级的主要优势细菌为Actinobacteria放线菌纲和Alphaproteobacteria α-变形菌纲的菌群,主要优势真菌为Sordariomycetes粪壳菌纲和Eurotiomycetes散囊菌纲的菌群。
