FTIR结合主成分分析鉴别残留包衣剂的玉米幼苗
2020-05-29李栋玉时有明
李栋玉,时有明*,刘 刚
1. 曲靖师范学院物理与电子工程学院,云南 曲靖 655011 2. 云南师范大学物理与电子信息学院,云南 昆明 650500
引 言
土传病害是玉米种植中常见的病害,也是影响玉米产量最严重的病害。玉米播种后,土壤中的致病真菌、细菌病原体在种子萌发时侵入玉米胚芽,最终对植株造成严重的影响[1]。为了解决土传病虫害对玉米种植的威胁,目前常采用玉米种子包衣技术来应对。在播种前利用包衣剂农药涂于玉米种子表面,对种子进行包裹。包衣剂通常由杀菌剂和杀虫剂混合而成[2]。虽然包衣剂阻断了病原体和害虫对玉米种子的侵蚀,但是随着玉米种子的萌发和生长,包衣剂将逐渐被玉米根系吸收,进入玉米茎叶,造成农药在植株内的残留[3]。目前农药残留的检测主要通过对样品进行萃取后使用超高效液相色谱、质谱等进行分析。这些检测方法需要对样品进行提取、净化等复杂程序,耗时且检测费用高[4]。近年也有开展表面增强拉曼光谱在农药残留检测中的研究报道,检测灵敏度高,但光谱测试时需制作金纳米棒等增强基底,测试过程也显得复杂[5]。使用傅里叶变换红外光谱(FTIR)定性检测植物中某些农药残留与色谱、质谱和表面增强拉曼光谱相比具有快速、便捷等优点,测试时无需对样品进行特殊处理。Xiao等[6]利用FTIR成功鉴别1∶1 000稀释后的毒死蜱农药在苹果皮中的残留。Sharma等[7]利用FTIR对重金属污染的玉米幼苗进行研究,发现铜使得玉米幼苗的果胶、氨基酸等含量增加。Sharma等[8]利用FTIR对线虫侵染的秋葵根进行研究,得到淀粉、蛋白质等营养物质的变化规律。FTIR研究植物样品时无需对样品进行萃取等过程,在定性分析方面具有经济、快速和便捷等优点。因此利用FTIR结合主成分分析鉴别残留包衣剂农药的玉米幼苗。
1 实验部分
1.1 样品采集与测试
选用同一杂交玉米品种(乐玉1号,四川丰大种业有限公司),经过包衣剂包裹的玉米种子作为实验组,未进行包衣剂包裹的玉米种子作为对照组。两组玉米种子在相同土壤、气候、湿度条件下播种,进行平行对照试验。播种15天后选取长势一致的实验组和对照组玉米幼苗(整株含根部器官)各5株,此后每隔10 d收取实验组和对照组整株玉米苗各5株。实验组和对照组分别获得生长期为15, 25和35 d三个时间段的15株玉米幼苗样品。玉米幼苗采集后清洗干净,在27 ℃下进行干燥处理。干燥后剪取每株玉米幼苗的胚根和下层叶片分别研磨为粉末,用电子天平按3∶300 mg比例称量样品粉末和溴化钾混合,研磨均匀后压片测试。测试的红外光谱仪为美国Thermo Nicolet公司的Avatar FTIR 360光谱仪(扫描次数: 32次,分辨率: 2 cm-1,扫描范围: 4 000~400 cm-1)。实验组和对照组各自获得叶片光谱15条和根光谱15条。
1.2 数据预处理
光谱测试时通过差谱技术处理,扣除背景吸收光谱。采用Omnic 8.0软件进行吸光度归一化处理和基线校正。实验组(对照组)在同一生长期收获的5株样品相当于5次重复性实验。使用SPSS 22.0软件对玉米叶片(根)的5次重复性实验的光谱进行偏相关分析,偏相关系数均大于0.99,表明5次重复测量的光谱几乎一致,实验具有重复性。
2 结果与讨论
2.1 纤维素和玉米种子包衣剂农药的傅里叶变换红外光谱特征
玉米叶片和根的主要成分是纤维素,它们的红外光谱在特征区呈现出纤维素的强吸收。为了便于对比研究含与不含包衣剂残留的叶、根的光谱,测试了纤维素和包衣剂农药的红外光谱,见图1。纤维素的光谱在3 348 cm-1附近出现羟
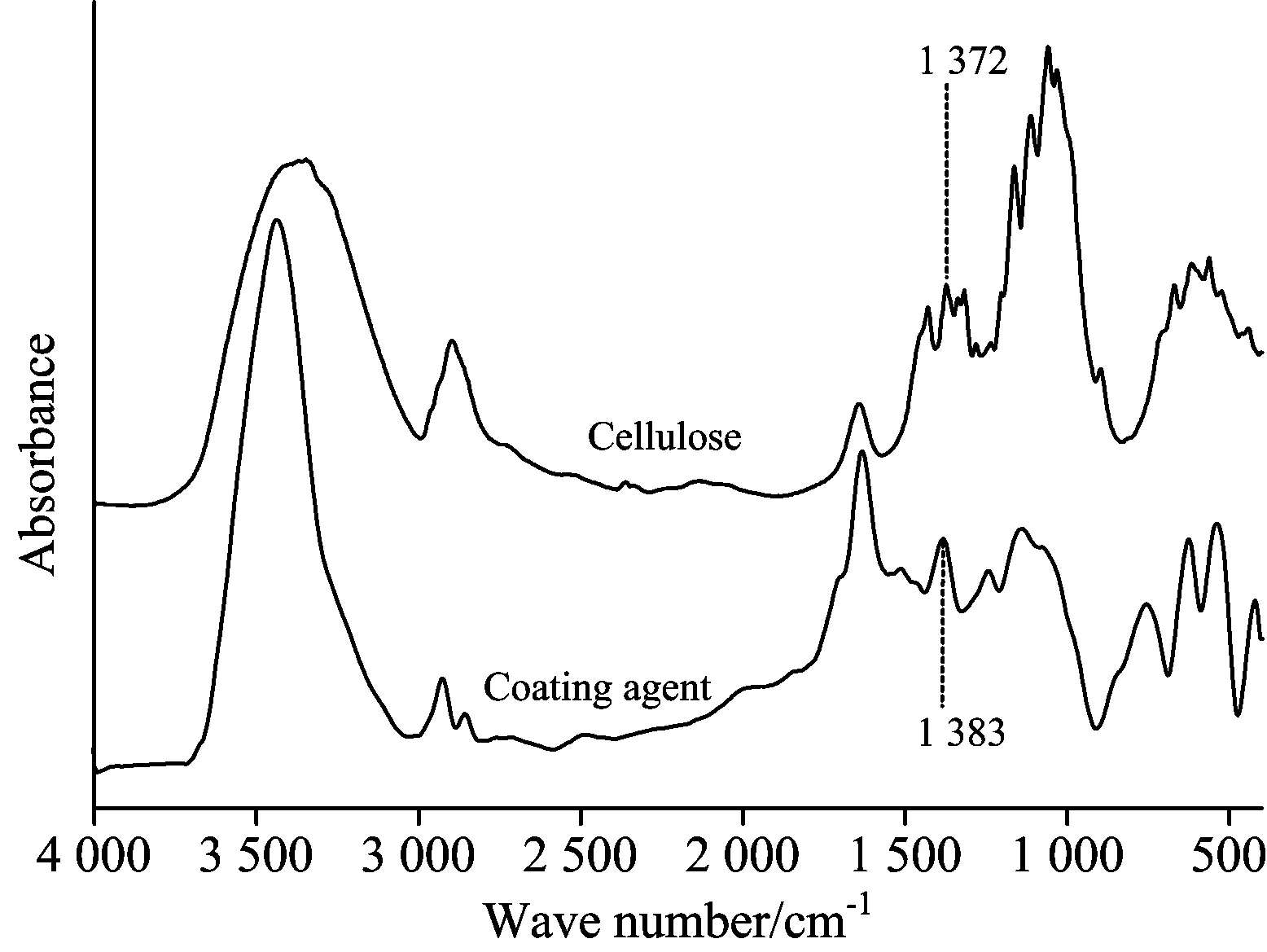
图1 玉米种子包衣剂和纤维素的傅里叶变换红外光谱Fig.1 FTIR spectra of maize seed coating agent and cellulose
基的特征吸收峰,包衣剂农药的光谱则在3 437 cm-1附近出现以氨基为主的强吸收,该峰可能还含有羟基吸收的叠加。羟基和氨基的吸收峰差异明显,羟基的吸收峰较宽,而氨基的吸收峰则较为尖锐[9]。3 000~2 800 cm-1范围内两者的吸收带主要是甲基和亚甲基的吸收叠加峰。在纤维素的光谱中,1 372 cm-1附近出现了C—H的弯曲振动,但在包衣剂农药的光谱中C—H的弯曲振动吸收出现在1 383 cm-1处[10]。纤维素最为明显的特征峰出现在1 162,1 114,1 060和1 030 cm-1附近,主要源于C—O键的振动吸收,并且这四个特征峰叠加后形成了纤维素特有的叠加带峰形。
2.2 包衣剂农药在玉米根中残留情况的傅里叶变换红外光谱分析
经过包衣剂包裹和未包裹的玉米种子种植后,三个生长时期的幼苗根的红外光谱见图2。三个生长阶段的对照组(种子未经包衣剂包裹)和实验组(种子经过包衣剂包裹)的6条光谱在3 404,2 922和1 732 cm-1附近的三个吸收峰的峰形基本一致,波数位置相互偏差小于3 cm-1。玉米根光谱中3 404 cm-1的吸收峰不仅包含了羟基的吸收峰,还包含了氨基的吸收峰。2 922 cm-1吸收峰来源于亚甲基的非对称伸缩振动吸收,1 732 cm-1附近的吸收峰来源于羰基[11]。1 200~800 cm-1范围内,实验组和对照组的光谱均在1 157,1 103和1 050 cm-1附近出现纤维的特征吸收峰,峰形上呈现三级递增形状,与图1中纤维素在该范围内的峰形一致。纤维素的红外光谱中(见图1),在1 060和1 030 cm-1位置存在吸收峰,但在玉米根的红外光谱中,这两个吸收峰相互叠加,导致叠加峰的中心频率移至1 050 cm-1。根的红外光谱中低于900 cm-1的吸收带较弱且叠加严重,不能直接分辨出特征峰。

图2 种子经过包衣剂包裹和未包裹的玉米幼苗根的红外光谱Fig.2 FTIR spectra of maize seedling rootswith and without coating agent
对比试验组和对照组玉米幼苗根的光谱,两者最大的差异处于1 488~1 295 cm-1吸收带(图2阴影带范围),无需对光谱进行处理就可以明显分辨出两者的差异。在该范围内对照组的相对吸收强度比实验组弱。实验组在1 384 cm-1附近的吸收峰较为尖锐,从吸收带的形状上可区别于对照组。三个生长阶段,实验组在该范围内的吸收峰都出现在1 384 cm-1位置,而对照组分别出现在1 375,1 375和1 372 cm-1位置。在纤维素和包衣剂农药的红外光谱中,纤维素C—H的弯曲振动在1 375 cm-1,包衣剂农药C—H弯曲振动在1 384 cm-1。通过对比可以确定实验组根的红外光谱中1 384 cm-1尖锐的吸收峰是由于玉米包衣剂农药的残留引起。该峰可以作为包衣剂农药残留检验的目标对象。光谱经过纵坐标归一化后,对照组1 375 cm-1吸收峰的相对强度随着植株生长有增强的趋势,说明随着植株生长纤维素含量在增加。而实验组1 384 cm-1吸收峰的相对强度随着植株生长逐渐减弱,这是由于农药残留由根运输进入玉米地上器官,导致根中的农药残留浓度逐渐降低。
2.3 包衣剂农药在玉米叶片中残留情况的傅里叶变换红外光谱分析
对照组和实验组幼苗的三个生长时期叶片的红外光谱见图3。对比对照组和实验组的光谱,两者差异最大的吸收峰在1 565 cm-1附近的酰胺Ⅱ带和1 375 cm-1附近的C—H弯曲振动吸收带。实验组玉米幼苗叶片光谱中在酰胺Ⅱ带位置均出现明显的肩峰,而在对照组玉米幼苗叶片光谱中该肩峰则未能观察到。经过包衣剂农药包裹种子的幼苗叶片,随着植株的生长,酰胺Ⅱ带呈现减弱的趋势,肩峰逐渐消失。未经过包衣剂农药包裹种子的幼苗叶片光谱中,酰胺Ⅱ带位置均没有出现肩峰。对照组玉米幼苗光谱C—H的弯曲振动吸收峰均出现在1 375 cm-1附近,而实验组的玉米幼苗均出现在1 384 cm-1附近。结合图1,可以再次确定1 375 cm-1吸收峰主要来自于纤维素,1 384 cm-1吸收峰主要来源于玉米包衣剂农药的残留。

图3 种子经过包衣剂包裹和未包裹的玉米幼苗叶片的红外光谱Fig.3 FTIR spectra of maize seedling leaves ofseeds with and without coating agent
在含有包衣剂农药残留的叶片光谱中,导致1 375 cm-1吸收峰没有被观察到的原因是1 384 cm-1的吸收带强于1 375 cm-1的吸收带,两者相互叠加,导致1 375 cm-1的吸收峰被掩盖,最终呈现1 384 cm-1的吸收峰。对残留包衣剂叶片光谱的1 384 cm-1叠加带进行傅里叶自去卷积(Fourier self-deconvolution, FSD),见图4,可剥离出1 375 cm-1的吸收子峰,进一步证实了上述的分析。
2.4 玉米幼苗根和叶红外光谱的主成分分析
为了便于清楚地对比含农药残留和未含农药残留的玉米叶片、根部器官的光谱规律,对其傅里叶变换红外光谱中的主要吸收带进行统计和归属[12-15],见表1。
红外光谱可视为高维度数据,往往存在一定的数据冗余,冗余数据会干扰有用信息的获取。为了快速区别包衣剂农药残留的玉米植株,主成分分析(principal component analysis,PCA)方法用于对根、叶的红外光谱进行降维处理。考虑到基线漂移的影响和提高光谱叠加带的分辨率,先对红外光谱进行二阶导数处理,再使用二阶导数光谱进行降维运算。分别对叶、根的30个样本的二阶导数光谱进行单因素方差分析,显著性(p值)小于0.01,表明样品的光谱具有显著的统计意义。实验组和对照组玉米幼苗根的二阶导数光谱进行主成分分析降维后,提取的前两个主成分累计已经包含了92%的光谱信息。同样的处理方法对实验组和对照组玉米幼苗叶片的二阶导数光谱进行降维,前两个主成分累计已经包含了96%的光谱信息。根、叶的二阶导数光谱前两个主成分的得分图见图5(g1—g15是根对照组样本,a1—a15是根实验组样本; y1—y15是叶片对照组样本,b1—b15是叶片实验组样本)。从图5可看出,根的实验组和对照组的聚类图中样本散点没有重叠,表明实验组和对照组玉米幼苗根的光谱存在差异,通过光谱可以将两者区分开。叶片实验组和对照组虽然也分为两类,但类间距离较近,y13和b14两个样品不能准确判定,鉴别准确率为93%。随着幼苗生长时间的增加,包衣剂农药在叶片内的残留逐渐降低,导致1 384 cm-1吸收峰的强度减弱,光谱中主要以1 375 cm-1吸收峰呈现出来,在FSD光谱中也证实了该变化规律。b14属于生长时间为35 d的样本,包衣剂残留相对生长前期浓度降低,1 384 cm-1吸收峰强度减弱,导致b14和y13之间的类间距离减小,出现散点的交叉,而未能准确鉴别。

图4 种子经过包衣剂包裹的玉米幼苗叶片的傅里叶自去卷积红外光谱Fig.4 FSD infrared spectra of maize seedling leaves of seeds with coating agent
3 结 论
通过傅里叶变换红外光谱对包衣剂包裹种子的玉米幼苗进行研究,并与未经过包衣剂包裹种子的玉米幼苗的光谱进行对比。发现经过包衣剂包裹种子的玉米幼苗,其根和叶片的红外光谱中均在1 384 cm-1附近出现C—H弯曲振动的特征吸收峰,而未经过包衣剂包裹种子的玉米幼苗的根和叶的红外光谱中C—H弯曲振动吸收峰均出现在1 375 cm-1附近。对比包衣剂的红外光谱,证实1 384 cm-1的特征峰来自农药残留的吸收。尤其在根的红外光谱中,农药残留在1 384 cm-1的特征峰较为尖锐,特征明显。因此1 384 cm-1吸收带可作为玉米幼苗植株中包衣剂残留检测的目标对象。对玉米幼苗根和叶片的二阶导数光谱进行主成分分析后,前两个主成分的得分图显示含农药残留和不含农药残留的根样品散点图没有重合,含农药残留和未含农药残留的根被全部鉴别出来,正确识别率为100%。但含农药残留和不含农药残留的叶片样品散点有交叉,正确识别率为93%。傅里叶变换红外光谱技术具有便捷、快速等优点,结合主成分分析可有效识别含有包衣剂农药残留的玉米幼苗植株。该研究为农作物植株内农药残留的鉴别提供一种便捷方法。

表1 玉米幼苗叶片和根的傅里叶变换红外光谱主要吸收带归属Table 1 General band assignments of the FTIR spectra of maize seedling root and leaf

图5 玉米幼苗根和叶片二阶导数光谱的主成分分析 Fig.5 PCA of secondary derivative spectra from corn seedling roots and leaves
