急性ST段抬高心肌梗死患者合并新发心房颤动的危险因素
2020-05-29廖伟民曾美群欧阳玉珍
夏 彬 廖伟民 曾美群 欧阳玉珍 李 芳 徐 华
(中国人民解放军南部战区空军医院心血管内科,广东省广州市 510000,电子邮箱:393447151@qq.com)
心律失常是急性ST段抬高心肌梗死(acute ST-segment elevation myocardial infarction,ASTEMI)患者最常见的并发症之一,其发生率为60%~75%[1]。目前认为缺血导致心肌梗死后纤维化,以及梗死边界存活心肌细胞发生电生理重构,是心肌梗死后心律失常发生的解剖学基础。心肌梗死后3~5 d,心肌细胞开始启动增殖修复,成纤维细胞活性增强[2];但若修复过于活跃,则会导致梗死区域以外的心肌成纤维化,触发心律失常发生。其中,梗死区域周边或非梗死区域中形成的间质纤维化,使心肌细胞被各种不具有传导功能的胶原所分割,更容易诱发异位心律、慢性心律失常以及折返性心律失常[3]。新发心房颤动(new-onset atrial fibrillation,NOAF)是ASTEMI患者常见的并发症之一,是指患者在ASTEMI前无明确的心房颤动病史,且心房颤动首次发生在ASTEMI病程中,包括阵发性心房颤动和持续性心房颤动,其发病率为6%~21%[4]。NOAF患者的近、远期死亡率和主要不良心血管事件发生率均明显增高[5],但其发病机制尚不明确,目前考虑可能与心包炎、心房缺血或心房梗死、左房压力增大、代谢异常、药物毒性、电解质紊乱、神经内分泌功能失调和物理压力等有关。一项荟萃分析结果显示,NOAF患者或既往有心房颤动患者的死亡优势比均较高[6]。还有研究表明,住院期间出现NOAF的ASTEMI患者死亡率及卒中风险增高,预后更差[7]。因此,探讨ASTEMI患者合并NOAF的危险因素,对降低患者病死率和改善预后有积极意义。
1 资料与方法
1.1 临床资料 回顾性分析2016年1月至2018年1月我院心血管内科收治的278例ASTEMI患者的临床资料。所有患者均符合我国2015年《ST段抬高型心肌梗死的诊断和治疗指南》的诊断标准[8]:(1)具有典型缺血性胸痛症状并持续超过30 min不缓解;(2)18导联心电图提示2个或2个以上相邻导联ST 段弓背向上抬高,肢体导联抬高≥0.1 mV,胸导联抬高≥0.2 mV,或者新发左束支传导阻滞;(3)伴或不伴有心肌损伤标志物升高;(4)发病时间<12 h或者发病12~24 h内,临床和(或)心电图提示仍有进行性缺血胸痛的证据。排除标准:患有风湿性心脏瓣膜病、先天性心脏病、持续和永久性心房颤动、感染性疾病、严重肝肾功能不全、甲状腺疾病、自身免疫性疾病、合并恶性肿瘤等。ASTEMI合并NOAF的标准:患者在出现ASTEMI前无明确的心房颤动病史,并且心房颤动首次出现在急性冠状动脉综合征病程中,包括阵发性和持续性的心房颤动。根据是否为ASTEMI合并NOAF分为观察组(房颤组)88例和对照组(非房颤组)190例。本研究已获取患者知情同意,并经医院伦理委员会讨论同意后开展。
1.2 研究方法 (1)一般资料的收集:性别、年龄、既往病史及用药情况,入院时血压、心率、心泵功能分级(Killip分级)、Grace分值等。其中,根据患者入院时的年龄、心率、收缩压、肌酐、心泵功能分级、是否有已知心脏事件、心肌酶、ST 段变化情况计算Grace分值,Grace分值≤108 分为低危,109~140 分为中危,>140分为高危。吸烟定义为既往连续或累积吸烟6个月或以上。(2)辅助检查结果:记录入院时血常规、肝肾功能、空腹血糖和血脂、 N末端B型钠尿肽前体(N-terminal pro-B-type natriuretic peptide,NT-proBNP)、C反应蛋白水平,以及住院期间磷酸肌酸激酶同工酶(creatinine kinase-MB isoenzyme,CK-MB)峰值。(3)心脏彩超检查结果:冠状动脉造影术后3 d行床边经胸心脏彩超检查,测量患者左心房内径(left atrium diameter,LAD)、左心室射血分数(left ventricular ejection fraction,LVEF)和左心室后壁舒张末期厚度(left ventricular end-diastolic posterior wall thickness,LVPWTd)。(4)治疗情况:记录急诊冠状动脉造影术中的冠状动脉靶血管及病变程度,是否行主动脉内球囊反搏术,以及住院期间使用抗血小板、血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)、β受体阻滞剂、低分子肝素、他汀类药物等治疗情况。(5)住院期间的主要不良心脏事件发生情况:包括再发心绞痛、心力衰竭加重、严重心律失常、心源性猝死、心脏破裂。
1.3 统计学分析 采用SPSS 18.0软件进行统计分析。符合正态分布的计量数据以(x±s)表示,组间比较采用两独立样本t或t′检验,非正态分布者以[M(P25,P75)]表示,比较采用秩和检验;计数资料以例数和百分比表示,组间比较采用χ2检验;影响因素分析采用Logistic回归模型。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者的一般资料比较 观察组的年龄、心率、有高血压史者比例、心泵功能分级≥Ⅱ级者比例、Grace评分≥109分者比例均大于或高于对照组,舒张压、男性比例、有吸烟史者比例均小于或低于对照组(均P<0.05)。见表1。

表1 两组患者的一般资料比较

组别n糖尿病史[n(%)]卒中史[n(%)]血脂异常史[n(%)]吸烟史[n(%)]心泵功能分级≥Ⅱ级[n(%)]Grace评分≥109分[n(%)]观察组8826(29.55)4(4.55)41(46.59)34(38.64)49(55.68)84(95.45)对照组19043(22.63)17(8.95)104(54.74)105(55.26)50(26.32)160(84.21) t/t'/χ2值1.5411.6691.5996.65122.6207.084P值0.2150.1960.2060.010<0.0010.008
2.2 两组患者实验室检查及心脏彩超结果比较 观察组的血清肌酐、NT-proBNP、C反应蛋白、LAD水平均高于对照组,血红蛋白、LDL-C水平均低于对照组(均P<0.05);两组的其他实验室检查及心脏彩超结果比较,差异均无统计学意义(均P>0.05)。见表2。

表2 两组患者实验室检查及心脏彩超结果

组别nNT-proBNP[M(P25,P75),pg/mL]总胆固醇(x±s,moL/L)LDL-C(x±s,moL/L)C反应蛋白[M(P25,P75),mg/dL]LAD(x±s,mm)LVPWTd(x±s,mm)LVEF(x±s,%)观察组883 251.10(1 352.47,4 782.32)1.23±0.513.03±1.1915.29(6.34,26.22)39.73±6.7047.33±5.5256.17±8.85对照组1901 122.50(952.26,3 256.45)1.05±0.953.37±1.119.47(2.11,19.33)36.10±4.1246.43±5.0157.26±7.49 t/t'/Z值5.2421.383-3.2323.1204.6881.348-1.064P值<0.0010.076 0.0210.001<0.0010.179 0.288
2.3 两组冠状动脉造影结果及用药情况比较 观察组的β受体阻滞剂和ACEI的使用率均低于对照组,行主动脉内于求囊反搏术者比例高于对照组(均P<0.05);两组其他冠状动脉造影及用药情况比较,差异均无统计学意义(均P>0.05)。见表3。

表3 两组冠状动脉造影及用药情况[n(%)]
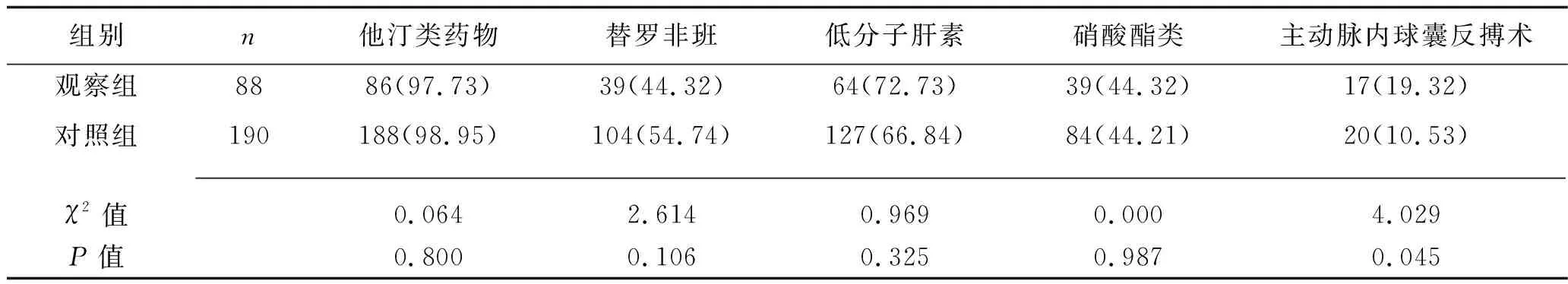
组别n他汀类药物替罗非班低分子肝素硝酸酯类主动脉内球囊反搏术观察组8886(97.73)39(44.32)64(72.73)39(44.32)17(19.32)对照组190188(98.95)104(54.74)127(66.84)84(44.21)20(10.53) χ2值0.0642.6140.9690.0004.029P值0.8000.1060.3250.9870.045
2.4 影响ASTEMI合并NOAF的多因素Logistic回归分析 将上述单因素分析中具有统计学意义的年龄、入院时心率、舒张压、性别、高血压史、吸烟史、心泵功能分级、Grace评分、C反应蛋白、NT-proBNP、血清肌酐、NOAF前应用β受体阻滞剂和ACEI类药物情况、LAD、血红蛋白、LDL-C、主动脉内球囊反搏率作为自变量,ASTEMI合并NOAF发生情况为因变量,进行多因素Logistic回归分析(变量赋值情况见表4)。结果显示,高龄和心泵功能分级≥Ⅱ级为ASTEMI合并NOAF的独立危险因素,应用β受体阻滞剂为保护因素(均P<0.05),见表5。

表4 变量赋值情况

表5 ASTEMI合并NOAF的多因素Logistic回归分析
2.5 两组住院期间主要不良心血管事件发生率比较 观察组的再发心绞痛发生率低于对照组,心力衰竭加重、严重心律失常、心源性猝死发生率高于对照组(均P<0.05);两组的心脏破裂发生率差异无统计学意义(P>0.05)。见表6。

表6 两组住院期间主要不良心血管事件发生率比较[n(%)]
3 讨 论
ASTEMI合并心律失常的原因多为心肌缺血后解剖学和电生理学方面的改变;心肌缺血缺氧导致心肌细胞损伤、坏死,心肌细胞电活动不稳定性增加,可诱发心律失常的发生;同时交感神经过度兴奋,通过神经-体液调节导致血液儿茶酚胺水平显著升高,可增高心肌细胞自律性和兴奋性,引起心动过速[9]。NOAF是ASTEMI后较常见的心律失常类型之一[10],而ASTEMI合并NOAF与恶性心律失常相关[11]。ASTEMI合并NOAF诱发恶性心律失常可能与心肌缺血后心肌细胞重塑及瘢痕组织形成有关[12]。一项荟萃分析结果显示,急性心肌梗死合并NOAF患者住院期间的主要不良心脏事件发生率高于窦性心律患者[13]。本研究结果显示,住院期间观察组发生心力衰竭加重、严重心律失常、心源性猝死的比例高于对照组(均P<0.05),与上述研究结果相似。
ASTEMI合并NOAF的机制非常复杂,目前的研究表明其与左心房压力升高、心房缺血、交感神经兴奋、炎性反应的激活等因素密切相关[14]。因此,寻找预测NOAF的危险因素,并提早进行干预,具有积极的临床意义。既往流行病学调查显示,高龄与ASTEMI合并NOAF密切相关[13]。还有研究显示,NOAF发生风险随LAD增加而升高,LAD每增加5 mm,NOAF的发生风险提高39%[6]。本研究结果显示,观察组患者的年龄和LAD均大于对照组,且Logistic回归分析结果显示,年龄为ASTEMI合并NOAF的独立危险因素(均P<0.05),与上述研究结果相似,提示年龄和LAD与ASTEMI合并心房纤颤相关。既往Meta分析结果显示,心泵功能分级≥Ⅱ级的ASTEMI患者发生NOAF的风险是心泵功能分级为Ⅰ级患者的2.29倍[15]。目前认为急性心肌梗死心泵功能不全导致NOAF的机制可能与左室功能不全引起舒张末充盈压增高,加重左心房负荷引起电生理的改变有关。本研究结果显示,心泵功能分级≥Ⅱ 级是ASTEMI患者合并NOAF的独立危险因素(P<0.05),与上述研究结果相似。急性心肌梗死患者机体存在神经-体液因子的激活,交感神经过度激活和肾素-血管紧张素-醛固酮系统张力增高,可以促进左心房纤维化和电生理重构,从而导致心房颤动的发生[16]。因此,是否使用β受体阻滞剂或肾素-血管紧张素-醛固酮系统拮抗药与心房颤动发生有一定关联。本研究中,观察组患者使用β受体阻滞剂和ACEI的比例均低于对照组,Logistic回归分析结果显示,使用β受体阻滞剂是ASTEMI患者合并NOAF的保护因子(均P<0.05)。这提示,使用β受体阻滞剂和ACEI可以降低ASTEMI患者合并NOAF的发生风险。
综上所述,高龄和心泵功能分级≥Ⅱ级是ASTEMI患者合并NOAF的独立危险因素,而使用β受体阻滞剂为其保护因素。此外,ASTEMI合并NOAF患者住院期间的并发症发生率高,临床预后不良。因此应针对相关因素进行及早干预,以改善ASTEMI合并NOAF患者预后。
