基于麻味成分的顶坛花椒HPLC指纹图谱研究
2020-05-29敖厚豫李欣余天华杨庆雄
敖厚豫,李欣,余天华*,杨庆雄
(1.贵州师范大学 生命科学学院,贵阳 550001;2.贵州师范大学 喀斯特研究院 国家喀斯特石漠化防治 工程技术研究中心,贵阳 550001;3.贵州师范大学 化学与材料科学学院,贵阳 550001)
贵州顶坛花椒(Zanthoxylumplanispinumvar.dingtanensis)系芸香科花椒属植物竹叶花椒的一个变种[1],由于适宜生长在喀斯特干热河谷地区,被选为贵州石漠化治理地区生态治理的重要经济植物,特别是在以黔西南地区贞丰县为中心的石漠化地区,种植面积超过5万亩,产量稳定,已经成为当地重要的土特农产品,并通过了国家质检总局地理标志产品保护的论证(DB52/T 542-2016)。顶坛花椒是一个区域性特有品种,它区别于花椒(Z.bungeanum)、青花椒(Z.schinifolium)、竹叶花椒(Z.armatum)等花椒市场上常见和分布地域广的几个主要品种,并由于具有“麻味重”、“香味浓”的特点,形成了较为独特的特色产品,是在贵州省石漠化地区多年推广后逐渐培育成的一个具备较大产量规模并形成地区特色产业的重要特色农产品。贵州省的石漠化地区目前正在进一步大规模推广,已经成为“黔货出山”的重要品种。
目前,按照林业行业标准(LY/T 1652-2005)、国标GB/T 30391-2019等,对花椒质量等级的分级,主要包括感官评价和理化指标评价,其中感官指标包括色泽、气味、味道和果形特征等,理化指标包含挥发油含量、水分和固体杂质等,并无对花椒中最具特征的麻味物质的定性定量测定评价,对花椒的质量评价还缺乏整体性,难以反映其内在品质。关于不同花椒的麻味成分已有较多的报道[2-5],特别是通过对比不同植物来源花椒麻味成分组成分析发现,构成麻味成分的不饱和脂肪酸酰胺类组分可作为花椒来源的判断依据和花椒品质评价的重要指标[6-9],红花椒、青花椒、竹叶花椒等不同的花椒品种,具有不同的麻味成分构成指纹图谱。基于花椒的麻味物质基础,在一些花椒主产地,已经开始制订定量测定麻味成分的地方标准[10],作为花椒产品质量的重要指标。
顶坛花椒中富含不饱和长链脂肪酸酰胺和黄酮等多种成分[11,12]。顶坛花椒的质量标准目前仅限于外形的判断和产地的来源等初步方法,未能构建其合理有效的质量控制体系,作为名优特产产品的贵州顶坛花椒,亟需建立一种可以从特色风味物质基础进行质量控制,并能特征性区别于其他花椒产品的有效方法,作为其地理标志产品的鉴别以及品牌的塑造的技术支撑。指纹图谱是一种从整体上研究复杂物质体系的技术,在花椒品种识别中也有报道[13,14]。但顶坛花椒的识别模式和麻味组分的特征未见报道。本文通过收集地理标志产品保护范围内和周边地区的顶坛花椒产品,研究其基于麻味成分的HPLC指纹图谱,同时对其中主要麻味成分的含量进行了测定,为贵州顶坛花椒质量评价提供了科学依据,支撑特色名优农产品的特征性标识和品牌保护。
1 材料
1.1 仪器与试剂
LC-MS 2020高效液相色谱-质谱仪(带PDA检测器) 日本岛津公司;Sartorius BP211D电子天平 德国赛多利斯公司;KQ-300DE型数控超声仪 昆山市超声仪器有限公司;N-1000旋转蒸发仪 上海埃朗公司;WND-500A型高速中药粉碎机 浙江省兰溪市伟能达电器有限公司;超纯水机 美国Millipore公司;LGJ-20F冷冻干燥机 北京松源华兴生物技术有限公司。
羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素对照品(纯度>98%):均购自成都麦德生中药对照品有限公司;甲醇(色谱纯):购自默克股份公司;其他试剂:均为分析纯。
1.2 植物样品
顶坛花椒样品采集自以贵州省贞丰县北盘江镇、平街乡、者相镇、白层镇4个乡镇现辖行政区域为中心的顶坛花椒地理标志产品保护地区范围及其周边地区扩大种植的乡镇,样品标本统一收藏于贵州师范大学喀斯特研究院标本室,顶坛花椒植物样品均由贵州师范大学杨庆雄教授统一鉴定。其他品种花椒购自国内其他花椒主产区。其中样品S1~S15为当地采集后进行晒干处理得到,S16~S32为顶坛花椒采集后1 d内带回实验室冷冻干燥得到。不同批次花椒样品信息见表1。

表1 不同批次花椒样品信息Table 1 Information of different batches of Zanthoxylum bungeanum samples
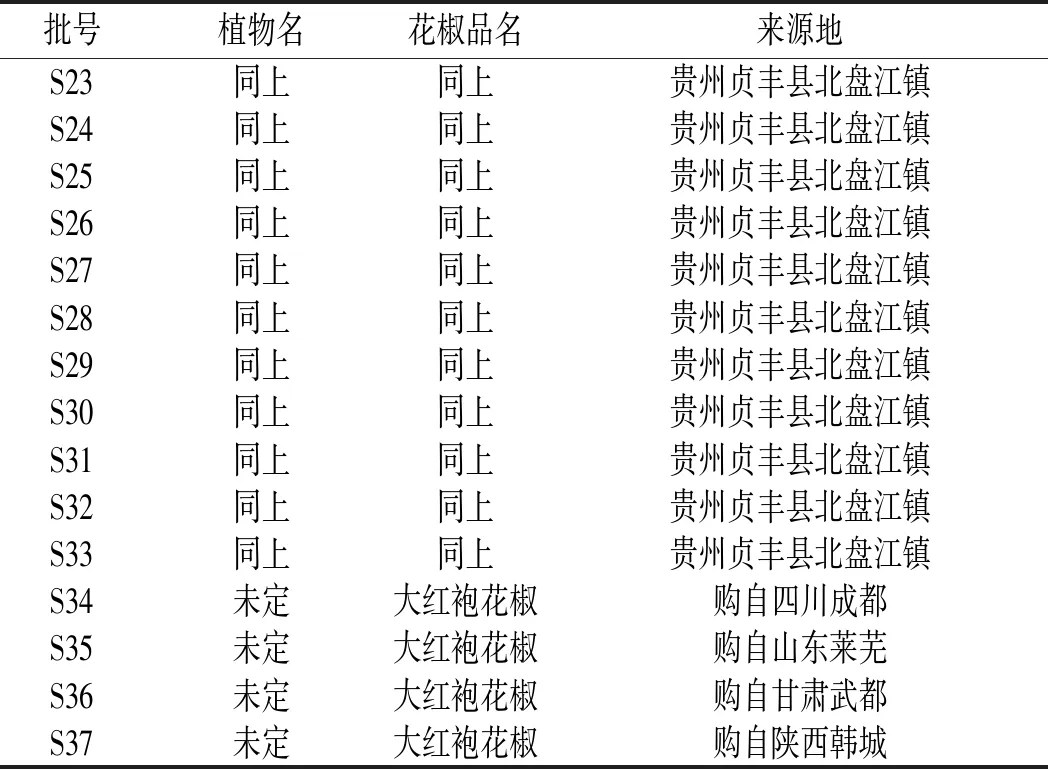
续 表
2 方法与结果
2.1 色谱条件
Phenomenex C18色谱柱(150 mm×4.6 mm,5 μm),流动相甲醇(A)-水(B),梯度洗脱(0~30 min,65%~80% A;30~40 min,80% A),流速0.7 mL/min,柱温30 ℃,检测波长270 nm,进样体积5 μL。
共有峰的质谱数据由LC-MS 2020的单四极杆质谱仪采集得到,ESI离子源,正负离子模式同时采集,扫描分子量范围200~800 m/z;质谱条件:甲醇-水为流动相梯度洗脱(A:水、B:甲醇,0~30 min:67%~80% B,30~45 min:80% B),洗脱流速0.5 mL/min,检测波长270 nm,柱温30 ℃;干燥N2流量15 L/min;接口温度350 ℃,DL温度250 ℃;加热块温度400 ℃;接口电压4.5 kV。
2.2 溶液制备
2.2.1 标准品溶液配制
分别精密称取羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素对照品适量,置于容量瓶中,加入色谱甲醇溶解并定容,得到浓度分别为6.733,7.333,7.133,6.853,8.000,6.667 μg/mL的混合对照品储备液,于4 ℃保存备用。根据实验需要,分别称取不同体积的各标准品储备液,稀释得到不同浓度的混合标准品溶液。
2.2.2 供试品溶液的制备
称取花椒粉末(过40目筛)约0.025 g,精密称定,置于25 mL容量瓶中,加入甲醇至刻度,超声30 min,冷却至室温后再定容,经0.22 μm的微孔滤膜过滤,即得。
2.3 指纹图谱方法学考察
2.3.1 精密度考察
称取花椒粉末(S1)约0.025 g,精密称定,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件连续进样6次,以羟基-α-山椒素为参照峰,计算各共有峰的相对保留时间和相对峰面积,各共有峰的相对保留时间的RSD<1.5%,相对峰面积的RSD<2.5%,表明仪器精密度良好。
2.3.2 重复性考察
称取同一供试品溶液(S1)花椒粉末(S1)6份,每份约0.025 g,精密称定,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进行测定分析,以羟基-α-山椒素为参照峰,计算各共有峰的相对保留时间和相对峰面积,结果所有共有峰的相对保留时间的RSD<1.5%,相对峰面积的RSD均<3.0%,表明此方法重复性良好。
2.3.3 稳定性考察
称取花椒粉末(S1)约0.025 g,精密称定,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件分别于0,0.5,1.0,2.0,4.0,8.0 h测定峰面积,以羟基-α-山椒素为参照峰,计算各共有峰的相对保留时间和相对峰面积,结果所有共有峰的相对保留时间的RSD均<1.0%,相对峰面积的RSD均<3.0%,表明花椒供试品溶液在8 h内稳定。
2.4 含量测定
2.4.1 精密度试验
精密吸取羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素混合对照品溶液5 μL,连续进样6次,测定峰面积,每个标准对照品峰面积的RSD均<1.5%,表明本方法精密度良好。
2.4.2 重复性试验
分别称取供试品(S1)6份,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进行测定分析。供试品溶液中羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素的峰面积RSD均<2.0%,表明该方法重复性良好。
2.4.3 稳定性试验
称取同一供试品溶液(S1),分别于0,0.5,1.0,2.0,4.0,8.0 h进行检测,记录指纹图谱,供试品溶液中羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素的峰面积RSD均<2.5%,表明供试品溶液在8 h内稳定性良好。
2.4.4 线性关系考察
分别精密吸取混合对照品储备液0.5,1.25,2.5,4,5 mL于5 mL量瓶中,摇匀,即得系列混合对照品溶液。精密吸取系列对照品溶液5 μL,注入液相色谱仪,按2.1项下色谱条件依次进样,记录色谱峰面积。分别以峰面积为纵坐标(Y),对照品质量(对照品质量浓度×进样体积)为横坐标(X),绘制标准曲线。得到6种麻味素的工作曲线:羟基-α-山椒素为Y=16272000X+4234.5(R2=0.99993),线性范围为0.673~134.6 μg/mL;羟基-β-山椒素为Y=12007600X+13597.5(R2=0.9993),线性范围为0.733~146.6 μg/mL;羟基-γ-山椒素为Y=16972300X+5682.4(R2=0.99993),线性范围为0.713~142.6 μg/mL;羟基-ε-山椒素为Y=6946540X-568.1(R2=0.99988),线性范围为0.6853~137.06 μg/mL;羟基-γ-异山椒素为Y=17699900X+16504.3(R2=0.9996),线性范围为0.8~160 μg/mL;γ-山椒素为Y=3646520X+658.9(R2=0.99991),线性范围为0.67~134 μg/mL。结果表明,6种麻味成分在一定质量浓度范围内呈良好的线性关系。
2.4.5 加样回收试验
精密称取已测定含量的花椒样品(S1)共6份,每份约0.1 g,精密称定后,分别加入混合对照品溶液0.8,1,1.2 mL(其中羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-ε-山椒素、羟基-γ-异山椒素、γ-山椒素的质量浓度分别685.3,673.3,733.3,713.3,800,666.7 μg/mL),每种加入量平行测定2份。按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进行测定,计算各组分的加样回收率和RSD。羟基-ε-山椒素、羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素、羟基-γ-异山椒素、γ-山椒素的平均回收率分别为98.7%、110.7%、107.9%、111.62%、109.3%、99.82%。RSD均<3.0%,表明该方法准确度较好。
2.4.6 含量测定结果
对采集自贵州顶坛花椒地理标志产品保护范围区域内的15批次(S1~S15)自然晾干的顶坛花椒样品、17批次(S16~S32)冷冻干燥的顶坛花椒、新鲜顶坛花椒(S33)及购买自其他地方的花椒(S34~S37),粉碎过40目筛,精密称定0.025 g,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进行测定分析,采用外标法测定样品中6种麻味成分的含量,测定结果见表2。
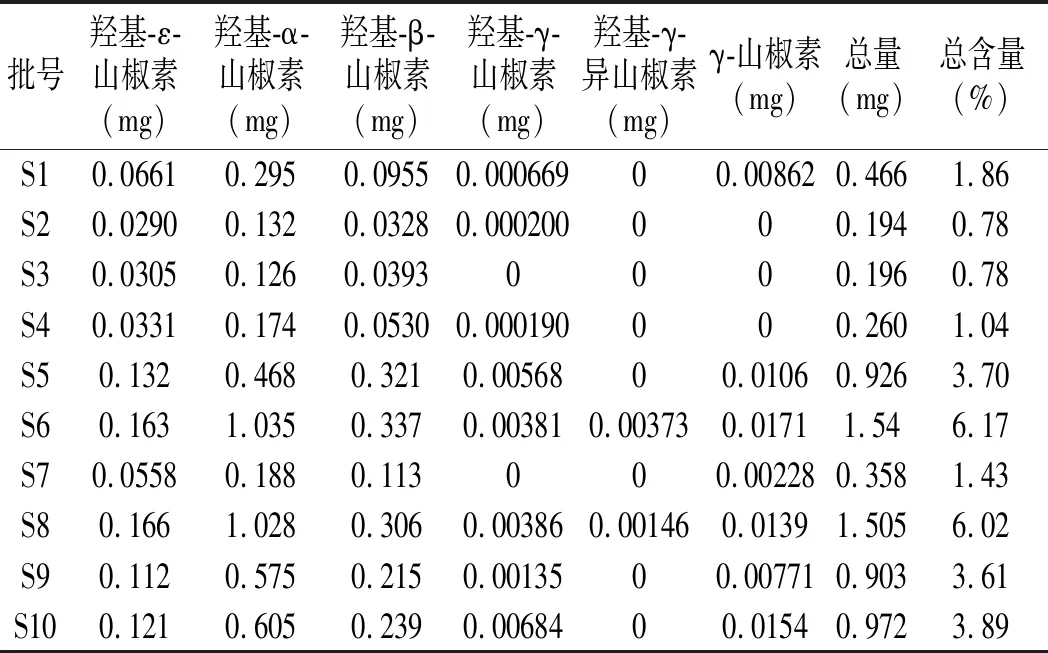
表2 不同批次花椒样品(0.025 g)中 6种麻味素含量测定结果Table 2 The detection results of content of 6 kinds of numb-taste components in different batches of Zanthoxylum bungeanum samples (0.025 g)
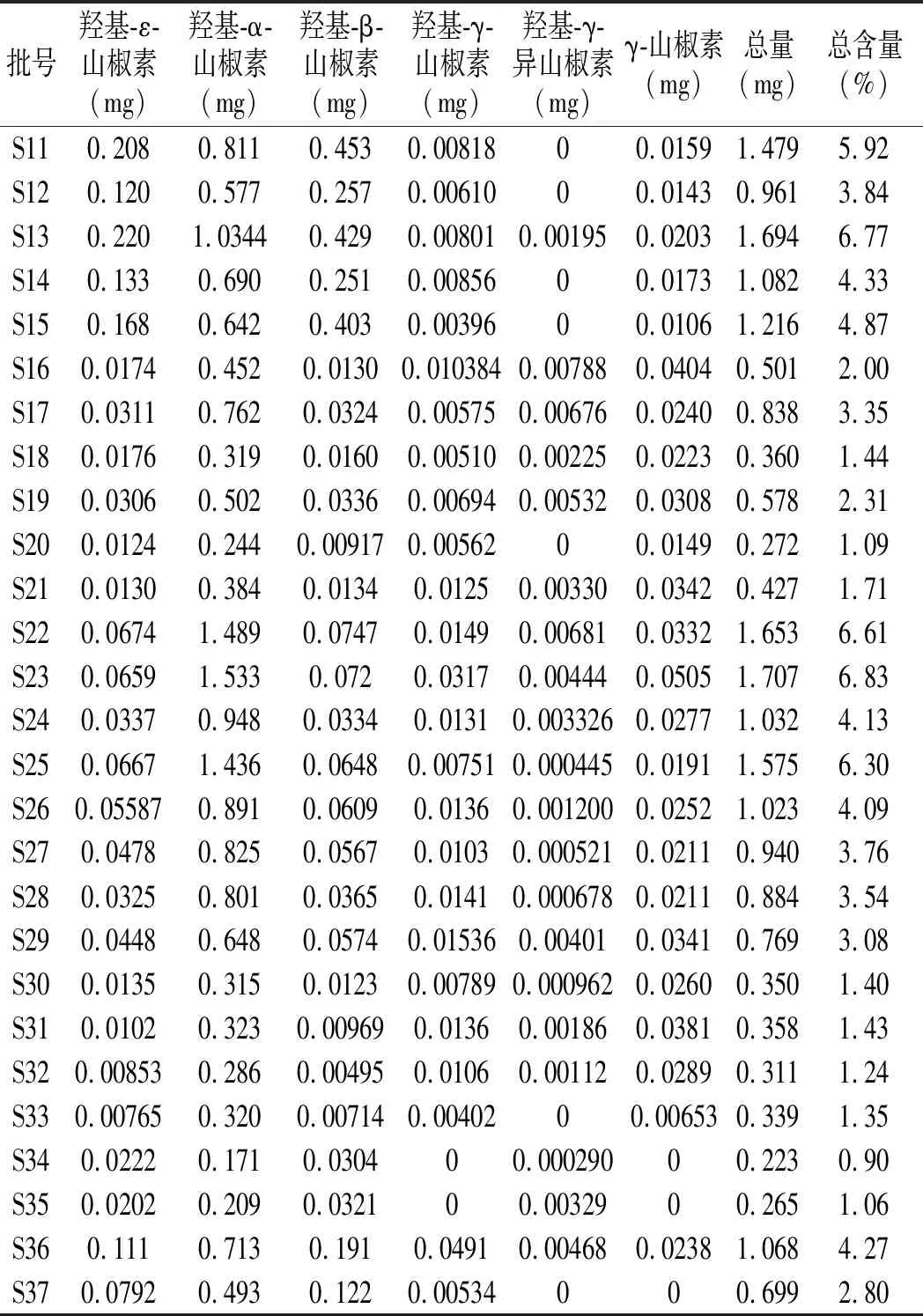
续 表
由表2可知,顶坛花椒麻味组分的总含量各批次之间有波动,组成麻味的各个组分出现较强的规律。其中麻味强度大的γ-山椒素含量普遍偏低,含量最高的单组分为羟基-α-山椒素,其次为羟基-β-山椒素。通过冷冻干燥的方法得到顶坛花椒(S16~S32),其中γ-山椒素和羟基-α-山椒素的含量显著高于晒干顶坛花椒(S1~S15),而羟基-β-山椒素的含量低于晒干产品。
2.5 聚类分析
2.5.1 基于HPLC图谱共有峰的聚类分析
称取花椒粉末(S1~S37)各约0.025 g,精密称定,按2.2.2项下方法制备供试品溶液,按2.1项下色谱条件进样,记录各样品色谱图,见图1。


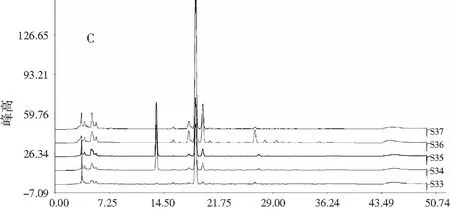
图1 不同批次(A)晒干、(B)冷冻干燥顶坛花椒 和(C)其他花椒样品的色谱图对比Fig.1 The comparison of chromatograms of different batches of (A)sun-dried,(B)freeze-dried Z. planispinum var. dingtanensis and (C)the other Zanthoxylum bungeanum samples
注:references为混合麻味素对照品;1为羟基-ε-山椒素;2为羟基-α-山椒素;3为羟基-β-山椒素;4为羟基-γ-山椒素;5为羟基-γ-异山椒素;6为γ-山椒素。
由图1可知,与花椒中常见的麻味混合对照品HPLC图对比,并结合HPLC图谱中主要色谱峰的UV光谱图和质谱图分子离子峰,花椒样品的HPLC色谱图中,保留时间在8 min以前的色谱峰均不是麻味素类成分,可能为花椒中的黄酮等酚类成分。出峰时间比γ-山椒素(tR=35 min)还长的位置已经未能明显检出麻味素组分。将不同批次的顶坛花椒样品HPLC色谱图导入“中药色谱指纹图谱相似度评价系统”(2004A版),并根据麻味组分的出峰时间进行溶剂峰(8 min)和尾峰(40 min)切除。以S1为参照图谱,采用中位数法,时间宽度设定为0.10 min,多点校正后自动匹配,计算色谱峰匹配结果,选取37个样品中匹配数大于30的色谱峰,以含量最高的羟基-α-山椒素(tR=18.7 min)做参照峰,计算其余色谱峰的相对峰面积。另外,考虑到S34、S35两个样品的色谱峰中出现了tR=13.5 min的典型色谱峰,与其他大部分样品的色谱图具有显著性差异,故将该色谱峰也作为指标进行聚类分析。以这些匹配峰的相对峰面积作为变量,采用组间联接法,以欧式距离的平方为测度,运用SPSS 20.0统计软件进行聚类分析,见图2。
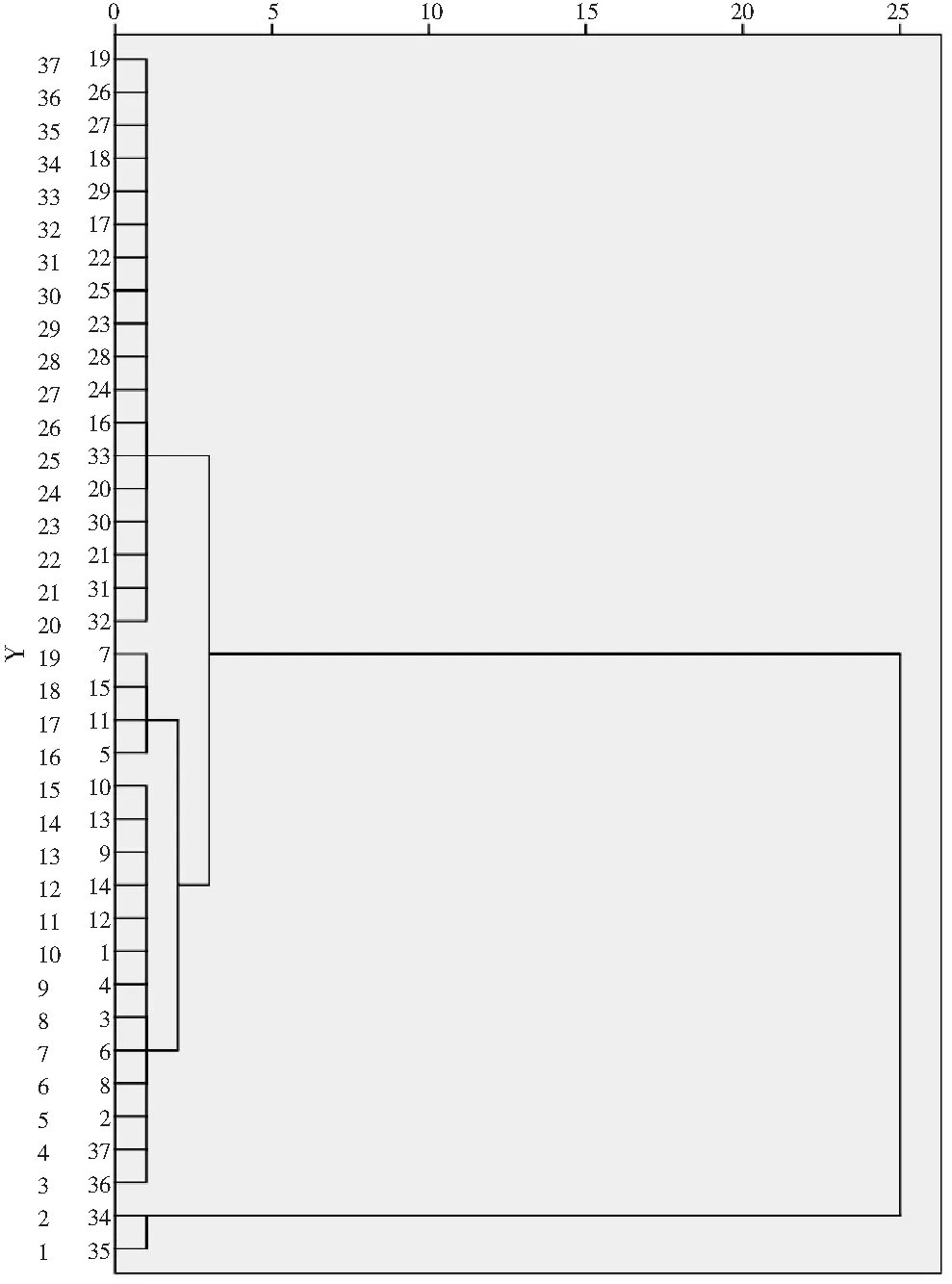
图2 37批花椒基于HPLC共有峰的聚类分析Fig.2 Cluster analysis of 37 batches of Zanthoxylum bungeanum based on the common peaks of HPLC spectra
由图2可知,当类间距离为25时,37批花椒可以分为两类:(S34、S35)为一类,其余为另一类;当类间距离为5时,则分为三大类:(S1~S15、S36、S37)、(S16~S33)和(S34、S35);当类间距离小于2时,(S1~S15、S36、S37)这个集合中的几个样本(5,7,11,15)又被单独聚为一小类,区别于集合中其他样本。
37个花椒样品中,S34、S35两者分别是购自四川和山东的红花椒,S1~S15为自然晒干的顶坛花椒,S16~S32为冷冻干燥的顶坛花椒,S33为新鲜的顶坛花椒,S36、S37为分别购自甘肃和陕西的红花椒。对比聚类分析后得到的各类典型HPLC色谱图发现,(S34、S35)组的色谱图与文献中红花椒的典型指纹图谱基本相同,与其他所有样品具有显著性的差异,而S36、S37同样作为红花椒,却在不同的分类层次中,晒干的顶坛花椒处于同一组。这个结果与S34、S35色谱图中的tR=13.5 min特征峰有关,同时,由于购自市场上的红花椒的植物来源无法明确鉴定,因而同为红花椒的S36、S37与文献中的竹叶花椒的指纹图谱较为相似,甘肃和陕西为竹叶花椒的主产区之一,购自陕西和甘肃的S36、S37可能的植物来源与此有关。33批顶坛花椒样品采集自相同的地理标志产品保护的区域,范围相对比较集中,来源明确,所以色谱图的差异较小。但从聚类结果看,干燥方法的差异将同样来源于顶坛花椒的样品分成了两大类,其中冷冻干燥的顶坛花椒(S16~S32)的羟基-α-山椒素组分,在其色谱图中表现为麻味成分的最主要组成,其他麻味素色谱峰占比很小。相较于晒干的顶坛花椒(S1~S15)比重更大,而后者中羟基-β-山椒素的比重显著上升。在晒干组中,又进一步地分为两个小组,有可能是由于晒干条件的差异导致了小的变化。
聚类分析结果提示,不同干燥方法对顶坛花椒的品质和风味特征具有显著的影响。冷冻干燥花椒麻味组分的色谱图与新鲜花椒(S33)的色谱图更为接近。
2.5.2 基于麻味组分含量的聚类分析
根据2.4.6中得到的6种麻味素含量测定结果,以含量最高的羟基-α-山椒素作为参照,分别计算37批花椒样品中的6种麻味素的相对含量。以6种麻味素的相对含量作为变量,采用组间联接法,以欧式距离的平方为测度,运用SPSS 20.0统计软件进行聚类分析,见图3。

图3 37批花椒基于麻味成分相对含量的聚类分析Fig.3 Cluster analysis of 37 batches of Zanthoxylum bungeanum based on the relative content of numb-taste components
由图3可知,与以上的聚类分析结果类似,当类间距离为25时,37批花椒同样被分成了两类,但与2.5.1中的结果不同,S34、S35由于在测定过程中未考虑特征色谱峰(tR=13.5 min)对麻味成分的贡献(为定量测定),使得两者被并入了晒干顶坛花椒(S1~S15、S36、S37)这一大组中,说明这两种花椒的不同麻味组分间的相对含量,在不包括特征峰的贡献时,与晒干顶坛花椒样品类似。改变类间距离后,晒干组顶坛花椒最后可以聚类为3个小组,与之前的聚类结果有一定的差距,可能是外标法含量测定结果计算的不同使组分间的相对含量与相对峰面积的数值有一定的差别。但冷冻干燥组和新鲜花椒(S16~S33)稳定地被聚为一大类,也提示温和的冷冻干燥方法对顶坛花椒产品的品质控制有利。
两种基于不同变量的聚类分析结果说明,顶坛花椒由于采集后干燥方法的差异,导致其中麻味成分的组成特征发生了较为显著的变化。
2.6 顶坛花椒HPLC指纹图谱的建立
2.6.1 顶坛花椒指纹图谱测定
根据聚类分析结果,顶坛花椒样品根据干燥方法的不同显著地分成了两组。这两组间的特征,可以反映顶坛花椒产品的麻味组分的差异。从顶坛花椒最终产品的质量控制角度考虑,分别对这两种类型的顶坛花椒产品建立指纹图谱。
根据2.5.1中得到的HPLC色谱图,将两个批次顶坛花椒样品分别导入“中药色谱指纹图谱相似度评价系统”(2004A版),并根据麻味组分的出峰时间进行溶剂峰起初和尾峰切除。以S1作为S1~S15、S16为S16~S32的参照图谱,采用中位数法,时间宽度设定为0.10 min,多点校正,自动匹配生成指纹图谱,见图4。
晒干顶坛花椒(S1~S15)的共有模式对照指纹图谱中,标定了7个麻味成分的共有峰(见图4中A和表2),通过对比对照品的保留时间和质谱图,分别鉴定出已知的麻味素羟基-ε-山椒素(峰2)、羟基-α-山椒素(峰4)、羟基-β-山椒素(峰5),共有峰3具有与羟基-ε-山椒素、羟基-α-山椒素和羟基-β-山椒素相同的分子量,则可以认为是这3个麻味素的另一个同分异构体。麻味强度最强的γ-山椒素在15批次晒干顶坛花椒样品中含量低而且不稳定(见表1)[15]。冷冻干燥顶坛花椒(S16~S32)的共有模式对照指纹图谱中,标定了6个麻味共有峰(见图4中B和表2),鉴定出了羟基-ε-山椒素(峰1)、羟基-α-山椒素(峰2)、羟基-β-山椒素(峰3)、羟基-γ-山椒素(峰4)和γ-山椒素(峰6)5个已知麻味素。其中麻味最强的γ-山椒素作为共有峰出现,含量显著大于晒干顶坛花椒(见表1)。羟基-α-山椒素在两类顶坛花椒中都是含量最高的麻味素,但冷冻干燥的顶坛花椒中相对含量更大,而麻味强度较小的羟基-β-山椒素在晒干品中则变大。
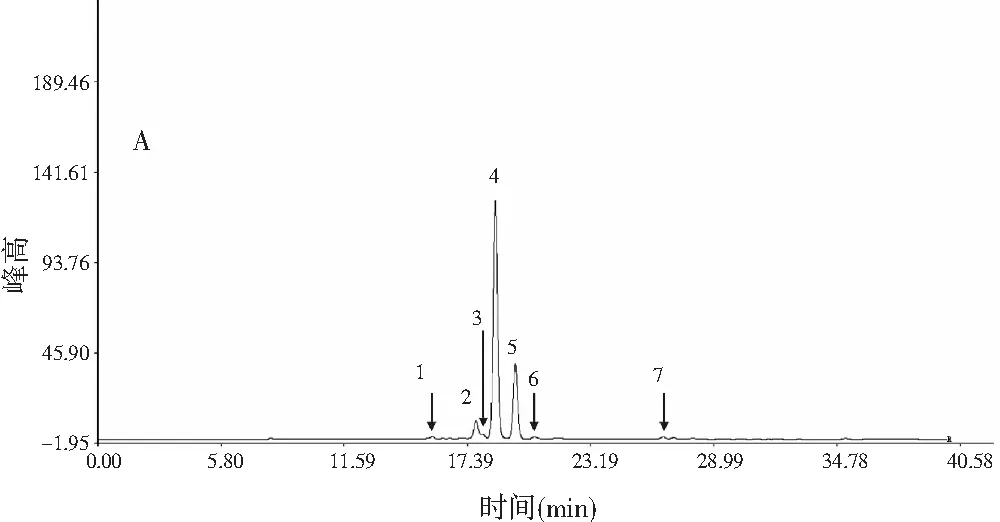
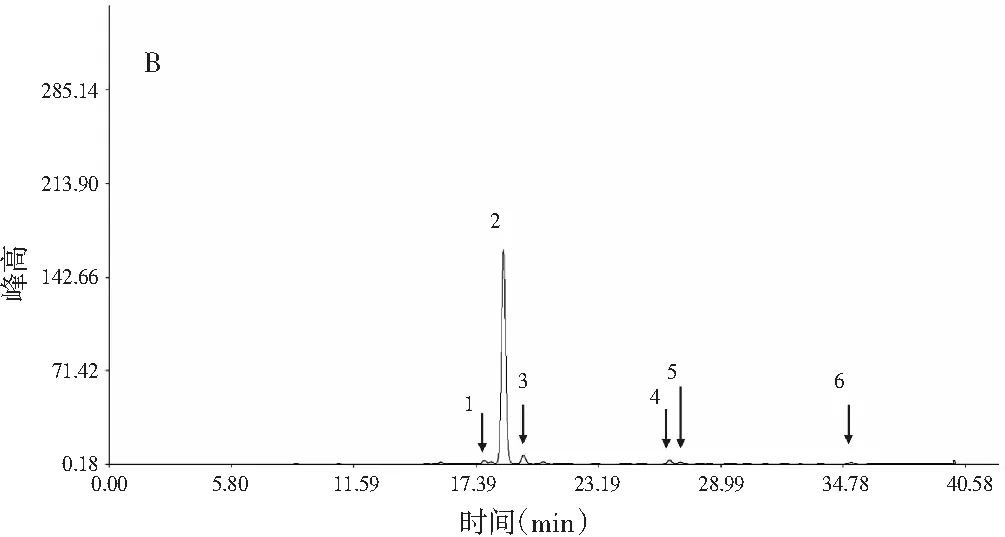
图4 晒干(A)和冷冻干燥(B)顶坛花椒的HPLC共有峰模式Fig.4 HPLC common peak pattern of (A) sun-dried and (B) freeze-dried Z.planispinum var. dingtanensis
结果显示:两种干燥方法处理的顶坛花椒指纹图谱,可以较为方便地表现出两类顶坛花椒产品的不同麻味素相对组成特征。
2.6.2 相似度测定

表3 15批晒干顶坛花椒及17批冻干顶坛花椒的 共有峰的相对保留时间和相对峰面积Table 3 The relative retention time and relative peak areas of the common peaks of 15 batches of sun-dried Z. planispinum var. dingtanensis and 17 batches of freeze-dried Z. planispinum var. dingtanensis
由表3可知,晒干顶坛花椒供试品之间的相似度及其与对照指纹图谱之间的相似度均大于0.98,而冷冻干燥花椒供试品之间的相似度及其与对照指纹图谱之间的相似度均大于0.99(见表4和表5),说明根据相同干燥方法得到的顶坛花椒产品可以保持较高的稳定性。
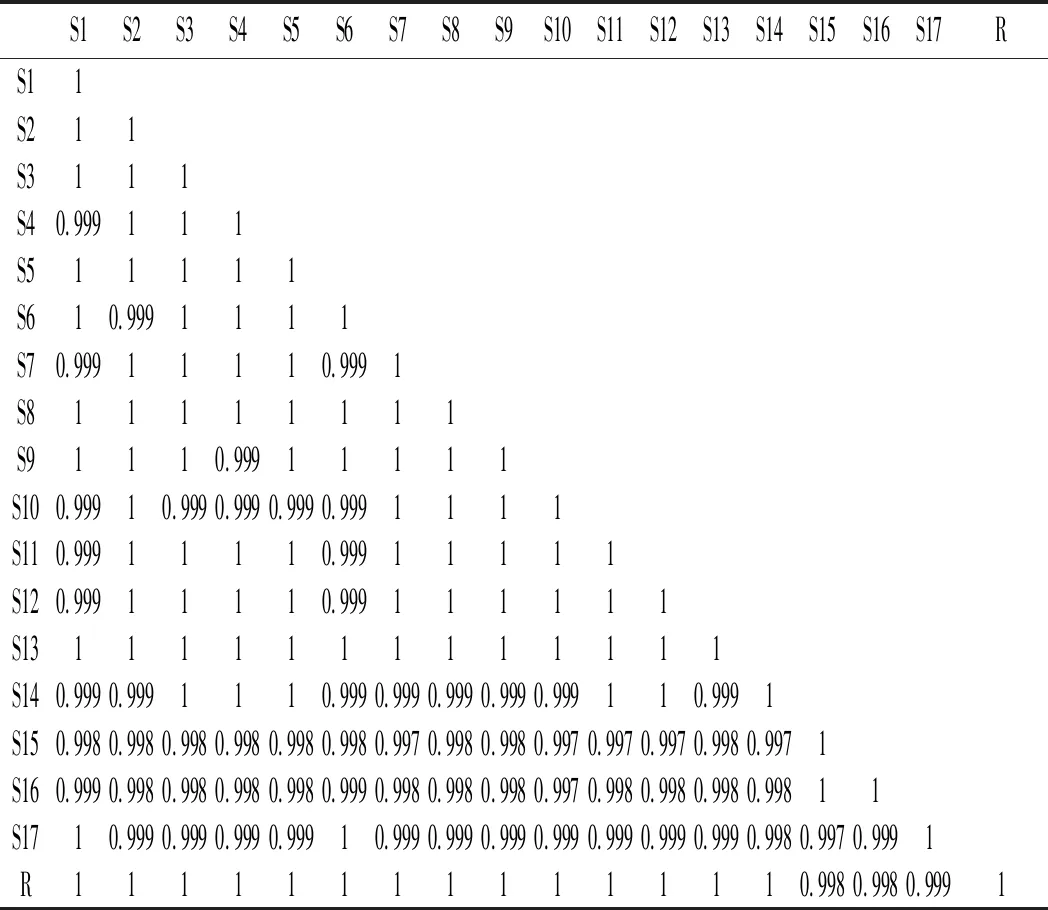
表5 17批次冻干顶坛花椒相似度计算结果Table 5 Simlilarity calculation results of 17 batches of freeze-dried Z.planispinum var. dingtanensis
3 讨论
本研究首先确立了花椒中主要麻味素组分HPLC分离方法,色谱条件下,花椒中主要麻味成分的色谱峰分离度、基线和峰形都较好,色谱峰信息丰富,并通过紫外吸收和质谱结果进行了溶剂峰和尾峰切除,集中对比更能反映花椒风味特征的麻味组分。
基于共有峰(配对大部分的样品)相对峰面积和6种麻味素相对含量作为变量的聚类分析,可以明确指出,顶坛花椒具有与其他来源花椒不同的麻味素组成特征,但与近缘种之间可能具有一定的相似性。更为重要的是,对花椒采集后以不同方法进行干燥,得到的花椒产品的麻味素组分表现出不一样的特点,并可以据此区分出不同的产品类别。因而,本文在此基础上完成了对不同处理方法得到的顶坛花椒指纹图谱的研究。
37个批次花椒样品的6个麻味素质量分数波动较大。与其他来源的花椒对比,顶坛花椒样品的总麻味素含量总体呈现较高的水平。因为其他来源花椒的样品数量太少,难以进行更全面对比,但也从侧面说明顶坛花椒确实具备了麻味重的特色。
对两种顶坛花椒产品指纹图谱共有峰的结构确认结果指出,构成两种产品的麻味组成成分大部分相同,但不同成分的相对含量有差别。由对照指纹谱图可以看出,冷冻干燥的顶坛花椒与新鲜花椒的麻味组成基本一致,其中羟基-α-山椒素的含量明显高于自然晒干花椒中的含量。33个批次的顶坛花椒麻味素含量测定结果也显示,羟基-α-山椒素是大多数花椒的主要麻味成分,含量最高。冷冻干燥顶坛花椒不同批次样品中,羟基-α-山椒素的相对含量测定也高于晒干顶坛花椒,但羟基-β-山椒素的相对含量明显低于晒干品。顶坛花椒晒干或烘干过程中的光照(或加热)导致的不饱和脂肪酸酰胺中顺势构型双键转变为热力学更稳定的全反式结构,使得晒干顶坛花椒中羟基-α-山椒素比重下降,羟基-β-山椒素增加。花椒中极性较小的γ-山椒素的麻味强度最大,山椒素氧化后得到的极性较大的羟基-山椒素,麻味强度减弱,并且不同羟基-山椒素的麻味强度差异也较大,如羟基-α-山椒素的麻味强度阈值比羟基-β-山椒素低1倍以上。温和的冷冻干燥处理方法,使得冻干顶坛花椒产品中麻味强度最大的γ-山椒素得以保留,并成为其指纹图谱中的重要指标,这可能也是新鲜花椒或冻干花椒比晒干品麻味大的原理。
本研究提示了花椒生产中采用不同的干燥方法,可以影响其麻味素的组成特征。因而在花椒产品开发和生产中,需要关注麻味成分结构转化和含量变化,如作为调味品的花椒产品,保持麻味更强的羟基-α-山椒素和γ-山椒素的含量,这将有利于保持顶坛花椒产品“麻味重、香味浓”的品质特征,则需要对新鲜花椒采摘后的干燥方法和过程进行合理控制。冷冻干燥方法可以得到与新鲜花椒产品类似的风味特征,但成本较高,晒干或烘干会导致高强度麻味组分含量的降低,但生产成本更低。同时,HPLC指纹图谱不仅可以有效地区分不同干燥方法得到的顶坛花椒产品,作为产品质量控制的重要手段,同时基于顶坛花椒与其他植物来源花椒HPLC指纹图谱共有峰特征的差异,还可以作为顶坛花椒地理标志产品的判别。
