子痫前期孕妇实验室指标水平及其对妊娠结局的影响
2020-05-27侯书宁程文国李莹莹朱新林
侯书宁 程文国 刘 艳 李莹莹 朱新林
子痫前期(preeclampsia,PE)是妊娠期特有疾病,发病率约2%~8%,临床主要表现为血压升高并伴有蛋白尿,常累及多个重要器官致其损伤及功能衰竭,严重时会危及孕妇和胎儿安全[1-2]。子痫前期的发病机制尚未明确,主要与胎盘着床浅、免疫反应、血管内皮受损、遗传因素、胰岛素抵抗等有关[3-5]。已有研究[6]表明,血脂代谢异常可导致脂质介导的氧化应激和血管内皮损伤,从而引起子痫前期的临床症状。维生素D作为广泛生物学活性的脂溶性维生素,与妊娠子痫前期的关系也受到人们的关注。本研究选择468例确诊的子痫前期孕妇为研究对象,通过对其维生素D水平、血脂、肾功能、凝血功能指标进行对照分析,拟探讨其在子痫前期诊断中的价值。
1 资料与方法
1.1 一般资料 选取2014年1月至2018年12月扬州市妇幼保健院产科定期产检和分娩确诊为子痫前期的孕妇468例为研究对象(观察组),子痫前期诊断标准参照人民卫生出版社《妇产科学》(第9版)[7]。纳入标准:①均为单胎;②孕妇年龄23~35岁;③采血时间10~12孕周;④孕期无特殊服药史、无心脏病或肝及肾疾病史、无其他妊娠合并症;本研究经院伦理委员会批准。排除标准:①孕前合并慢性心脏病、高血压者;②孕前合并肾病、糖尿病者;③孕前存在甲状腺功能亢进、自身免疫性疾病及血液病等慢性病史。468例子痫前期患者又分为慢性高血压合并子痫前期组88例、重度子痫前期组380例,其中包括重度子痫前期合并HELLP综合征16例;另选取同时间正常分娩孕妇375例为对照组,3组一般资料比较差异无统计学意义(P>0.05)。见表1。
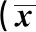
表1 3组孕妇一般资料比较s)
1.2 方法
1.2.1 实验室指标检测 研究对象在孕10~12周用分离胶采血管和含抗凝剂采血管抽取外周静脉血3~5 mL,离心后待检。①25-羟维生素D (25-dihydroxyvitaminD,25(OH)D)测定:采用ELISA法进行检测,试剂购自于广州菲康生物有限公司;②尿酸(uric acid,UA)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、钙离子(calcium,Ca2+)、镁离子(magnesium,Mg2+)测定:通过迈瑞生化仪BS2000进行检测,肾功能为速率法,血脂为酶法,电解质为参比法;③纤维蛋白原(fibrinogen,FIB)、D-二聚体(D-dimer,D-D)检测:通过希森美康CS5100进行检测,D-D检测为免疫比浊法,FIB检测为凝固法。均按照说明书进行操作。
1.2.2 观察指标 比较三组的25(OH)D、肾功能、血脂、电解质和凝血功能水平。比较慢性高血压合并子痫前期组和重度子痫前期组不良妊娠结局(包括早产、低体质量儿、胎儿生长受限、新生儿窒息、胎儿窘迫和足月小样儿)的发生率。

2 结果
2.1 3组25(OH)D、凝血功能和电解质比较 重度子痫前期组25(OH)D、Ca2+水平低于慢性高血压合并子痫前期组和对照组,D-D、Mg2+浓度高于慢性高血压合并子痫前期组和对照组,差异均有统计学意义(P<0.05);三组间FIB水平差异无统计学意义(P>0.05)。见表2。
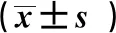
表2 3组25(OH)D、凝血功能和电解质比较
注:与正常妊娠对照组比较,aP<0.05;与慢性高血压合并子痫前期比较,bP<0.05
2.2 3组肾功能、血脂比较 重度子痫前期组与慢性高血压合并子痫前期组的UA、BUN、Cr、TG、TC、HDL水平均高于对照组,差异均有统计学意义(P<0.05);重度子痫前期组的UA、BUN、Cr、TG均高于慢性高血压合并子痫前期组,TC、HDL均低于慢性高血压合并子痫前期组,差异均有统计学意义(P<0.05)。见表3。
2.3 两组子痫前期产妇不良妊娠结局比较 两组子痫前期产妇早产、胎儿生长受限和胎儿窘迫发生率差异有统计学意义(P<0.05),两组低体质量儿、新生儿窒息和足月小样儿发生率差异无统计学意义(P>0.05)。见表4。
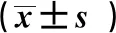
表3 3组肾功能、血脂比较
注:与正常对照组比较,aP<0.05;与慢性高血压合并子痫前期比较,bP<0.05
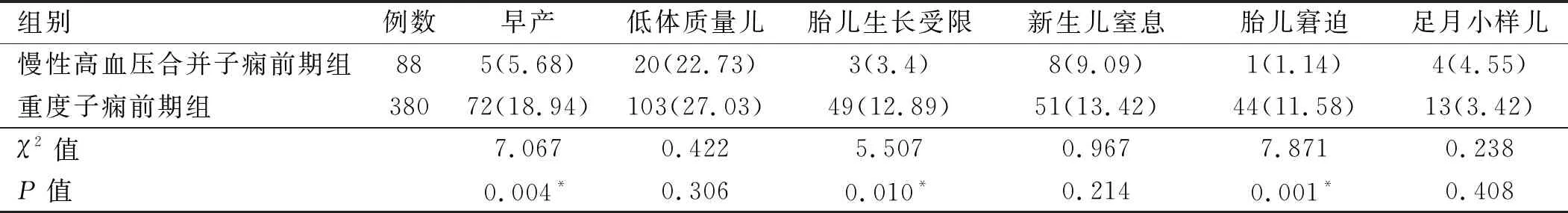
表4 两组子痫前期产妇不良妊娠结局比较[例(%)]
注:*为Fisher确切概率法
2.4 实验室指标对子痫前期发生的预测价值 以是否发生子痫前期为因变量(是=1,否=0),单因素分析中差异有统计学意义的指标为自变量,纳入自变量的方法为逐步筛选法。结果显示,血清TG、Mg2+和BUN是子痫前期发生的危险因素,而25(OH)D是保护因素。见表5。
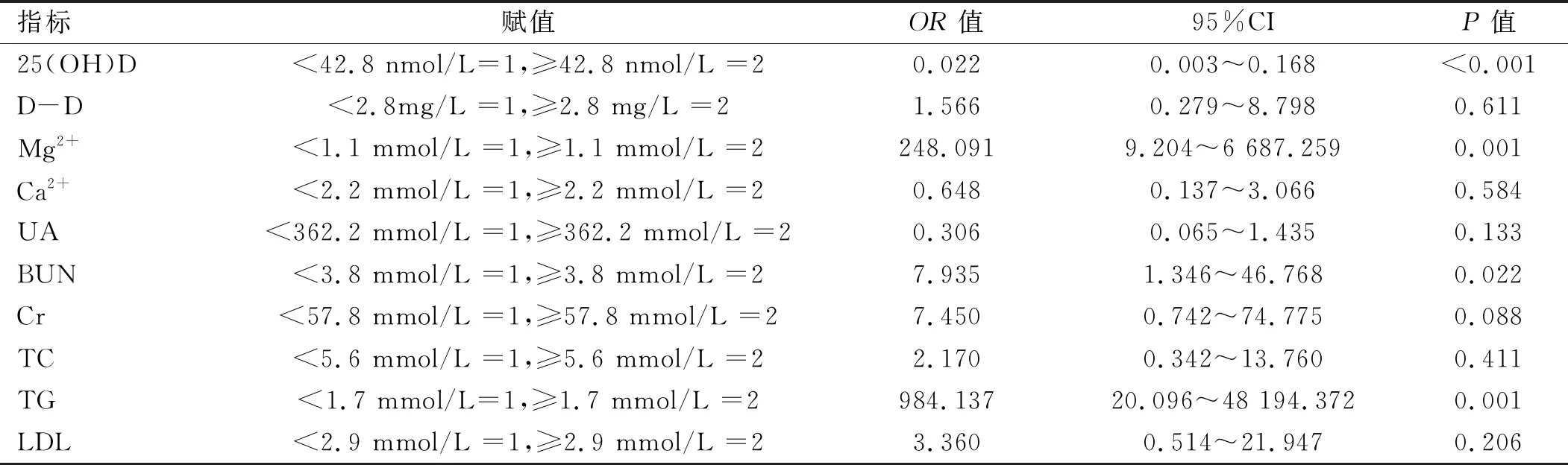
表5 logistic回归分析实验室指标在子痫前期发生中的预测价值
2.5 实验室指标诊断子痫前期的AUC 以灵敏度为纵坐标,1-特异度为横坐标绘制ROC曲线,实验室指标诊断子痫前期的AUC见图1、表6。
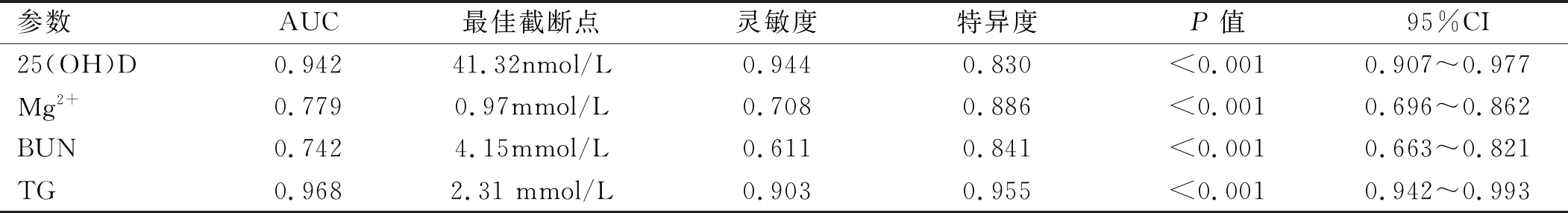
表6 血清25(OH)D、Mg2+、BUN和TG的ROC曲线分析
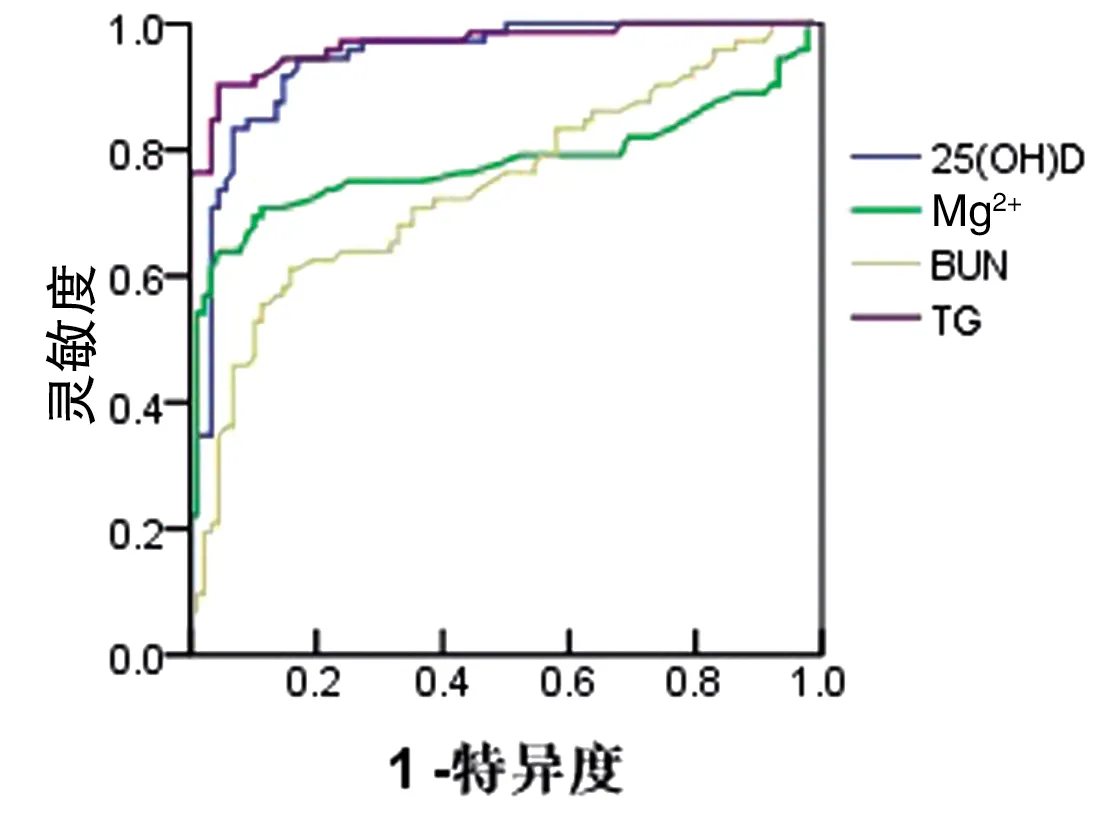
图125(OH)D、Mg2+、BUN和TG诊断子痫前期的ROC曲线
3 讨论
重度子痫前期是孕妇及胎儿死亡的主要原因之一,具有发病率高、发病时间早、病情重、并发症多等特点[8]。发生重度子痫前期的孕妇存在全身小动脉痉挛并引起外周阻力增大,导致血压升高甚至导致胎盘缺血缺氧损伤,且易累及多器官及系统功能障碍。
本研究发现,重度子痫前期组的25(OH)D水平显著低于慢性高血压合并子痫前期组和正常对照组,logistic回归分析表明血清中高浓度的25(OH)D是子痫前期发生的保护因素,说明体内维生素D的缺乏与重度子痫前期的发生密切相关。近年来的研究[9]表明,25(OH)D除了能调节钙磷代谢外,还具有影响激素分泌、调节免疫应答和控制细胞增殖、分化等作用。钮玉洁等[10]研究发现,血清25(OH)D的降低能预示发生子痫前期的风险,这与本研究结果相一致。
子痫前期的发生可能与缺钙有关,已有研究表明,孕期补钙可使妊娠高血压发生率下降。本研究发现,跟正常妊娠对照组比较,重度子痫前期组Ca2+降低、Mg2+显著增高。表明可能由于重度子痫前期孕妇25(OH)D缺乏,肠道对Ca2+吸收率下降,血清钙浓度失衡,从而促进机体对Mg2+的重吸收,导致血清镁增高。
重度子痫前期的孕妇因妊娠高血压导致血管内皮细胞破坏后暴露出胶原组织,可促进血小板聚集和血栓形成,导致血小板减少和凝血功能的紊乱[11]。本研究发现,与慢性高血压合并子痫前期组和正常对照组相比较,重度子痫前期组的D-D明显增高,而D-D的增高提示血栓形成,可能导致绒毛坏死和胎盘缺血,预示子痫前期的严重程度[12]。FIB是形成血栓的重要因素,本研究中未发现FIB在三组间有显著变化,为探求原因需要进一步测定纤维蛋白原降解产物来确定子痫前期组的血栓状态。
妊娠期高血压除了引起凝血功能紊乱外,还会引起肾功能损伤,出现蛋白尿[13]。本研究发现,跟正常妊娠对照组和慢性高血压合并子痫前期组比较,重度子痫前期组UA 、BUN 、Cr逐渐增高,差异有统计学意义,表明随着病情进展,肾功能损伤越严重,Lisonkova 等[14]认为,肾功能更好反映PE的严重程度。
由于妊娠期的特殊生理需求,在妊娠的中期和晚期血脂水平升高明显。已有研究[15]表明,血脂代谢水平异常、氧化应激与子痫前期发病关系密切。本研究发现,重度子痫前期血TC、TG和LDL明显高于正常妊娠对照组,logistic回归分析显示血清中高浓度的TG是子痫前期发生的危险因素,表明TG在子痫前期发病起重要作用,这与Siddiqui等[16]研究相符。另外本研究发现,在选取的血清标志物中,TG诊断子痫前期的AUC大于25(OH)D、Mg2+和BUN,即TG代谢异常与子痫前期发生相关性更高,诊断PE价值更高。
妊娠子痫前期时,由于胎盘供血不足、胎盘功能减退,可发生胎儿窘迫、胎儿宫内发育迟缓等妊娠不良结局。本研究表明,相对于慢性高血压合并子痫前期组,重度子痫前期组患者的早产、宫内生长受限和胎儿窘迫发生率显著升高。
综上所述,随着子痫前期病情的发展,25(OH)D逐渐降低,而TG、BUN和Mg2+逐渐升高,因此分析血清25(OH)D、TG、BUN和Mg2可能对早期发现、早期干预子痫前期和减少不良妊娠的发生率有积极作用。但本研究尚未对正常妊娠组的孕中期、孕晚期实验室指标进行分析比较,这些实验室指标预测子痫前期发展仍需要进一步的深入探讨。
