微血管侵犯对多发性肝癌肝切除术远期预后的影响
2020-05-23谢之豪白石磊杨平华张小峰张宝华
谢之豪,白石磊,杨平华,张小峰,夏 勇,李 俊,张宝华,沈 锋
0 引 言
原发性肝癌是我国常见的恶性肿瘤。随着影像学技术的进步及肝炎高危人群的广泛普查,多数肝癌患者能被早期诊断治疗,但仍有近40%患者就诊时为多发肿瘤[1]。肝切除术(liver resection,LR)是多发性肝癌最有效的治疗手段,但由于术后高复发率,长期疗效仍不理想[2-3]。大量研究表明,微血管侵犯(microvascular invasion,MVI)是影响肝细胞肝癌(hepatocellular carcinoma,HCC)预后的重要因素[4];但既往针对MVI在多发性肝癌治疗中意义的研究较少。
肝内转移(intrahepatic metastasis,IM)是多发性肝癌的一种发生机制,主要通过血路播散所致[5-6]。因此,肝内转移所致的多发性肝癌可能与MVI呈一定相关性。分析伴有MVI的多发性肝癌肝切除术后预后有助于加深对肝切除术在多发性肝癌中应用价值的认识。本研究通过回顾性分析505例经肝切除的多发性肝癌病例,探讨MVI存在对术后预后的影响,并观察伴MVI的多发性肝癌术后行TACE辅助治疗的疗效。
1 资料与方法
1.1 研究对象 回顾性分析我院2009年3月至2015年3月接受LR治疗的肝癌患者临床资料。纳入标准:①术后病理为肝细胞肝癌, 且肿瘤数目≥2;②接受根治性肿瘤切除(R0切除);③无肝内主血管侵犯或远处转移。排除标准:①合并其他肿瘤病史;②术前行抗肿瘤治疗;③患者术后1个月内死于严重手术并发症;④临床数据不完整或术后随访信息不全。最终共505例多发性肝癌患者纳入研究,根据病理结果分为MVI组和非MVI组。分析患者临床及病理资料,包括性别、年龄、肝炎史、血常规、肝肾功能、肿瘤标志物、肿瘤最大径、肿瘤数量、肿瘤直径之比(肿瘤最大径与最小径的比值)、肿瘤直径之和、肿瘤包膜、肝硬化、MVI等。本研究取得医院伦理委员会批准(EHBHKY201501012)。所有纳入研究的患者均签署知情同意书。
1.2 肝切除术 术前影像学评估所有肿瘤均可根治性切除。R0切除定义为肉眼可见肿瘤结节完整切除,无大血管侵犯及肝外远处转移,显微镜检查切缘无肿瘤细胞残余[7];且肝功能储备良好,有足够残余肝体积的患者行LR治疗。术中超声探查术前未发现的肿瘤病灶。肝癌多发病灶位于 Couinaud 段/区/半肝以内,行解剖型肝切除;多发肿瘤位于两个半肝或残余肝不足时,则分别予以肿瘤切除,并尽量保证切缘>1 cm。术中常规行门静脉阻断,阻断时间不超过20 min,肝硬化严重者不超过15 min。肝细胞癌的临床分期使用BCLC分期系统[2]。肿瘤细胞分化使用Edmondson-Steiner 分级系统[8]。MVI定义为显微镜下于门静脉、肝静脉或其他由血管内皮细胞包绕的微血管中发现肝癌细胞团块[9]。
1.3 术后辅助性治疗 LR术后1~2个月,根据患者肝功能恢复情况,择机行经导管肝动脉化疗栓塞术(transarterial chemoembolization, TACE)治疗。通过Seldinger技术经股动脉穿刺置管,行肝动脉造影后酌情行肝固有动脉或超选择性化疗栓塞(盐酸阿霉素、吡柔比星或表柔比星和碘油,剂量由体表面积及肝功能决定)。TACE术后1个月复查增强CT观察手术效果。
1.4 随访 所有患者术后均行标准化随访,内容包括肝功能、血清甲胎蛋白(Alpha-fetoprotein,AFP)水平及HBV免疫学指标、腹部超声等。术后2年内每3个月随访1次,此后每6个月随访1次。每3个月行增强CT或MRI检查,此后视随访结果而定。研究随访终点时间为2018年9月1日。早期复发肿瘤若为单发,体积较小且肝功能良好者,首选再次LR或射频消融治疗;否则考虑TACE、索拉非尼靶向治疗以及支持治疗等。本研究的终点指标为早期复发时间和总体生存时间(overall survival,OS)。早期复发时间指从手术当天至LR术后2年内诊断肿瘤复发的时间间隔;OS指从手术当天至患者死亡或最后一次随访的时间间隔。
1.5 统计学分析 采用R 3.1.3统计软件进行临床数据分析。分类变量以n(%)形式表示,组间比较采用χ2检验或Fisher 精确检验。使用Kaplan-Meier方法绘制生存曲线,并用Log-rank检验进行组间比较。使用Cox风险比例模型分析影响预后的独立危险因素。以P≤0.05为差异有统计学意义。
2 结 果
2.1 一般临床病理资料 本研究共纳入505例接受LR治疗的多发性肝癌患者,其中MVI患者279例,MVI发生率55.2%。MVI组患者男245例,年龄44.0~60.0岁,中位年龄52.0岁,合并肝硬化194例。非MVI组患者男201例,年龄45.0~60.8岁,中位年龄53.0岁,合并肝硬化159例。2组患者性别、年龄、肝硬化构成比差异均无统计学意义(P>0.05)。MVI组患者较非MVI组的AFP>400 g/L、肿瘤数目>3、肿瘤最大径>5 cm、肿瘤直径之比>6、肿瘤直径之和>8 cm、Edmonson-Steiner I-II级,以及更低比例的肿瘤位于同侧、包膜完整、和BCLC A期比较差异均有统计学意义(P<0.05)。见表1。
2.2 MVI对多发性肝癌肝切除术后的预后影响 本组患者随访时间38.9(37.7~42.3)个月。505例多发性肝癌患者的早期复发率为51.4%。其中MVI组早期复发率显著高于非MVI组,差异有统计学意义(60.4%vs40.5%,P<0.01)。505例多发性肝癌患者的1、3、5年生存率分别为77.7%、56.3%、41.2%;MVI组患者1、3、5年生存率显著低于非MVI组(70.5%、47.4%、33.4%vs86.6%、66.8%、50.1%,P<0.05)。见图1。
单多因素分析显示,患者术前AFP水平、肿瘤直径之比、MVI和辅助性TACE治疗是影响患者LR术后早期复发的危险因素;肿瘤最大径、术中输血、MVI和辅助性TACE治疗则是影响患者LR术后总体生存的危险因素。见表2、表3。
表 1 MVI组和非MVI组间的一般临床病理特征比较[n(%)]
Table 1 Baseline clinicopathological features between patients with or without MVI presencen(%)
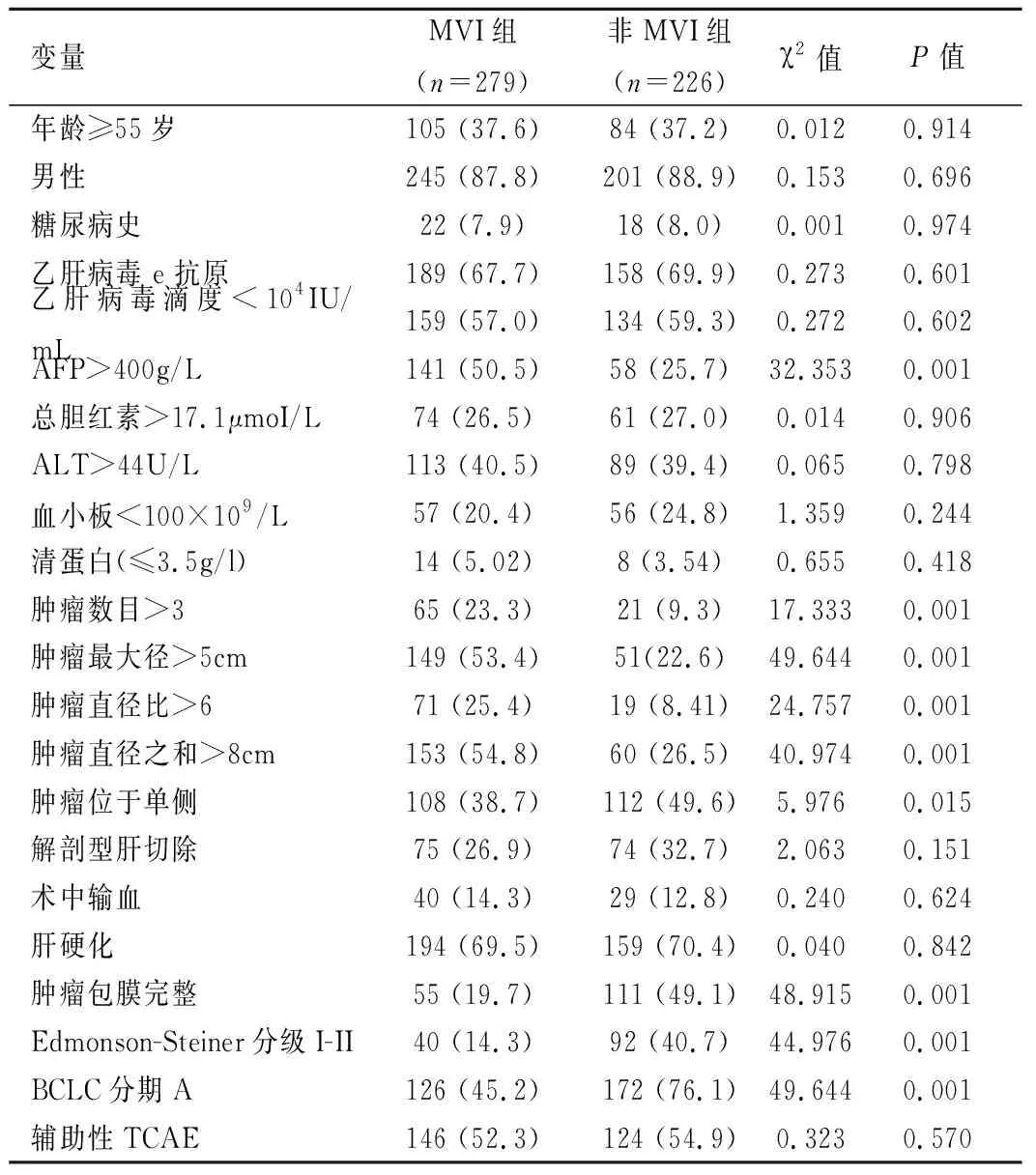
变量MVI组(n=279)非MVI组(n=226)χ2值P值年龄≥55岁105 (37.6) 84 (37.2)0.0120.914男性245 (87.8)201 (88.9)0.1530.696糖尿病史22 (7.9)18 (8.0)0.0010.974乙肝病毒 e 抗原189 (67.7)158 (69.9)0.2730.601乙肝病毒滴度<104IU/mL159 (57.0)134 (59.3)0.2720.602AFP>400g/L141 (50.5)58 (25.7)32.3530.001总胆红素>17.1μmoI/L74 (26.5)61 (27.0)0.0140.906ALT>44U/L113 (40.5)89 (39.4)0.0650.798血小板<100×109/L57 (20.4)56 (24.8)1.3590.244清蛋白(≤3.5g/l)14 (5.02)8 (3.54)0.6550.418肿瘤数目>365 (23.3)21 (9.3)17.3330.001肿瘤最大径>5cm149 (53.4)51(22.6)49.6440.001肿瘤直径比>671 (25.4)19 (8.41)24.7570.001肿瘤直径之和>8cm153 (54.8)60 (26.5)40.9740.001肿瘤位于单侧108 (38.7)112 (49.6)5.9760.015解剖型肝切除 75 (26.9)74 (32.7)2.0630.151术中输血40 (14.3)29 (12.8)0.2400.624肝硬化194 (69.5)159 (70.4)0.0400.842肿瘤包膜完整55 (19.7)111 (49.1)48.9150.001Edmonson-Steiner分级I-II40 (14.3)92 (40.7)44.9760.001BCLC分期A126 (45.2)172 (76.1)49.6440.001辅助性TCAE146 (52.3)124 (54.9)0.3230.570

图 1 伴MVI和非MVI多发性肝癌患者LR术后早期复发和总体生存曲线
Figure 1 Tumor early recurrence and OS for mHCC patients with or without MVI presence
表 2 影响多发性肝癌患者早期复发和生存的单因素分析(n=505)
Table 2 Univariate analysis of tumor early recurrence and OS in patients with multiple hepatocellular carcinoma (n=505)

变量早期复发HR(95%CI)P值总体生存HR(95%CI)P值性别0.80(0.52~1.23)0.3100.95(0.64~1.42)0.817年龄0.85(0.65~1.10)0.2231.12(0.86~1.45)0.409糖尿病史0.59(0.34~1.03)0.0630.84(0.51~1.38)0.492HBeAg(+)1.17(0.90~1.53)0.2401.04(0.79~1.36)0.800乙肝病毒滴度1.30(1.01~1.67)0.0401.33(1.03~1.71)0.029TBIL1.07(0.80~1.41)0.6561.23(0.92~1.63)0.157ALT1.37(1.07~1.77)0.0131.38(1.07~1.78)0.013清蛋白0.83(0.47~1.49)0.5390.62(0.35~1.11)0.108血小板1.28(0.93~1.77)0.1260.89(0.66~1.20)0.439AFP1.92(1.49~2.47)0.0011.60(1.24~2.06)0.001肿瘤数目1.29(0.94~1.78)0.1131.21(0.87~1.68)0.258肿瘤最大径2.12(1.65~2.73)0.0012.25(1.74~2.9)0.001肿瘤直径比2.17(1.63~2.90)0.0011.96(1.46~2.63)0.001肿瘤直径和2.05(1.59~2.63)0.0011.86(1.44~2.40)0.001肿瘤部位0.89(0.69~1.15)0.3690.81(0.62~1.04)0.103解剖型肝切除0.97(0.73~1.28)0.8100.87(0.65~1.15)0.324术中输血1.73(1.24~2.40)0.0012.13(1.54~2.94)0.001肿瘤包膜0.81(0.62~1.06)0.1230.75(0.57~1.00)0.047肝硬化1.04(0.79~1.37)0.7591.17(0.88~1.55)0.279病理分级0.63(0.46~0.86)0.0030.61(0.44~0.83)0.002MVI1.84(1.41~2.39)0.0011.86(1.42~2.42)0.001辅助性TACE0.76(0.59~0.98)0.0350.69(0.53~0.89)0.004
表 3 影响多发性肝癌患者早期复发和生存的多因素分析(n=505)
Table 3 Multivariate analysis of tumor early recurrence and OS in patients with multiple hepatocellular carcinoma (n=505)

变量早期复发HR(95%CI)P值总体生存HR(95%CI)P值AFP(g/L)1.48(1.13~1.93)0.004--最大径---0.020直径比1.51(1.09~2.12)0.015--术中输血--1.75(1.24~2.45)0.001MVI1.34(1.00~1.78)0.0481.36(1.01~1.83)0.044辅助性TACE0.76(0.59~0.97)0.0300.68(0.53~0.89)0.005
2.3 伴MVI的多发性肝癌患者LR术后早期复发与总体生存 279例MVI患者中146例(52.3%)术后行辅助性TACE治疗。MVI患者中,行TACE患者早期复发率低于未行TACE治疗患者(56.3%vs64.9%,P<0.05);行TACE治疗患者1、3、5年生存率高于未行TACE治疗患者(77.8%、51.8%、35.8%vs62.5%、42.6%、31.1%,P<0.05);非MVI患者中,行TACE治疗患者较其他患者早期复发及总体生存差异均无统计学意义(早期复发:41.3%vs39.3%,P<0.05;1、3、5年生存率:92.8%、72.5%、53.1%vs78.6%、59.5%、47.3%,P<0.05),见图2。
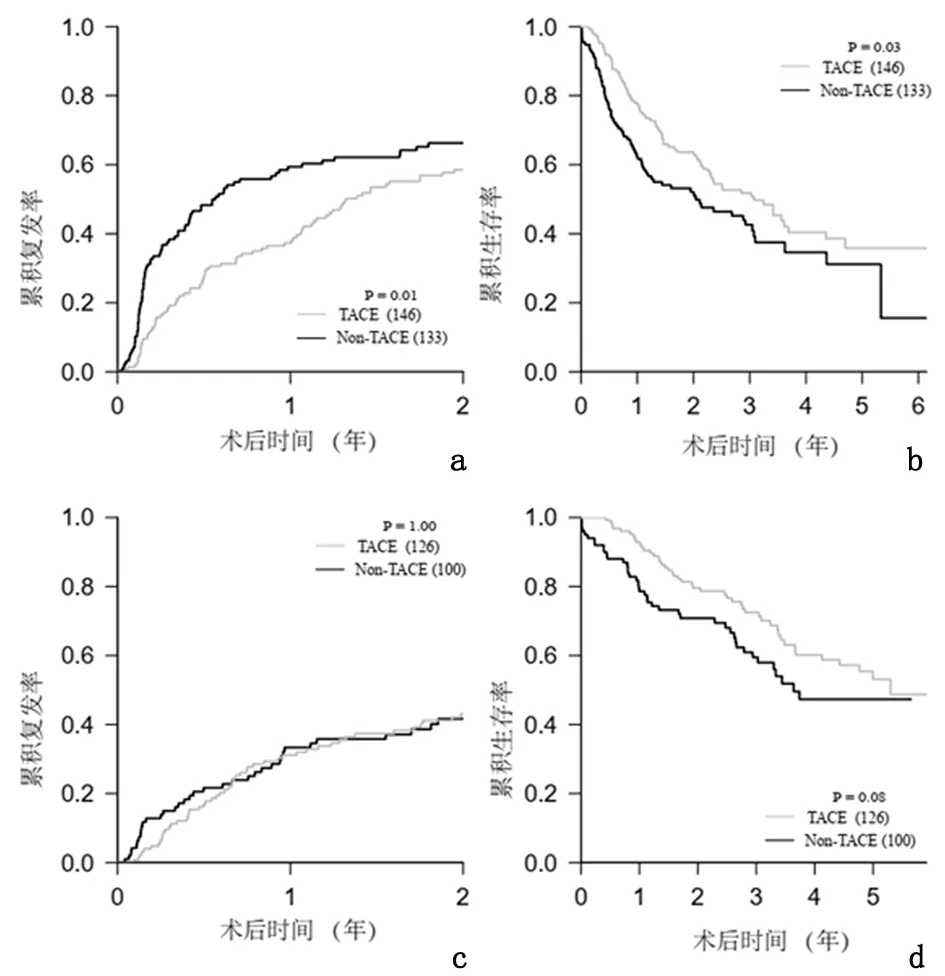
a、b:分别为TACE对伴MVI的多发性肝癌患者LR术后早期复发和总体生存的影响;c、d:分别为TACE对非MVI多发性肝癌患者LR术后早期复发和总体生存的影响
图 2 各组多发性肝癌患者累积复发率及生存率比较
Figure 2 Tumor early recurrence and OS in each group for mHCC patients with or without MVI presence
单多因素分析显示,患者术前AFP水平、肿瘤直径之比、MVI和辅助性TACE治疗是影响患者LR术后早期复发的危险因素;肿瘤最大径、术中输血、MVI和辅助性TACE治疗则是影响患者LR术后总体生存的危险因素,见表4、表5。
表 4 影响伴MVI的多发性肝癌患者早期复发与生存的多因素分析(n=279)
Table 4 Multivariate analysis of tumor early recurrence and OS in mHCC patients with MVI (n=279)
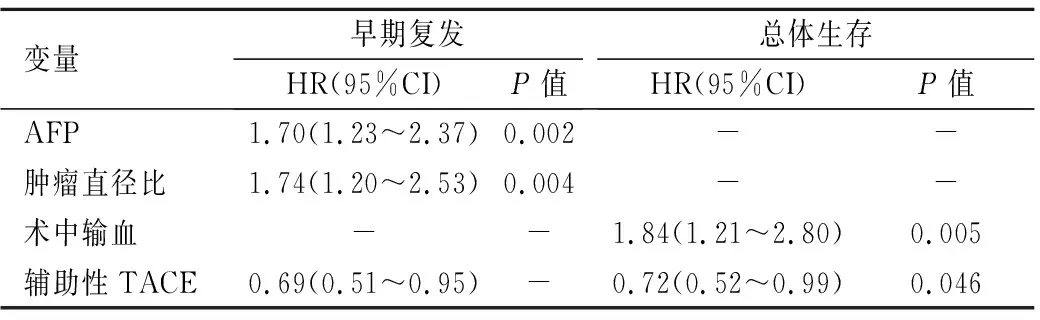
变量早期复发HR(95%CI)P值总体生存HR(95%CI)P值AFP1.70(1.23~2.37)0.002--肿瘤直径比1.74(1.20~2.53)0.004--术中输血--1.84(1.21~2.80)0.005辅助性TACE0.69(0.51~0.95)-0.72(0.52~0.99)0.046
表 5 影响伴MVI的多发性肝癌患者早期复发与生存的单因素分析(n=279)
Table 5 Univariate analysis of tumor early recurrence and OS in mHCC patients with MVI (n=279)
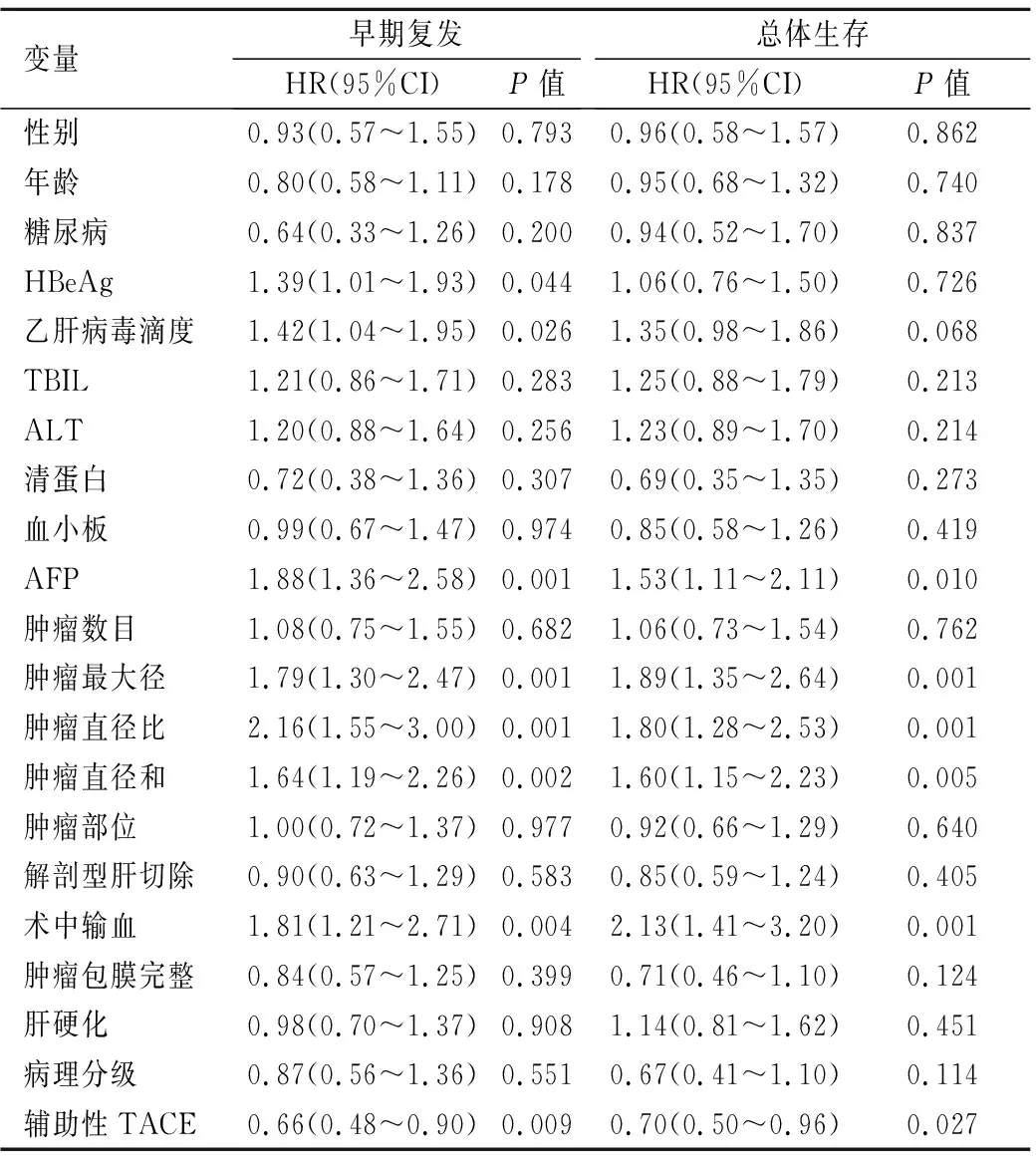
变量早期复发HR(95%CI)P值总体生存HR(95%CI)P值性别0.93(0.57~1.55)0.7930.96(0.58~1.57)0.862年龄0.80(0.58~1.11)0.1780.95(0.68~1.32)0.740糖尿病0.64(0.33~1.26)0.2000.94(0.52~1.70)0.837HBeAg1.39(1.01~1.93)0.0441.06(0.76~1.50)0.726乙肝病毒滴度1.42(1.04~1.95)0.0261.35(0.98~1.86)0.068TBIL1.21(0.86~1.71)0.2831.25(0.88~1.79)0.213ALT1.20(0.88~1.64)0.2561.23(0.89~1.70)0.214清蛋白0.72(0.38~1.36)0.3070.69(0.35~1.35)0.273血小板0.99(0.67~1.47)0.9740.85(0.58~1.26)0.419AFP1.88(1.36~2.58)0.0011.53(1.11~2.11)0.010肿瘤数目1.08(0.75~1.55)0.6821.06(0.73~1.54)0.762肿瘤最大径1.79(1.30~2.47)0.0011.89(1.35~2.64)0.001肿瘤直径比2.16(1.55~3.00)0.0011.80(1.28~2.53)0.001肿瘤直径和1.64(1.19~2.26)0.0021.60(1.15~2.23)0.005肿瘤部位1.00(0.72~1.37)0.9770.92(0.66~1.29)0.640解剖型肝切除0.90(0.63~1.29)0.5830.85(0.59~1.24)0.405术中输血1.81(1.21~2.71)0.0042.13(1.41~3.20)0.001肿瘤包膜完整 0.84(0.57~1.25)0.3990.71(0.46~1.10)0.124肝硬化0.98(0.70~1.37)0.9081.14(0.81~1.62)0.451病理分级0.87(0.56~1.36)0.5510.67(0.41~1.10)0.114辅助性TACE0.66(0.48~0.90)0.0090.70(0.50~0.96)0.027
3 讨 论
本研究对505例接受根治性切除的多发性肝癌患者进行回顾性分析,其中MVI发生率为55.2%,明显高于单发性肝癌[10]。MVI患者的早期复发率为60.4%,1、3、5年生存率分别为70.5%、47.4%、33.4%;非MVI患者的早期复发率为40.5%,1、3、5年生存率分别为 86.6%、66.8%、50.1%;结果表明MVI患者早期复发率更高,总体生存率较低。多因素分析显示MVI是早期复发(HR=1.34,P=0.048)和总体生存(HR=1.37,P=0.043)的独立危险因素。
大量研究证实,MVI是HCC患者LR术后早期复发的重要预测指标,也是术后远期预后的独立预测指标,目前已广泛应用于指导HCC的外科综合治疗[4,11]。对于多发性肝癌,研究表明多中心起源(MO)预后要明显好于肝内转移(IM)[12-14],MO行LR预后可接近单发肿瘤[15]。临床中鉴别是IM还是MO对于远期预后十分重要,能依据其指定个体化治疗方法(如选择术后辅助治疗和制定随访规划)。MVI可能是导致IM的重要因素之一,本研究中MVI患者早期复发率更高,总体生存率较低,这也与IM预后较差相一致[13]。然而目前针对多发性肝癌患者MVI的相关研究仍较少。
术后辅助性TACE在单发肿瘤中的抗复发价值已得到普遍认可,但对于其在多发性肝癌中的作用及指征仍缺乏共识[16]。Wang等[17]研究表明,对于多发肿瘤术后具有高危复发因素的患者,辅助性TACE能够减少复发,延长总体生存。另有学者研究证实对于超Milan标准并伴MVI的肝癌患者,术后辅助性TACE有较好的疗效;但对于Milan标准内的伴MVI患者,术后TACE并不能带来生存受益[18]。本研究结果显示,MVI患者中行辅助性TACE组早期复发率明显低于未行TACE组(56.3%vs64.9%,P<0.05),TACE组1、3、5年生存率高于未行TACE组(77.8%、51.8%、35.8%vs62.5%、42.6%、31.1%,P<0.05);多因素分析显示辅助性TACE是早期复发(HR=0.69,P=0.023)和总体生存(HR=0.72,P=0.046)的独立影响因素;而非MVI患者中TACE组与未行TACE组早期复发及总体生存并无明显差异。对于伴MVI的多发性肝癌患者,LR术后积极联合辅助性TACE治疗,有利于降低肿瘤早期复发,提高患者的总体生存率;对于非MVI患者,辅助性TACE的价值及指征,则需进一步研究探讨。笔者团队前期建立了一个能够准确评价多发性肝癌肝切除术后预后的NDR评分系统,该NDR评分由肿瘤数目、肿瘤直径之和及直径之比构成,可能与多发性肝癌的克隆起源相关[19]。利用该评分系统对非MVI患者筛选辅助性TACE的指征值得进一步研究探讨。
目前 MVI 的诊断主要依靠术后病理学检查,一定程度上限制了其临床应用。 Lei 等[10]建立了适用于米兰标准内HCC的预测 MVI 列线图模型,可用以临床指导个体化治疗策略。然而针对多发性肝癌,尚缺乏高效、准确的术前MVI预测模型。本研究表明多发性肝癌中MVI与AFP水平,肿瘤最大径、最大最小径比值、直径之和等临床病理因素密切相关,依据这些临床特征预测MVI从而指导多发性肝癌的外科治疗选择,仍有待进一步深入研究。
综上所述,本研究分析了MVI与多发性肝癌LR术后预后的关系,证实MVI是多发性肝癌LR术后早期复发、远期预后不良的重要危险因素之一。对于伴MVI的多发性肝癌患者,LR术后行辅助性TACE治疗可降低肿瘤早期复发率,提高远期生存率。
