细胞钙转运系统研究进展*
2020-05-23刘怡静鲍丽琴孙鲁宁张学会龚晓健王永庆
刘怡静,柏 蓉,鲍丽琴,孙鲁宁,张学会,龚晓健,王永庆**
1 中国药科大学 药理学教研室,南京 210009;2 南京医科大学第一附属医院 临床药理研究室,南京 210029;3 江苏盛泽医院 药学部,苏州 215228
钙离子作为细胞的第二信使,调控多种生理活动,如肌肉收缩、神经递质和激素释放、神经元兴奋性变化、基因转录、细胞周期、细胞增殖和受精等。钙稳态失衡将导致细胞损伤甚至死亡,包括细胞凋亡、自噬性细胞死亡、失巢凋亡、细胞坏死[1]。
在正常生理条件下,细胞内游离钙浓度([Ca2+]i)严格维持在低水平状态,约100nmol·L-1;胞外Ca2+浓度为1~2mmol·L-1,肌浆网/内质网Ca2+浓度为0.1~1 mmol·L-1。细胞受到刺激后,胞内Ca2+的升高以及多余Ca2+的清除均依赖于钙转运系统的精密调控。细胞钙转运系统主要分布于质膜、内质网和线粒体等,包括钙泵、钙通道和Na+/Ca2+交换体等不同形式(见图1)。质膜的电压门控钙通道(voltage-gated calcium channel,VGCC)、配体门控钙通道(ligand-gated calcium channel,LACC)、钙释放激活的钙通道(calcium release activated calcium channel,CRAC channel)以及瞬时受体电位通道(transient receptor potential channel,TRP channel)的部分亚型可介导胞外Ca2+流入胞内,使胞内Ca2+升高;另外,内质网的三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptors,IP3Rs)和兰尼碱受体(ryanodine receptors,RyRs)可释放内质网Ca2+入胞浆,导致胞内Ca2+升高。而胞内Ca2+的升高又可激活钙释放通道:质膜钙泵(plasma membran Ca2+ATPase,PMCA)和肌浆网/内质网钙泵(sarcoplasmic/endoplasmic reticulum Ca2+ATPase,SERCA)负责将过多的Ca2+排出胞外或摄入内质网,钠钙交换体(Na+/Ca2+Exchanger,NCX)的正向转运模式将Ca2+排出细胞,线粒体钙离子单向转运体(mitochondrial Ca2+uniporter,MCU)将Ca2+摄入线粒体,从而恢复胞浆低钙水平。随着科技水平的进步,越来越多的技术被用于细胞钙转运系统和钙调控机制的研究,常见的有:放射性同位素示踪法、膜片钳技术和激光扫描共聚焦显微镜法[2]。目前亟待解决的问题是阐明钙信号和其他细胞信号之间复杂而协调的联系[3]。
钙离子在时间和空间的合理分布对维持细胞生理活动至关重要,钙信号调控的任一环节出现细微改变都会造成严重的后果,而这通常与疾病的发病机制有关。如心肌细胞钙信号紊乱将导致心律失常、心肌肥大、心肌缺血和心衰等心脏疾病,而神经元钙信号紊乱会造成衰老相关的神经疾病。因此将钙转运系统作为药物治疗靶点以及寻找新的特异性抑制剂一直都是研究的热点。
1 质膜钙转运系统
1.1 质膜钙泵
PMCA最早发现于红细胞,是P型泵(P-type ATPase)家族的一员。PMCA的活性受到钙调蛋白CaM的调节。低钙水平时,PMCA处于自抑制状态,ATP结合位点被阻断;胞内Ca2+升高时,Ca2+与CaM结合,Ca2+-CaM复合物与PMCA自抑制域相互作用,最终暴露ATP结合位点,激活PMCA,将Ca2+转运出细胞[4-6]。
全基因组关联研究表明,PMCA1与高血压和心血管疾病相关。PMCA2在小脑浦肯野神经元和耳蜗毛细胞大量分布,其功能缺失会造成小脑共济失调和听力衰退。PMCA3在小脑和脉络丛高表达,PMCA3基因突变与小脑共济失调及醛固酮增多的腺瘤有关[4,5]。PMCA4与疟疾耐药性和家族性痉挛性截瘫有联系,有望成为抗疟药物新靶点[7]。尸检以及动物实验表明,随着年龄的增加和神经退行性疾病(如AD、PD)的发生,PMCAs的活性和蛋白水平逐渐下降,Ca2+外排减少,胞内Ca2+增加,诱发钙相关毒性,最终导致神经功能紊乱[6]。阿尔兹海默症时,过度磷酸化的tau蛋白抑制PMCA造成胞内Ca2+增加,而升高的Ca2+又促进tau蛋白生成具有神经毒性的聚合物[14]。
1.2 钠钙交换体
钠钙交换体(Na+/Ca2+Exchanger,NCX)家族属于一个大的钙/阳离子转运体超家族(CaCA超家族)。NCX在哺乳动物中分3类:NCX、NCKX(Na+/Ca2+-K+交换体)和CCX(Ca2+/阳离子-交换体)[8]。NCX是钙外排的重要途径,其转运模式完全可逆,作用方向依赖于膜电势和离子浓度梯度。其正向转运模式为交换3个Na+进细胞和1个Ca2+出细胞。
与正向模式相比,NCX的反向模式对细胞不利。例如当心肌缺血/再灌注发生后,Na+/H+交换体为清除缺血时积累的H+而使胞内Na+升高,升高的Na+激活NCX的反向转运模式,导致大量的Ca2+进入细胞,最终发生SR钙超载[8]。然而,Yan ZY[9]等发现多巴酚丁胺的正性肌力作用的新机制与NCX有关。在心室肌细胞的去极化期,多巴酚丁胺促进电压门控Na+通道的激活,经Na+通道进入细胞的Na+激活NCX的反向模式,使胞外Ca2+内流,复极化时间被延长[9]。
1.3 钙通道
1.3.1 电压门控钙通道 电压门控钙通道(VGCC/Cavs)主要分布于兴奋性细胞,如大脑、心脏和肌肉细胞。根据它们对电压的敏感性可分为高压激活钙通道和低压激活钙通道,所有的T型(Cav3.1-Cav3.3)通道属于低压激活(LVA)钙通道,而L型(Cav1.1-Cav1.4)、P/Q型(Cav2.2)和R型(Cav2.3)通道属于高压激活(HVA)钙通道[10]。
在心肌细胞中,经Cav1.2内流的Ca2+可激活肌浆网RyR通道,引起钙库Ca2+释放,该过程被称作钙致钙释放CICR(Ca2+-induced Ca2+release)。与Cav2通道相比,Cav1.2通道开放时间短,钙内流的量也相对较少,为维持细胞的正常功能需依赖CICR。Cav2主要在神经元表达,动作电位是该通道的生理激活剂[11]。Cav2.2在神经元有专一性的表达,刺激神经递质的释放[10]。Cav3通道可以快速地从超极化的失活状态恢复到静息电位,又可以快速地在静息电位附近活化,具有起搏器的功能[11]。Cavs通道与心血管疾病和神经系统疾病密切相关,其抑制剂的研究有很多,一些特异性良好的抑制剂已经成为治疗药物广泛地用于临床(见表1)。
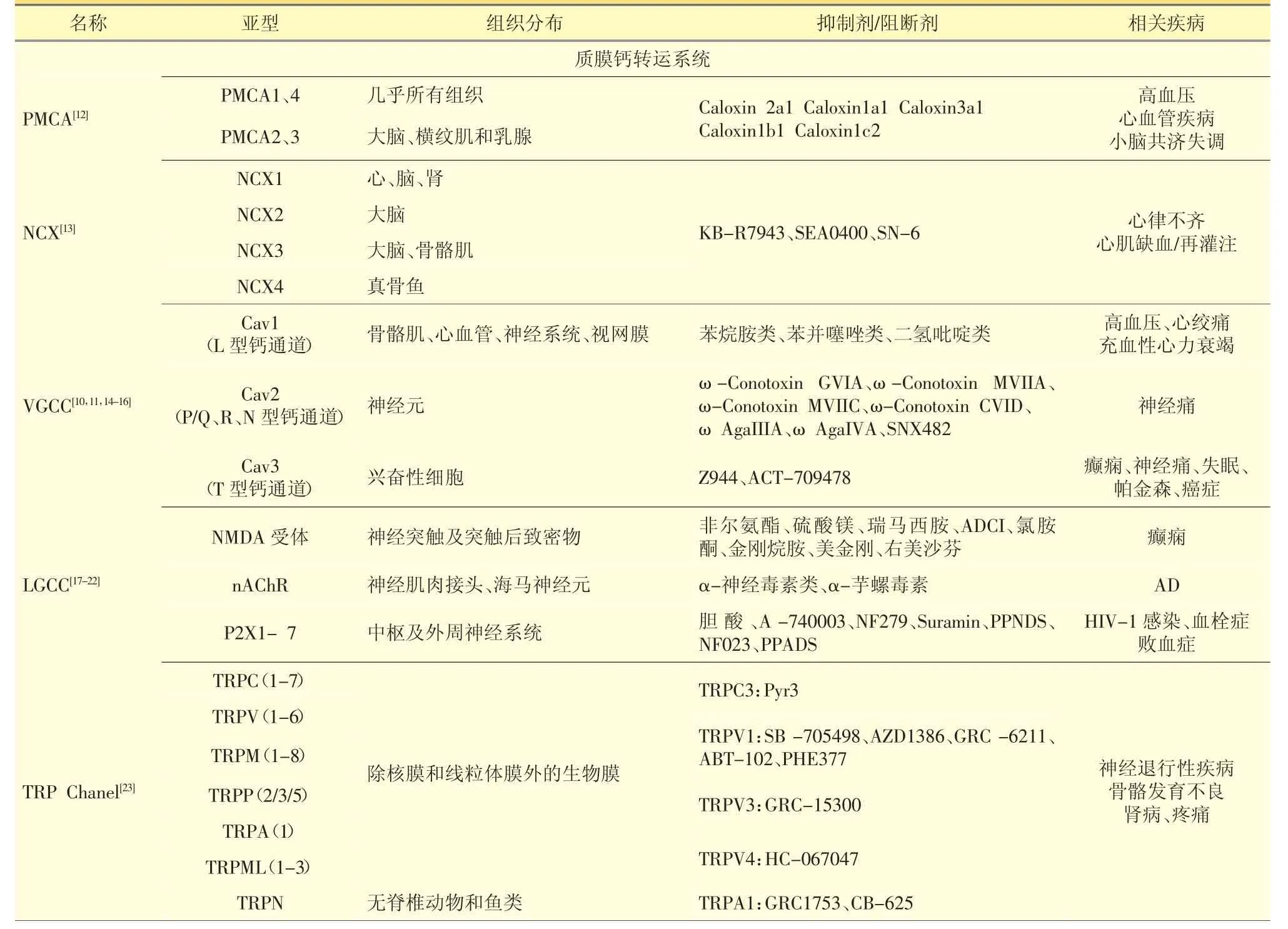
表1 钙转运系统分类

续表1 钙转运系统分类
1.3.2 配体门控钙通道 配体门控钙通道(LGCC)根据配体的种类可分为3类:①N-甲基-D-天冬氨酸受体(NMDA受体);②烟碱型乙酰胆碱受体(nAChR);③P2X受体。LGCC在神经系统的广泛分布表明它们对于突触的重要性[32]。
NMDA受体是四聚体复合物,存在多种亚型,亚型之间的药理学和功能特性存在差异。NMDA受体能够提高突触末端Ca2+浓度,促进神经递质释放,它与突触的建立有关,与学习和记忆有密切联系。NMDA受体的拮抗剂具有抗癫痫的效果[17]。高浓度的nAChR在神经肌肉接头处被发现,它参与电信号的快速化学传递。在人类和小鼠的海马神经元中,nAChR的表达随机体的发育、衰老而变化。其中α7和α4β2受体在个体出生后第一周表达增加,在老年时急剧下降。阿尔兹海默症患者的尸检发现,α7受体在海马星型胶质细胞中表达上调[18]。P2X受体是阳离子ATP-门控离子通道,含7个亚型(P2X1-7),广泛分布于外周和中枢神经系统,主要的生理性激动剂是胞外ATP[19]。不同类型的LGCC同时激活并不会出现叠加效应,而是产生交叉抑制。
1.3.3 瞬时受体电位通道 瞬时受体电位(TRP)通道是由TRP多基因超家族编码的整合膜蛋白,包括TRPC(1-7)、TRPV(1-6)、TRPM(1-8)、TRPP(2、3和5)、TRPA(1)、TRPML(1-3)和TRPN等7个家族成员,其中TRPN只存在于无脊椎动物和鱼类中[23]。TRP通道分布广泛,除了核膜和线粒体膜外,在所有的细胞膜上均有分布。它作为感受器对细胞环境的各种变化作出回应,如温度、压力、渗透压、pH和伤害性刺激等。TRP通道属于非选择性阳离子通道,可转导Ca2+、Na+、Mg2+等离子,不同TRP通道对Ca2+、Na+的通透性比值(PCa/PNa)不同。TRPV5和TRPV6亚型对Ca2+有高选择性,其PCa/PNa值大于100;一些亚型的PCa/PNa值小于10;而TPRM4和TRPM5亚型对Ca2+几乎不转导。TRP通道的活化机制包括膜电位、膜磷脂、磷酸化、配体等,其活化促进细胞膜去极化,进而激活电压依赖的离子通道,导致胞内Ca2+浓度的变化[33]。
2 内质网钙转运系统
内质网(endoplasmic reticulum,ER)钙稳态的维持:①ER钙结合蛋白(集钙蛋白、GRP78、钙网蛋白、钙联蛋白等)增加钙库的Ca2+容量;②ER钙摄取通道与钙释放通道之间的平衡[24,34]。
2.1 肌浆网/内质网钙泵
肌浆网/内质网钙泵(SERCA)是ER摄取Ca2+的主要途径,它通过消耗ATP将Ca2+逆浓度梯度泵入内质网。SERCA是一个分子量为110 kDa的跨膜蛋白,含2个Ca2+结合位点。3种基因(ATP2A1-3)编码了至少14种不同的SERCA亚型,它们的表达具有生物和组织特异性[24]。Ravier MA等[35]发现,在胰岛B细胞中,葡萄糖诱导的胰岛素分泌完全依赖于钙内流,胞内升高的Ca2+激活SERCA2b和SERCA3将过高的Ca2+摄入ER,另外,ER强烈的钙内流会减弱SERCA活性或激活ER钙释放机制。即SERCA维系了细胞钙信号调节和细胞钙稳态。研究表明,心衰与SERCA功能低下有关,增强SERCA活性和恢复SERCA正常表达是治疗这类心衰的有效措施。在一项早期临床试验中,以Ⅰ型腺相关病毒(Adeno-associated virus type 1,AAV1)为载体的AAV1-SERCA2a基因转染法,可以恢复晚期心衰患者的SERCA2a表达,减轻心衰患者的临床症状[36]。而SERCA的激活剂Istaroxime[37]和Pyridone derivative[38]可以治疗心衰,CDN1163[39]是治疗糖尿病和代谢异常的潜在药物。关于SERCA的抑制剂,毒胡萝卜素[40](thapsigargin,TG)相关的前药可用于抗癌,环匹阿尼酸[41](CPA)衍生物可用于抗疟。
2.2 IP3Rs和RyRs
1,4,5-三磷酸肌醇受体(IP3Rs)和兰尼碱受体(RyRs)是ER/SR的钙释放通道家族,各有3种亚型,在鱼类中可能还存在RyRs的第4种亚型。IP3Rs是细胞中最普遍的钙通道,3个亚型的同源性高达60%~80%。胞浆游离Ca2+浓度对IP3Rs具有双向调节作用,即低浓度钙促进IP3Rs活性,而高浓度抑制。当ER Ca2+浓度低于30%时,将快速降低IP3Rs对IP3的敏感性,这有利于防止钙库过度损耗[42]。2-APB是IP3R的非选择性抑制剂,肝素是竞争性拮抗剂。肝素对IP3Rs不同亚型的亲和力不同:IP3R3>IP3R1≥IP3R2。2-APB和高浓度的咖啡因选择性地抑制IP3R1而不影响IP3的结合[25]。
RyR1分布于骨骼肌,RyR2分布于心肌,RyR3在大脑、平滑肌和慢肌纤维骨骼肌都有表达。影响RyRs的因素有Ca2+、Mg2+、ATP、咖啡因、环腺苷二磷酸和磷酸化/去磷酸化,另外还有钙调蛋白、隐钙素、FK-506结合蛋白和DHPR环肽的调节[2]。如前所述,RyRs通道的激活与质膜上的VGCC相关,形成CICR事件。RyRs的功能异常与心衰、心律失常、肌病、糖尿病以及神经退行性疾病相关[27]。有观点认为,ER钙释放通道不需特定的刺激而处于开放状态,它意味着这些通道具备着低活性或低表达量或低开放概率的特点,否则将造成钙库耗竭,导致ER应激[43]。也有观点认为,只有当[Ca2+]ER达到某个水平时,ER钙释放通道才能开放,其活性由[Ca2+]ER控制。心肌细胞中因SERCA活性的增加而增加了钙火花出现的频率,这是[Ca2+]ER对RyR2调控的例子[35]。
2.3 TMCO1
TMCO1(transmembrane and coiled-coil domains 1)又称ER钙过载激活的钙离子通道,是ER跨膜蛋白。当ER出现钙超载时,TMCO1由单聚体组装成四聚体的通道,介导ER腔的Ca2+释放,使ER恢复钙稳态[44]。TMCO1缺陷会导致颅面畸形、骨骼异常、智力迟钝等多种疾病。Sun Z等[45]发现TMCO1对卵泡的发育十分重要。敲除Tmco1的雌性小鼠表现出卵泡逐渐丧失、卵泡发育受损和生育能力低下等症状,这与卵巢功能早衰症状类似。Li J等[46]研究发现,TMCO1介导的钙释放可促进Ca2+/CaMKⅡ信号通路,从而促进成骨细胞的骨形成过程。TMCO1可能成为治疗骨质疏松的新靶点。
2.4 其他
①TMBIMs:TMBIMs是pH依赖的钙释放通道[47],共有6种亚型,其中TMBIM6存在于ER,TMBIM4存在于高尔基体,其余不详。②其他具有争议的:Sec61α、Bcl-2、TRPV1、早老素类和SERCA1T[34,43]。
3 线粒体钙转运系统
线粒体具有双层膜结构,分为线粒体外膜(OMM)、膜间隙、线粒体内膜(IMM)和线粒体基质4部分。线粒体基础钙振荡是产生ATP的驱动力。线粒体Ca2+的摄取和释放分别由线粒体钙单向转运体(mitochondrial Ca2+uniporter,MCU)和线粒体Na+/Ca2+-Li+交换体(Na+/Ca2+-Li+exchanger,NCLX)完成,两者共同维持了线粒体的钙稳态。线粒体钙超载将诱导线粒体通透性转化孔(MPTP)开放,Ca2+和各种促凋亡因子经MPTP进入胞浆,导致了细胞损伤和凋亡[48]。
MCU不含经典的Ca2+结合域,无法自行调节通道活性。研究表明,存在多种辅助亚基与MCU相互作用,控制MCU的开放,与MCU共同组成了线粒体的Ca2+摄取通道。这些亚基包括:EMRE(Essential MCU regulatory element)、MICU(Mitochondrial Ca2+uptake)1/2/3、MCUR1(MCU regulator 1)[49]。MICU1被称作MCU的“门卫”,胞浆Ca2+浓度较低时,它可以阻止Ca2+通过MCU进入线粒体。Dong Z[50]等发现,人类MCU的第97位半胱氨酸(Cys-97)是氧化还原感受器。当细胞氧化应激时,Cys-97发生谷胱甘肽化,使MCU通道活性增加,随之发生的是线粒体钙摄取率升高、线粒体活性氧增加,以及线粒体钙超载诱导的细胞死亡。Guan L[51]等研究了MCU与心肌缺血再灌注(I/R)的关系及相关机制。在I/R时,MCU表达升高,促进钙蛋白酶的活化,下调视神经萎缩相关蛋白1(OPA1),最终导致线粒体功能失衡。
近年来,许多研究集中于线粒体与其他细胞器连接部位的结构和功能上。线粒体外膜和内质网膜存在紧密联系,被称作线粒体内质网结构耦联/线粒体相关膜(Mitochondriaassociated membranes,MAM)。MAM参与多种细胞过程,包括钙稳态的维持、自噬、脂质代谢、细胞凋亡和肿瘤增殖等。在MAM结构中,ER和线粒体之间的距离为10~30 nm,这有利于物质的有效运输,节省扩散运输的时间。葡萄糖调节蛋白75(Glucose-regulated protein 75,GRP75)是MAM的分子伴侣,将内质网IP3Rs Grp75与线粒体外膜的电压依赖性阴离子通道1(VDAC1)进行物理连接,IP3Rs释放的Ca2+经VDAC1进入线粒体膜间隙,再经MCU进入线粒体基质[52]。多种氧化还原敏感的蛋白调节MAM功能:Ero1α、Erp44、TMX1和Sigma-1受体(Sig1R)。Sig1R通过稳定IP3R的释钙功能来延长由ER向线粒体的钙信号传播。另外,线粒体钙瞬变能够诱导H2O2从线粒体嵴释放,H2O2又促进ER Ca2+释放[48]。
4 其他钙转运系统
4.1 CRAC
钙池操纵性钙内流(Store operated calcium entry,SOCE)是非兴奋性细胞中普遍存在的钙进入途径。1977年Putney首提SOC的概念,而CRAC(Calcium release activated calcium)通道是典型的SOCE通道,由ER钙离子感受器蛋白STIM和质膜Orai离子通道组成。当ER钙库耗竭时,STIM1构象重排变成二聚体,与Orai1相互作用,Orai1通道被激活,促进胞外Ca2+内流,随后被SERCA摄入内质网,最终实现ER钙库的重新填充[52]。SOCE通道由质膜-ER膜微域形成,因此,SOCE不会致全细胞钙升高,只是微域内钙升高。
4.2 线粒体内质网结构耦联
近年来,许多研究将注意力集中在线粒体与其他细胞器连接部位的结构和功能上。线粒体外膜和内质网膜存在紧密联系,被称作线粒体内质网结构耦联/线粒体相关膜(mitochondria-associated membranes,MAM)。MAM参与多种细胞过程,包括钙稳态的维持、自噬、脂质代谢、细胞凋亡和肿瘤增殖等。MAM结构中ER和线粒体之间的距离短(仅10~30 nm),有利于物质的有效运输,节省扩散运输的时间。葡萄糖调节蛋白75(glucose-regulated protein 75,GRP75)是MAM的分子伴侣,将内质网IP3Rs与线粒体外膜的电压依赖性阴离子通道1(VDAC1)进行物理连接,IP3Rs释放的Ca2+经VDAC1进入线粒体膜间隙,再经MCU进入线粒体基质[53]。多种氧化还原敏感的蛋白调节MAM功能:Ero1α、Erp44、TMX1和Sigma-1受体(Sig1R)。Sig1R通过稳定IP3R的释钙状态,从而延长由ER向线粒体的钙信号传播。另外线粒体钙瞬变能够诱导H2O2从线粒体嵴释放,H2O2又促进ER Ca2+释放[48]。
4.3 双孔通道
真核细胞中,双孔通道(Two-Pore Channels,TPCs)是介导Na+、Ca2+转运的离子通道家族,包括三个亚型(TPC1-3),每个亚型由两个重复的6次跨膜结构组成。TPCs定位于细胞的酸性钙库,如核内体和溶酶体。人类只有TPC1/2两种通道,而不含TPC3,TPC3存在于一些哺乳动物和脊椎动物中,且在细胞质膜和内溶酶体膜均有分布。TPC1/3是电压门控通道,而TPC2是配体门控通道,其开放依赖于PIP2与内溶酶体的结合[29]。在多数真核细胞中,烟酸腺嘌呤二核苷酸磷酸(NAADP)促进酸性钙库的钙释放,使胞浆Ca2+浓度短暂升高,影响细胞的生理过程。雷帕霉素靶蛋白(mTORC1)与TPC1/2结合形成复合物抑制TPC通道的开放。TPCs通过释放Ca2+入胞浆来控制物质(如受体蛋白、病毒)的运输,可以将TPCs作为靶点筛选对抗埃博拉病毒的药物。Christopher J等[30]证明多巴胺拮抗剂和选择性雌激素受体调节剂通过缩短TPC2的开放时间来抑制其活性,通过抑制TPC2的电流来阻断埃博拉病毒的入侵。已被鉴定为TPC的阻滞剂包括:吩噻嗪类(氟奋乃静、甲哌氟丙嗪、普鲁氯嗪和甲硫哒嗪);雌激素调节剂类(克罗米芬、他莫昔芬、托瑞米芬、雷洛昔芬和巴多昔芬)。从进化上看,TPCs可能是电压门控钙/钠通道(CaV和NaV)的中间体,实验证明CaV和NaV的阻滞剂对TPCs有效[54]。
4.4 钙隧穿(Ca2+ Tunnelling)
Ca2+在胞浆扩散的过程中,可能激活不必要的信号通路,如果存在一种机制避免这种情况的发生将是十分有利的。Petersen OH等[55]重点研究了两类不同的细胞(胰腺腺泡细胞和青蛙卵母细胞),提出了一种新的钙转运模式,即钙隧穿(Ca2+Tunnelling)。在胰腺腺泡细胞中,Ca2+从基底膜CRAC通道进入细胞、经SERCA、ER、IP3R到达顶膜附近,调节消化酶的转运和分泌,并激活腺泡浆膜的氯离子通道(ANO1)(见图2)。胞浆钙结合能力远高于ER,而钙隧穿模式很好地解决了胞浆对Ca2+高度缓冲的问题,也避免了激活其他Ca2+依赖过程的风险。这种钙转运机制既高效又精准。推测钙隧穿具有普遍性,在其他细胞中也可能存在。
5 结语与展望
Ca2+是细胞内重要的第二信使,钙信号的调控方式多样,调控机制复杂。钙泵、钙通道和钠-钙交换体对Ca2+的精确调控实现了细胞的正常生理活动,它们的功能一旦异常将导致细胞钙稳态失衡,引发一系列疾病,它们是新药开发的重要靶点。而对钙转运系统的结构组成和药理学性质的研究是药物开发的前提。近年来一些新的钙转运模式被发现,例如,质膜-ER膜微域、ER膜-线粒体膜微域和钙隧穿等。它们的结构功能和作用机制被相继报道,但仍存在争议。医药学专家需要进一步研究钙转运系统的生理病理特性,揭示它们与疾病的关系,找到治疗疾病的新途径。
