肺胶样腺癌4例临床病理分析
2020-05-22陈金平周新成殷宪刚
陈金平,周新成,葛 荣,殷宪刚
肺胶样腺癌(colloid adenocarcinoma, CA)是一种罕见肿瘤,约占所有原发肺癌的0.24%[1]。该肿瘤被认为是一种腺癌,伴有丰富黏液,黏液充满肺泡腔且破坏肺泡壁。以前肺CA一直被诊断为“黏液性囊腺瘤”、“黏液性囊性肿瘤”以及“黏液性囊腺癌”等[2],WHO(2015)肺肿瘤分类将其归为一种特殊类型的腺癌。由于CA临床罕见,目前只有少数个案报道,尚无完善的病理形态学诊断标准以及适合的治疗方案[3-4]。肺CA需与肺浸润性黏液腺癌和胃肠道、卵巢、乳腺及胰腺转移的黏液腺癌鉴别。本文现报道4例CA,探讨其临床病理学特征、免疫表型、诊断及鉴别诊断,并复习相关文献,旨在提高对其认识水平。
1 材料与方法
1.1 临床资料 2014年1月~2018年8月宁波市临床病理诊断中心从3 652例肺癌手术标本中搜集4例肺CA(占0.11%),从以下几方面记录患者的临床病理资料:年龄、性别、吸烟史、临床分期、手术方式、影像学特征、肿瘤发生部位、肿瘤最大径、肺膜侵犯、淋巴结转移、辅助化疗、复发或转移、预后等。参照国际癌症联盟发表的第8版TNM分期对4例肺CA进行临床分期,并记录黏液成分的相对比例(表1)。
1.2 方法 标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片,行HE和免疫组化染色,镜下观察。免疫组化染色采用EnVision法。所用抗体包括CK7、CDX-2、TTF-1、Napsin A、MUC2、Villin,均购自福州迈新公司,具体操作步骤严格按试剂盒说明书进行。
1.3 结果判读 根据DAB显色结果,抗体可在细胞膜、细胞质或细胞核着色,呈棕黄色或棕褐色颗粒为阳性。每张切片任选10个高倍视野,计数阳性细胞数及细胞总数,得出阳性细胞百分率,无阳性细胞为阴性,>10%为阳性,阳性可分为灶阳性和弥漫阳性。
2 结果
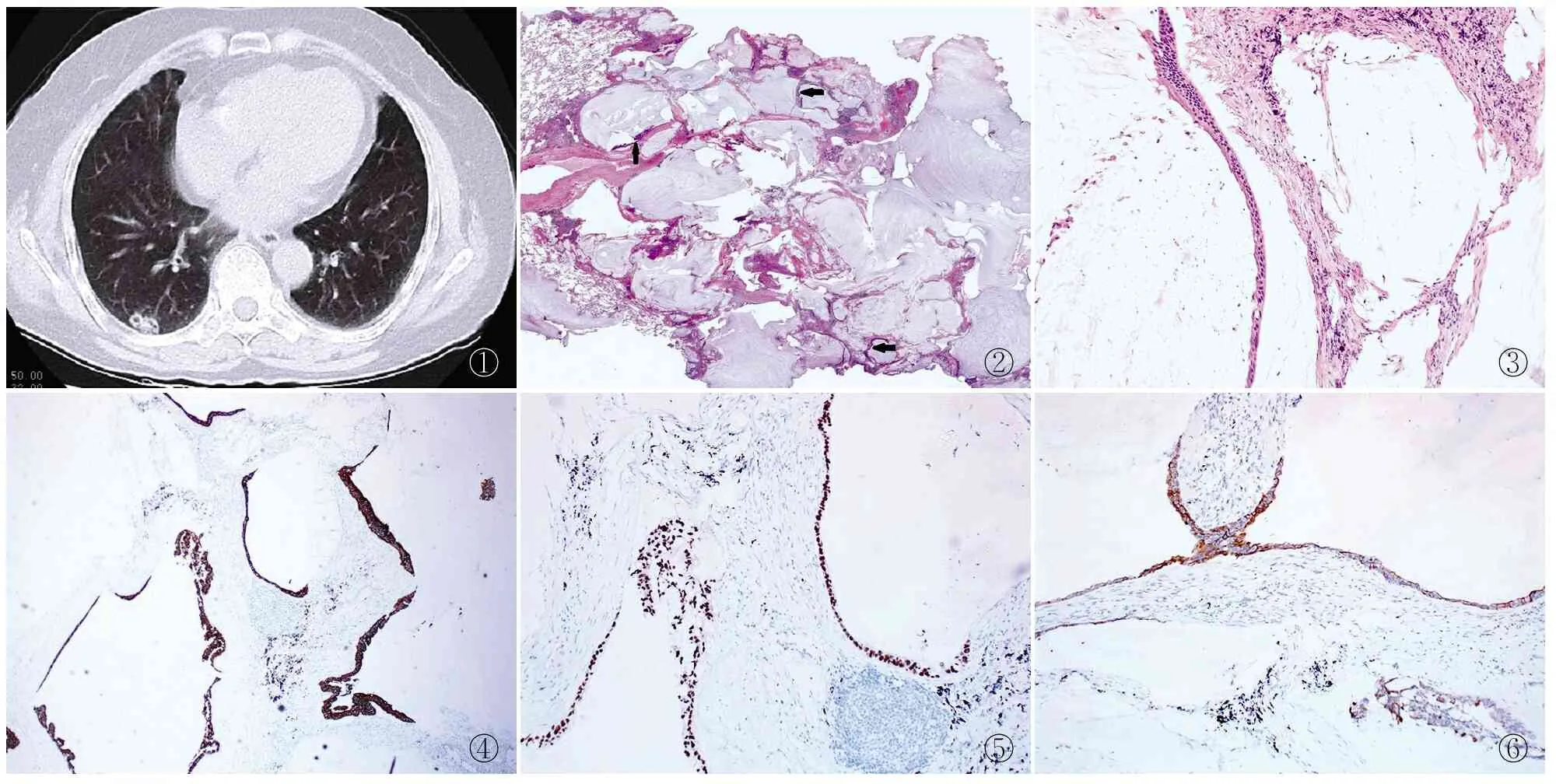
2.1 临床特征 4例肺CA,男性2例,女性2例,年龄51~69岁,平均59.5岁,1例患者有吸烟史,4例肿瘤CT检测均表现为孤立性囊实性结节,边界清楚(图1),肿瘤大体呈灰白色胶冻状,瘤体最大径1.3~3.2 cm(平均2.1 cm)。4例肿瘤位于右肺上、中部及下叶各1例,位于左肺下叶1例。所有病例均未见胸膜侵犯及淋巴结转移,3例患者术前行肺穿刺活检,2例被诊断为腺癌伴大量黏液产生;1例仅见大量黏液而未明确诊断。4例患者均行肺叶切除+肺门淋巴结清扫术,术后均未行化疗(表1)。
2.2 病理检查 肿瘤灰白色,质软,局部胶冻状,4例肿瘤黏液含量70%~90%,肿瘤富含大量黏液(图2),黏液湖充填肺泡腔且破坏肺泡壁(图3),肿瘤由两种细胞构成,一种为杯状细胞;一种为低柱状上皮细胞,细胞轻度异型。
2.3 免疫表型 4例CK20(图4)、CDX-2(图5)、CK7(图6)均阳性,例3 Napsin A局灶阳性,余均阴性,4例TTF-1、Villin均阴性。
2.4 预后及随访 4例患者采用电话方式进行随访,每6个月1次,随访1~4年,所有患者均未见复发及转移,预后良好。
3 讨论
肺CA是一种极为罕见的肺腺癌亚型[5],其临床病理特征尚不明确,本组4例肺CA的临床病理特征与文献报道相似[6]。4例肺CA患者在1~3.5年的随访中,未发现复发或转移现象。文献报道CA可复发或转移,但复发或转移率明显低于原发于肺的浸润性黏液腺癌(invasive mucinous adenocarcinoma, IMA)[7]。4例肺CA的CT检测均表现为孤立的囊实性结节,这可能有助于区分肺CA与肺IMA,因为IMA的CT表现有时为肺炎型阴影。IMA的CT表现通常表现为两种类型:孤立型和肺炎型[8],肺炎型肿瘤预后不良。
组织学上,虽然肺CA以破坏肺泡壁的大量黏液蛋白为特征,但肿瘤的定义尚不明确[9]。肺CA常被误诊为肺IMA。本组实验发现,CA镜下见大量细胞外黏液,黏液中漂浮着肿瘤细胞,瘤细胞贴付在肺泡壁、囊壁内侧或纤维间隔的表面。瘤细胞为富含黏液的杯状细胞,分泌出黏液后可呈矮立方甚至扁平状,单层或复层。与浸润性黏液腺癌的最大区别在于明显的肺泡壁被破坏而产生的黏液湖,黏液湖中可见漂浮的瘤细胞、断裂的肺泡壁和纤维间隔穿过。肺CA的黏液含量50%~90%不等,一般要求>50%,而IMA的黏液含量通常<50%;此外所有肺CA边界相对清楚。免疫组化标记CDX-2、CK20、Villin均阳性,肺CA中肿瘤细胞较少,瘤细胞由低柱状上皮和少量杯状上皮组成。IMA由高柱状或杯状细胞两类细胞构成,而且IMA中CDX-2、CK20、Villin阴性或仅部分呈弱阳性。IMA中肿瘤细胞数量远多于肺CA,IMA肿瘤细胞常由一种肿瘤细胞构成,而肺CA则可同时由两种细胞构成。IMA可沿着肺泡壁呈跳跃式的播散,CT表现与肺炎相似,边界不清,虽然IMA肿瘤细胞的异型性有时也比较小,但总体上异型性要大于肺CA。

表1 4例肺胶样腺癌的临床特征
①②③④⑤⑥
图1 CT示右下肺外周孤立性囊实性结节,边界尚清 图2 低倍视野下见肿瘤富含黏液,箭头所示为附壁生长的癌上皮 图3 中倍视野下黏液内见肿瘤细胞巢,瘤细胞呈杯状细胞或低柱状细胞形态,单层或复层排列,细胞轻度异型 图4 肿瘤细胞CK20阳性,EnVision法 图5 肿瘤细胞CDX-2阳性,EnVision法 图6 肿瘤细胞CK7阳性,EnVision法
胃肠道转移性黏液腺癌与肺CA的鉴别诊断非常困难。两者免疫组化标记CDX-2、CK20、Villin均阳性,形态特征相似,黏液丰富,边界清晰。但前者应具有胃肠道黏液腺癌病史。如果患者无胃肠道腺癌病史,建议医师仔细检查患者胃肠道,直至完全排除为止。当然我们仍然可以在这两者间找到一些差异,如胃肠道转移性黏液腺癌通常可见坏死,肿瘤细胞丰富,免疫组化标记SATB2阳性,CK7阴性,肿瘤细胞异型性大;而肺CA无坏死,肿瘤细胞含量少,免疫组化标记SATB2阴性,免疫组化标记CK7弥漫阳性以及少数肺CA中Napsin A可局灶阳性,肿瘤细胞异型性小等,这些均是与转移性胃肠道黏液腺癌不同之处,可用于鉴别诊断。
女性肺CA还需与乳腺、卵巢转移性黏液腺癌鉴别,男性还需与胰腺转移性黏液腺癌鉴别,乳腺黏液腺癌中GATA-3、ER、PR均阳性,CK20、CDX-2、Villin等阴性;卵巢黏液腺癌中PAX8、ER、PR及CA125均阳性,CK20一般阴性,因此通过免疫组化将上述两种黏液腺癌与CA进行鉴别并不困难。当然,我们不能单纯通过免疫组化将肺CA与胰腺转移的黏液腺癌鉴别,但是由于胰腺器官比较小,早期常有腹疼、黄疸等临床体征,结合B超和CT检查,两者不难鉴别。
Tsuta等[10]通过对一些肺腺癌的黏液产物进行免疫组化染色分析,显示出免疫组化染色模式的差异,提示产生黏液的肺腺癌可能有不同的发病机制。既往报道显示肺CA中CK7和MUC2阳性率较高。另一方面,CK20染色呈弱阳性[11]。然而,本组4例CK7、MUC2和CK20均强阳性。Chu等[12]的研究结果表明,肺CA代表了一个具有两种不同组织学变异的类型:杯状细胞型和印戒细胞型。其报道的印戒细胞类型更具侵袭性,预后较差。然而,在本组实验中,作者未发现印戒细胞类型。因此,印戒细胞的外观可能并非肺CA的特征。在WHO(2015)最新的腺癌分类中,印戒细胞的类型被排除在肺CA的组织学类型之外。
肺CA的治疗策略应以原发性肺癌的治疗原则为基础,Masai等[13]报道1例因局部复发而行楔形切除术的病例,因此肺门淋巴结清扫+肺叶切除术可作为肺CA治疗方式,类似于非小细胞肺癌手术。
综上所述,肺CA的主要特点为CT检测显示为孤立性囊实性结节,组织学上极度富含黏液,肿瘤细胞少,瘤体边界清晰,转移性黏液腺癌虽然边界清楚,但常为多个结节,但是肺CA与IMA及其他转移性黏液腺癌的鉴别有时较困难,必要时可综合免疫组化、分子检测以及仔细的临床检查。
