2019年CHINET三级医院细菌耐药监测
2020-05-22胡付品郭燕朱德妹汪复蒋晓飞徐英春张小江张朝霞季萍谢轶康梅王传清王爱敏徐元宏黄颖孙自镛陈中举倪语星孙景勇褚云卓田素飞胡志东0李金0俞云松单斌杜艳郭素芳魏莲花邹凤梅张泓王春胡云建艾效曼卓超苏丹虹郭大文赵金英黄湘宁刘文恩0李艳明0邵春红徐雪松鄢超王山梅楚亚菲张利侠马娟周树平周艳朱镭孟晋华董芳郑红艳胡芳芳沈瀚周万青贾伟0李刚0吴劲松卢月梅李继红段金菊康建邦马晓波郑燕萍郭如意朱焱陈运
胡付品,郭燕,朱德妹,汪复,蒋晓飞,徐英春,张小江,张朝霞,季萍,谢轶,康梅,王传清,王爱敏,徐元宏,黄颖,孙自镛,陈中举,倪语星,孙景勇,褚云卓,田素飞,胡志东0,李金0,俞云松,林 洁,单斌,杜艳,郭素芳,魏莲花,邹凤梅,张泓,王春,胡云建,艾效曼,卓超,苏丹虹,郭大文,赵金英,喻 华,黄湘宁,刘文恩0,李艳明0,金 炎,邵春红,徐雪松,鄢超,王山梅,楚亚菲,张利侠,马娟,周树平,周艳,朱镭,孟晋华,董芳,郑红艳,胡芳芳,沈瀚,周万青,贾伟0,李刚0,吴劲松,卢月梅,李继红,段金菊,康建邦,马晓波,郑燕萍,郭如意,朱焱,陈运生,孟青
近年来,临床上重要耐药细菌,尤以革兰阴性杆菌为代表的多重耐药细菌的检出率呈快速上升趋势,为临床的抗感染治疗带来巨大挑战[1-2]。细菌耐药监测工作是了解细菌耐药变迁、遏制耐药菌进一步流行播散最重要的基础工作之一。现将2019年CHINET三级医院细菌耐药监测结果报道如 下。
1 材料与方法
1.1 材料
1.1.1 细菌收集2019年1月1日-12月31日来自全国27个省市自治区36所三级医院的(30所综合性医院和6所儿童专科医院)临床分离株,剔除同一患者分离的重复菌株,按统一方案进行细菌对抗菌药物的敏感性试验,剔除非无菌体液标本分离的凝固酶阴性葡萄球菌和草绿色链球菌。
1.2 方法
1.2.1 药敏试验参照2019年美国临床和实验室标准化协会(CLSI)推荐的药敏试验要求[3],按CHINET的监测技术方案、采用纸片扩散法或自动化仪器法进行。药敏试验质控菌为:金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、肺炎链球菌ATCC 49619和流感嗜血杆菌ATCC 49247。
1.2.2 判断标准参照2019年CLSI M100文件推荐的判断标准[3]。其中磷霉素的判断标准仅针对尿标本分离的大肠埃希菌和粪肠球菌,多黏菌素的判断标准采用CLSI 2020年M100文件标准[4],替加环素按美国食品和药品监督管理局(FDA)推荐的判断标准[5]。
1.2.3 β内酰胺酶检测采用头孢硝噻吩试验定性检测流感嗜血杆菌中的β内酰胺酶。按CLSI推荐的纸片法酶抑制剂增强试验[3],确证大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌中产超广谱β内酰胺酶(ESBL)菌株。
1.2.4 青霉素不敏感肺炎链球菌的检测经1 μg/ 片苯唑西林纸片法测定抑菌圈直径≤19 mm的肺炎链球菌菌株,采用青霉素E试验条测定其最低抑菌浓度(MIC),脑膜炎株和非脑膜炎株分别按2019年CLSI M100文件相关标准判定为青霉素敏感(PSSP)、中介(PISP)或耐药(PRSP)[3]。
1.2.5 糖肽类不敏感革兰阳性球菌检测常规药敏试验显示万古霉素、利奈唑胺或替考拉宁不敏感(包括中介和耐药)的菌株,采用其他方法测定万古霉素、利奈唑胺或替考拉宁的MIC值进行复核确认,部分菌株采用PCR法确认万古霉素耐药的基因型,如vanA、vanB或vanM基因。
1.2.6 特殊耐药菌株定义碳青霉烯类耐药肠杆菌科细菌(CRE)定义为对亚胺培南、美罗培南或厄他培南中任一种抗生素耐药者[6]。其中摩根菌属、变形杆菌属等细菌应为除了亚胺培南之外对任一碳青霉烯类抗生素耐药者。
1.2.7 数据统计分析数据统计分析采用WHONET 5.6软件。
2 结果
2.1 细菌分布
2019 年共收集临床分离株249758株,其中革兰阳性菌和革兰阴性菌分别占2 9.0%(72 339/249 758)和71.0%(177 419/249 758)。住院患者和门急诊患者分离的菌株分别占86.5%和1 3.5%。标本分布中痰液等呼吸道分泌物占40.7%、尿液19.2%、血液15.1%、伤口脓液6.0%、脑脊液1.3%、其他无菌体液4.5%、生殖道分泌物1.2%、粪便1.0%和其他标本11.1%。肠杆菌科细菌占所有分离菌株的43.1%(107 575/249 758),其中最多见者依次为大肠埃希菌(44.2%)、肺炎克雷伯菌(33.4%)、阴沟肠杆菌(5.9%)、奇异变形杆菌(3.0%)。不发酵糖革兰阴性杆菌占所有分离菌株的23.8%(59 386/249 758),其中最多见者依次为鲍曼不动杆菌(38.2%)、铜绿假单胞菌(36.5%)、嗜麦芽窄食单胞菌(10.5%)和洋葱伯克霍尔德菌(3.0%)。革兰阳性菌中最多见者依次为金黄色葡萄球菌(32.2%)、屎肠球菌(14.4%)、粪肠球菌(10.6%)和肺炎链球菌(9.6%)。主要细菌菌种分布见表1。
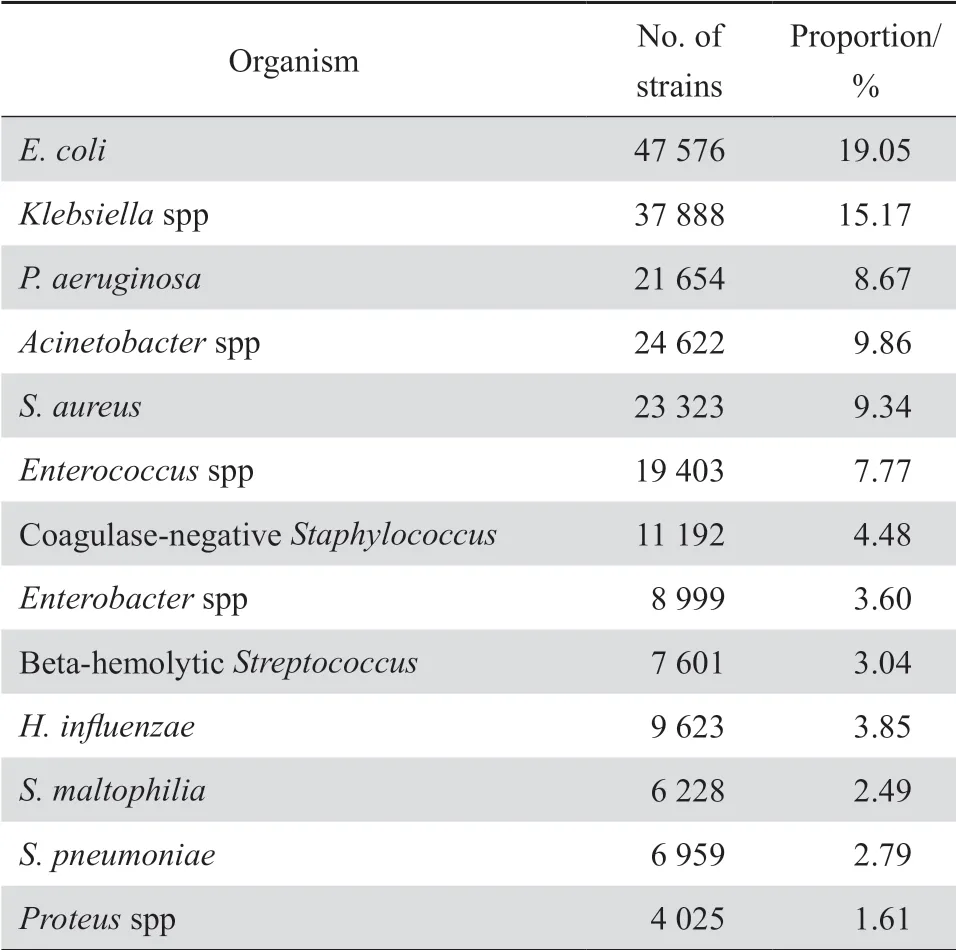
表1耐药监测菌种分布Table 1 Distribution of bacterial species in the bacterial resistance surveillance program
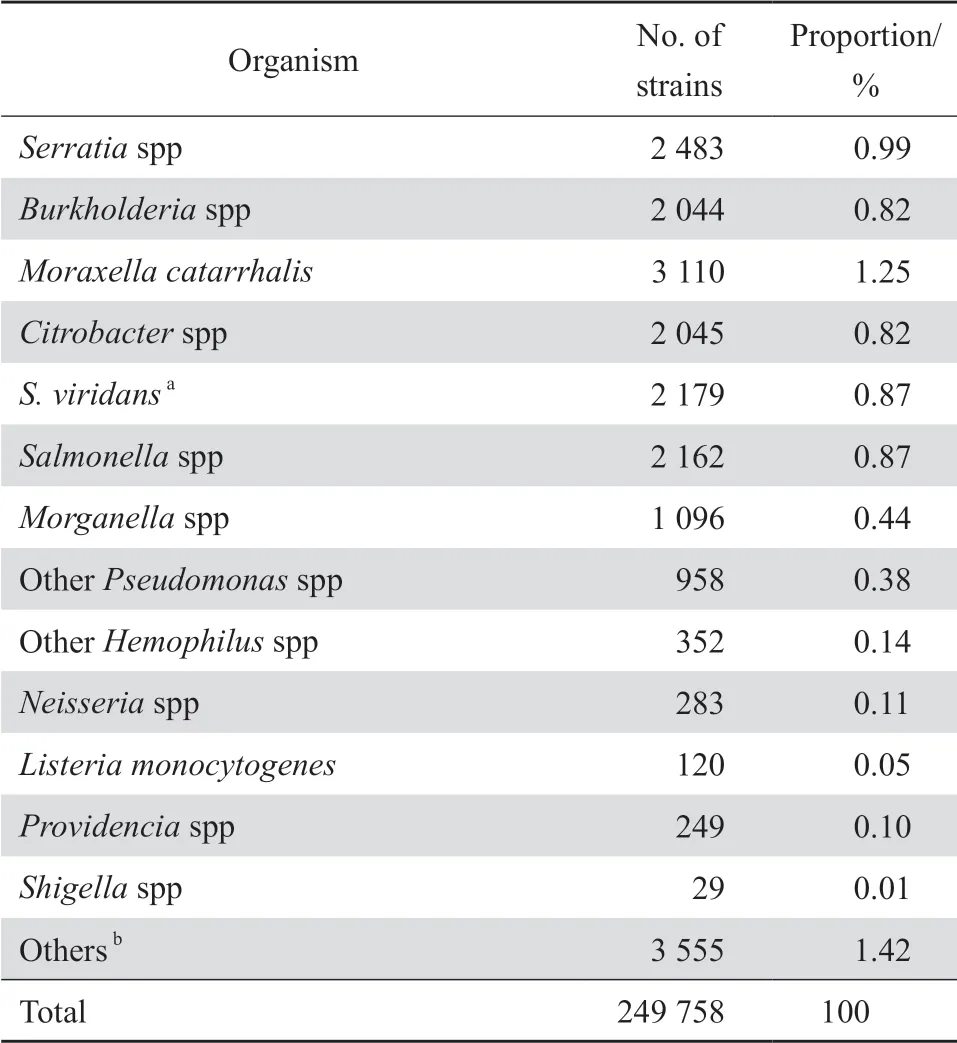
表1(续)Table 1(continued)
2.2 革兰阳性球菌对抗菌药物的耐药率和敏感率
2.2.1 葡萄球菌属金黄色葡萄球菌中甲氧西林耐药株(MRSA)的检出率为31.4%,表皮葡萄球菌中甲氧西林耐药株(MRSE)的检出率为82.4%,其他葡萄球菌属细菌(不包括假中间葡萄球菌和施氏葡萄球菌)中甲氧西林耐药凝固酶阴性葡萄球菌(MRCNS)的检出率为77.9%。MRSA和MRCNS对大环内酯类、氨基糖苷类和喹诺酮类等抗菌药物的耐药率均显著高于甲氧西林敏感株(MSSA和MSCNS)。但MRSA对甲氧苄啶-磺胺甲唑的耐药率低于MSSA(7.3%与17.2%)。MRSE对甲氧苄啶-磺胺甲唑的耐药率明显高于MRSA(58.7%与7.3%),但对克林霉素的耐药率则显著低于MRSA(34.1%与58.3%)。葡萄球菌属中尚未发现万古霉素耐药的菌株,极少数MRCNS对替考拉宁或利奈唑胺耐药。见表2。
2.2.2 肠球菌属肠球菌属细菌中粪肠球菌和屎肠球菌所占的比列分别为39.6%(7 676/19 403)和53.7%(10 413/19 403),其他肠球菌占6.8%(1 314/19 403)。粪肠球菌对绝大多数受测试抗菌药物的耐药率均显著低于屎肠球菌,其对呋喃妥因、磷霉素和氨苄西林的耐药率较低,分别为1.9%、4.2%和3.0%,但屎肠球菌对呋喃妥因和氨苄西林的耐药率均较高,分别为46.9%和91.4%。两者对高浓度庆大霉素的耐药率分别为36.6%和51.2%。粪肠球菌和屎肠球菌中均有少数万古霉素、替考拉宁和利奈唑胺耐药株。见表3。
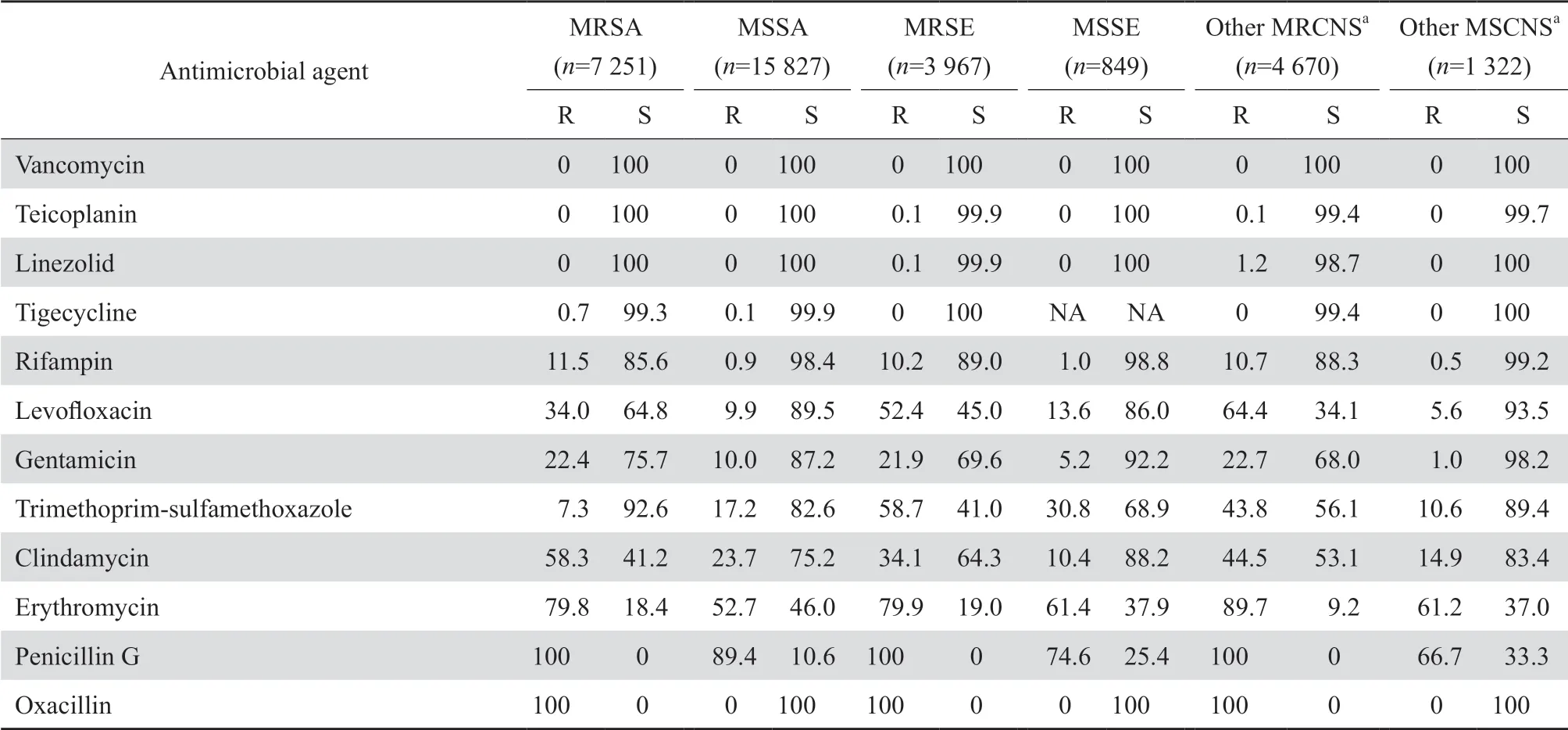
表2葡萄球菌属对抗菌药物的耐药率和敏感率Table 2 Resistance and susceptibility rates of Staphylococcus strains to antimicrobial agents(%)
2.2.3 链球菌属2019年儿童患者分离的肺炎链球菌中,PSSP、PISP和PRSP的检出率分别为95.2%、4.1%和0.7%;成人患者分离的肺炎链球菌中,PSSP、PISP和PRSP分别为95.3%、3.1%和1.6%。儿童和成人患者中非脑膜炎肺炎链球菌2017—2019年分布情况见表4。药敏试验结果显示儿童株和成人株对红霉素、克林霉素和甲氧苄啶-磺胺甲唑耐药率均较高。儿童患者分离的PSSP株中出现极少数左氧氟沙星或莫西沙星的耐药株(耐药率≤0.2%),但较成人株为少。未发现万古霉素和利奈唑胺耐药株。见表5。
监测到A、B、C、F、G各组β溶血链球菌分别为2 936、3 816、449、33和43株;以及血液或脑脊液等无菌体液标本中的草绿色链球菌2 179株。未发现对青霉素耐药的β溶血链球菌,但8.4%的草绿色链球菌对青霉素耐药。各组链球菌属对红霉素和克林霉素的耐药率均超过70%。除B组β 溶血链球菌对左氧氟沙星的耐药率为51%,其他β 溶血链球菌对左氧氟沙星均高度敏感,耐药率为0~3.8%。未发现万古霉素和利奈唑胺耐药的链球菌属细菌。见表6。
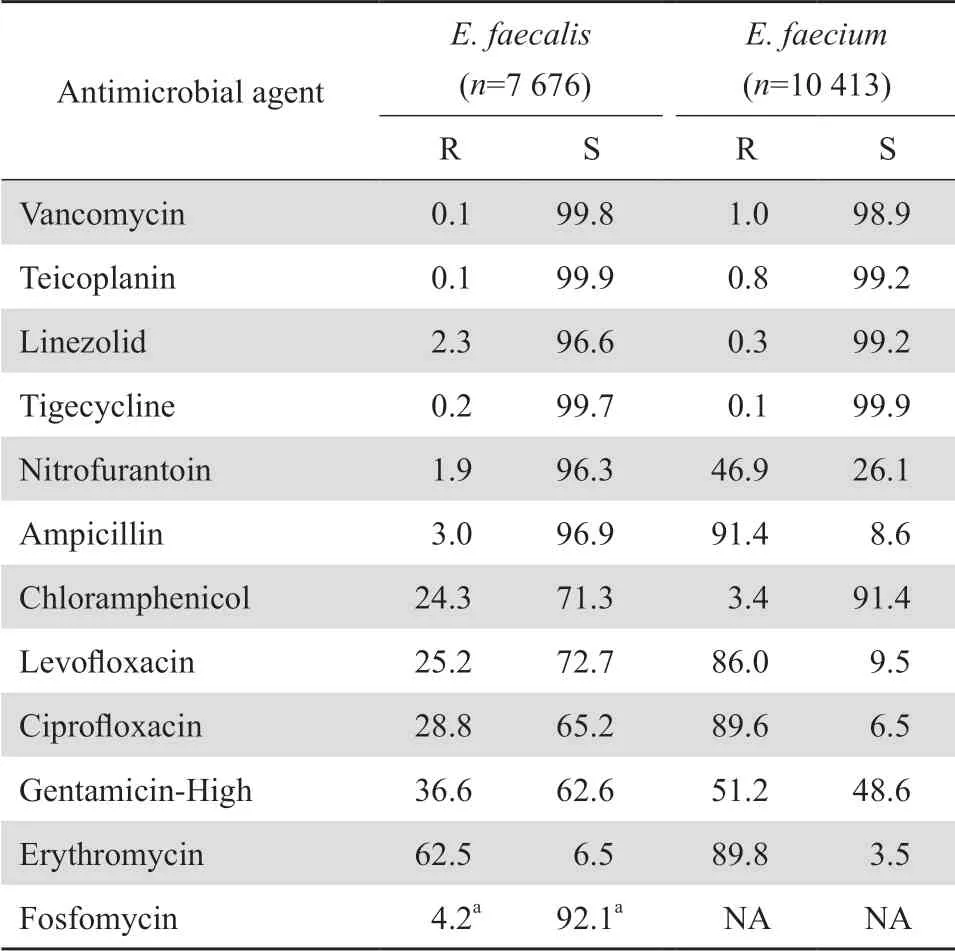
表3粪肠球菌和屎肠球菌对抗菌药物的耐药率和敏感率Table 3 Resistance and susceptibility rates of Enterococcus spp.to antimicrobial agents(%)

表4儿童和成人患者中非脑膜炎肺炎链球菌的分布Table 4 The distribution of nonmeningitis S. pneumoniae isolates from children and adults

表5儿童和成人患者中非脑膜炎肺炎链球菌对抗菌药物的耐药率Table 5 Resistance rates of nonmeningitis S. pneumoniae isolated from children and adults to antimicrobial agents(%)
2.3 革兰阴性杆菌对抗菌药物的耐药率和敏感率
2.3.1 肠杆菌科细菌大肠埃希菌对头孢噻肟、头孢曲松、哌拉西林、甲氧苄啶-磺胺甲唑、环丙沙星和左氧氟沙星的耐药率均高于55%。肠杆菌科细菌对2种碳青霉烯类的耐药率仍较低,除克雷伯菌属细菌对亚胺培南和美罗培南的耐药率分别为24.5%和25.9%外,其他细菌的耐药率多在10%以下。见表7。2005-2019年分离肺炎克雷伯菌对碳青霉烯类的耐药变迁结果显示,该菌对碳青霉烯类的耐药率呈持续上升趋势,其对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%迅速上升至2019年的25.3%和26.8%,见图1。鼠伤寒沙门菌、肠沙门菌和都柏林沙门菌对氨苄西林的耐药率均超过80%,但伤寒沙门菌和副伤寒沙门菌对氨苄西林的耐药率仅为43.6%;所有沙门菌属细菌对头孢哌酮-舒巴坦、哌拉西林-他唑巴坦和碳青霉烯类均高度敏感,耐药率均低于10%。见表8。107 575株肠杆菌科细菌对常用抗菌药物的总耐药率和敏感率见表9。其中细菌对替加环素、多黏菌素、3种碳青霉烯类和阿米卡星的耐药率最低,为2.1%~11.5%,对哌拉西林-他唑巴坦和头孢哌酮-舒巴坦的耐药率分别为14.5%和15.6%。
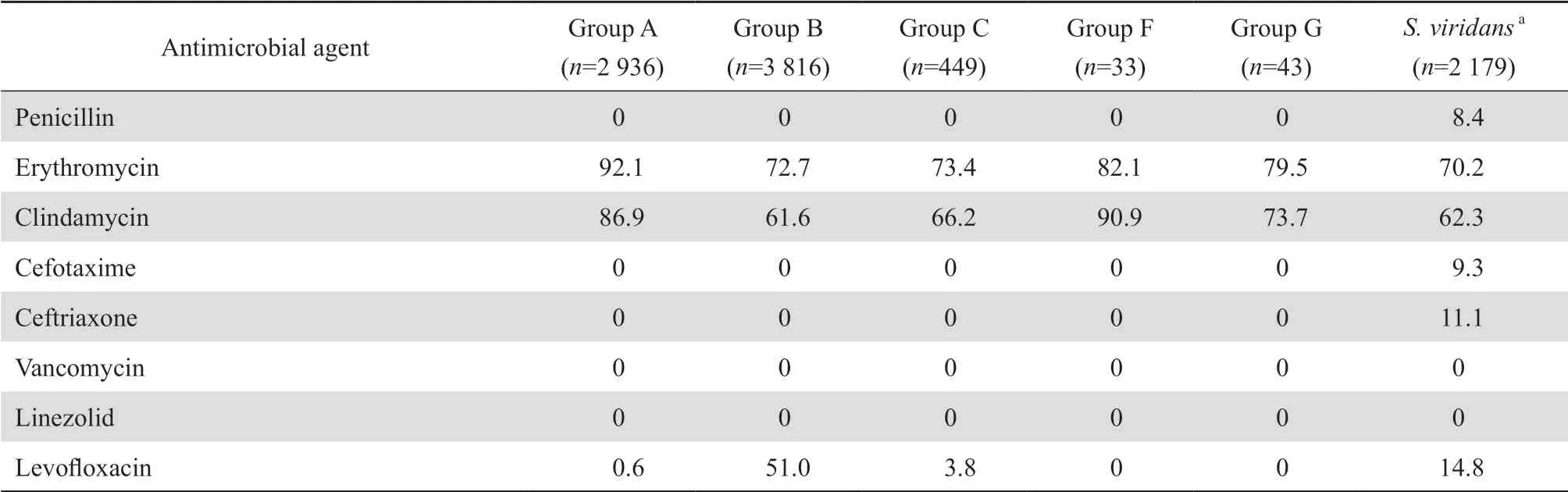
表6链球菌属对抗菌药物的耐药率 Table 6 Resistance rates of Streptococcus species to antimicrobial agents(%)
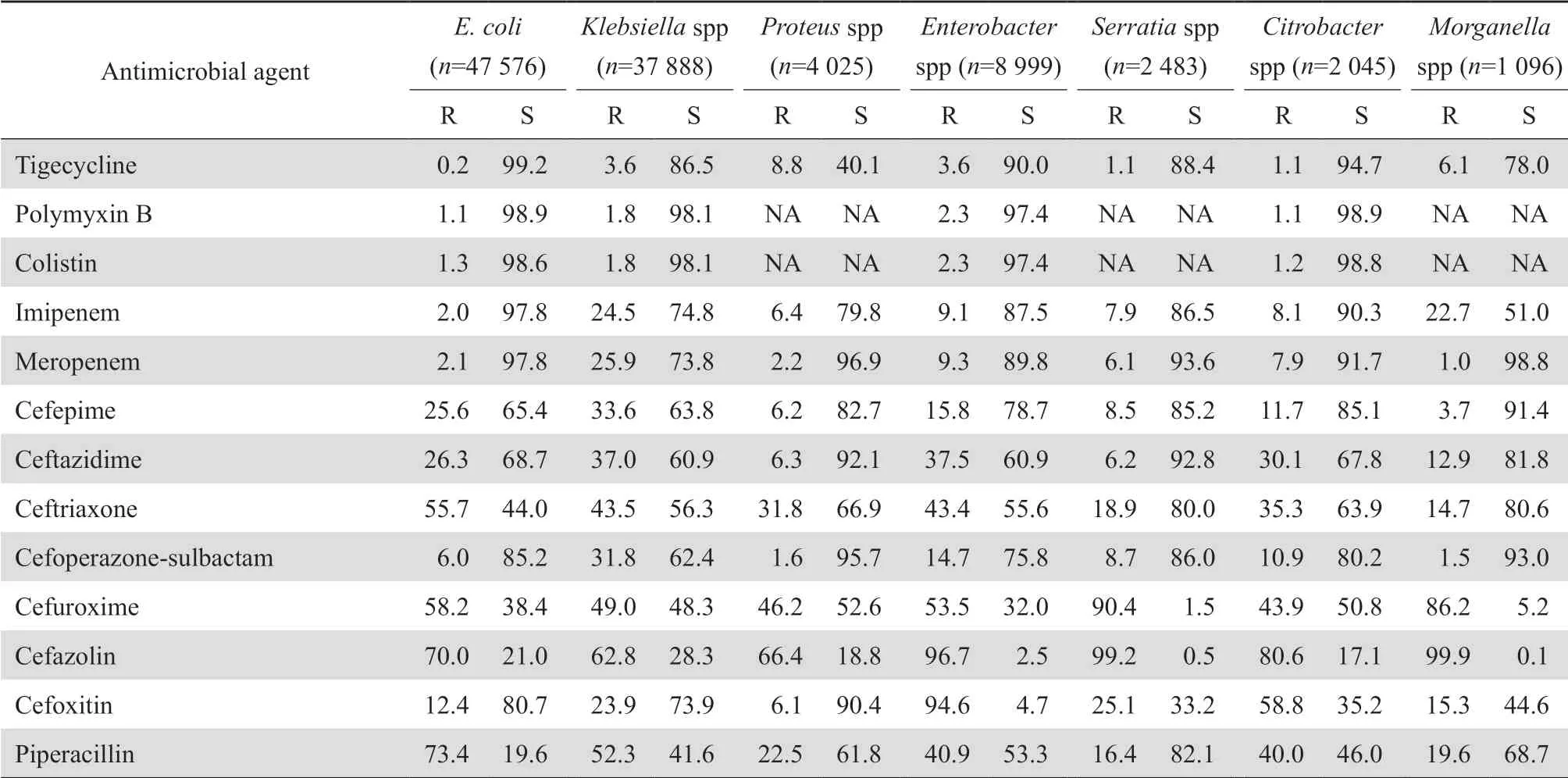
表7肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 7 Resistance and susceptibility rates of Enterobacteriaceae to antimicrobial agents(%)
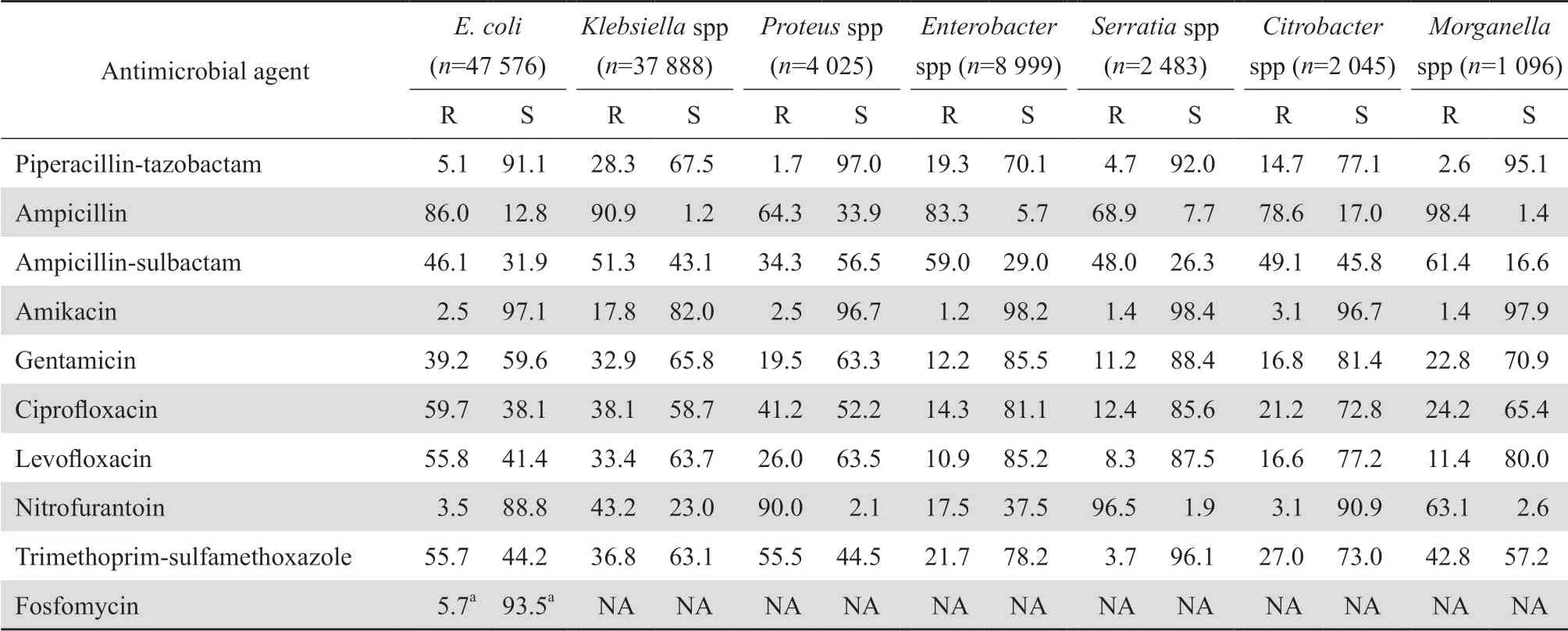
表7(续)Table 7(continued)(%)
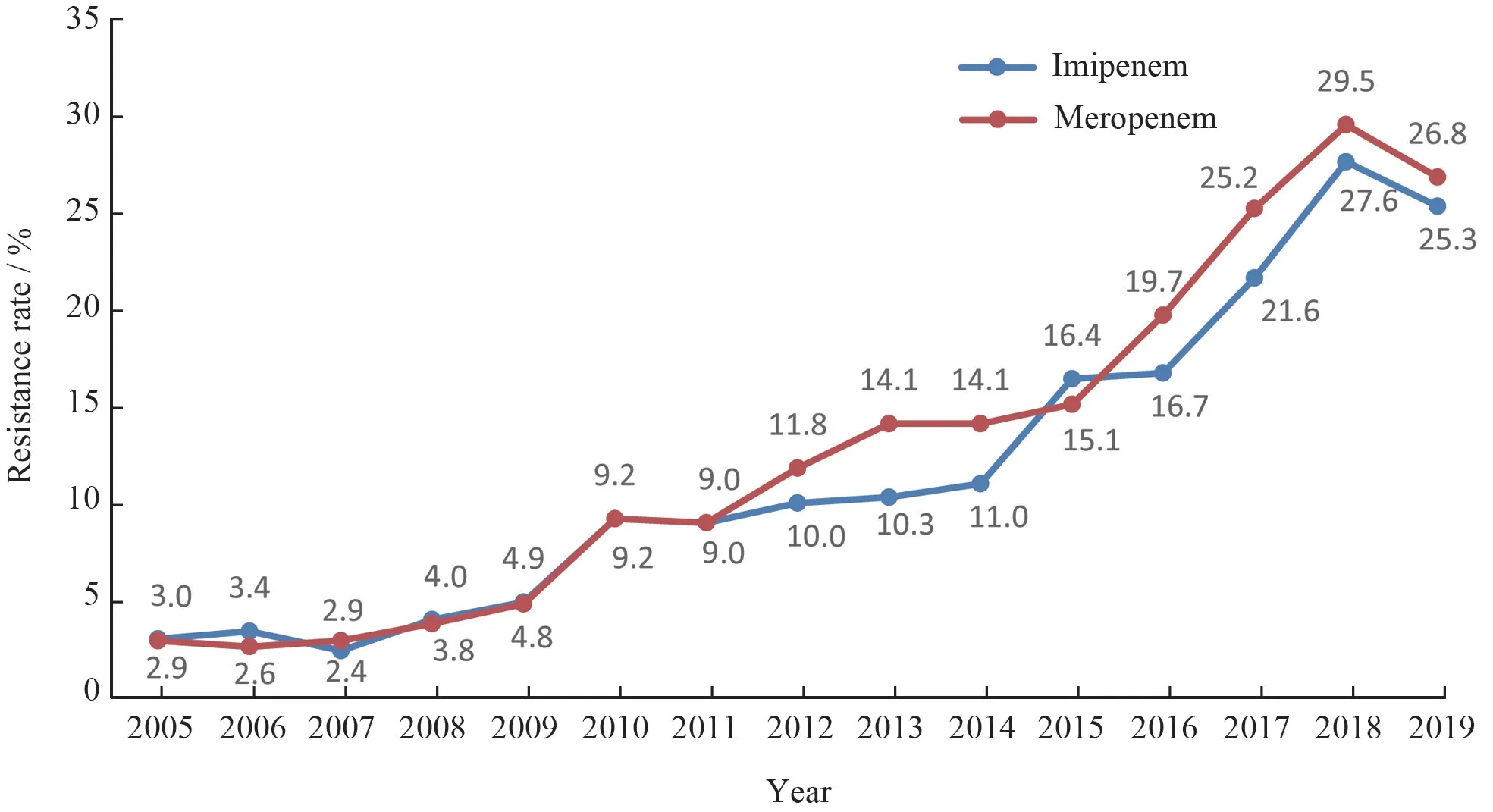
图1 2005-2019年CHINET 三级医院肺炎克雷伯菌对亚胺培南和美罗培南耐药变迁Figure 1 Changing resistance rates to imipenem and meropenem of K. pneumoniae strains isolated from tertiary hospitals in CHINET bacterial resistance surveillance program,2005-2019
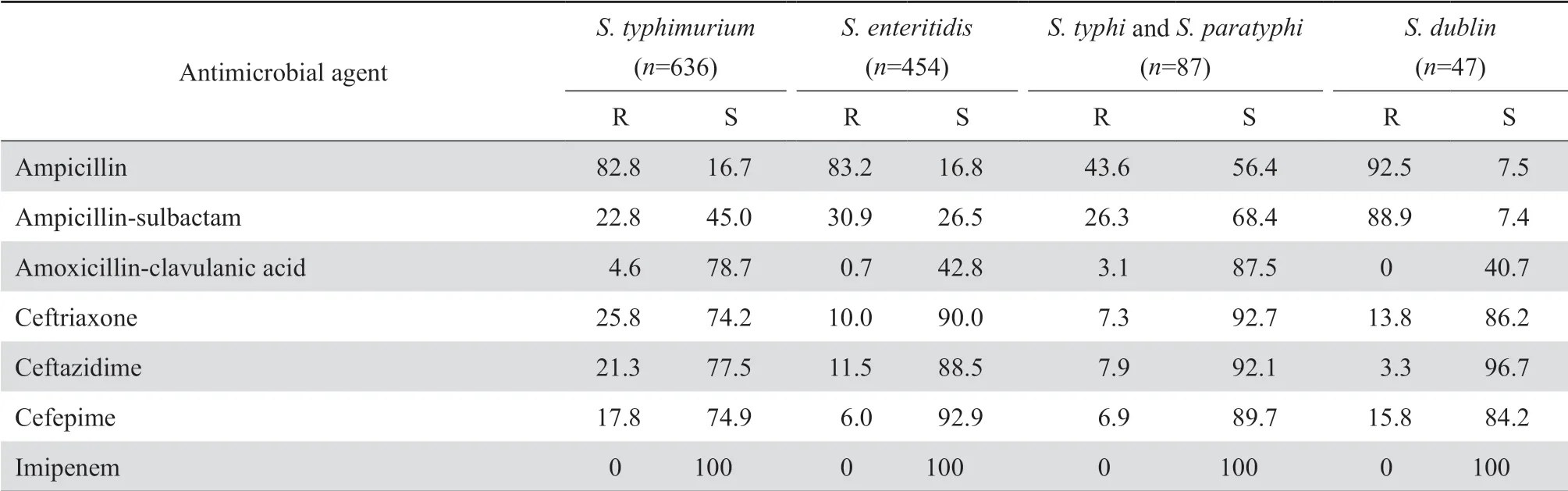
表8沙门菌属对抗菌药物的耐药率和敏感率Table 8 Resistance and susceptibility rates of Salmonella species to antimicrobial agents(%)
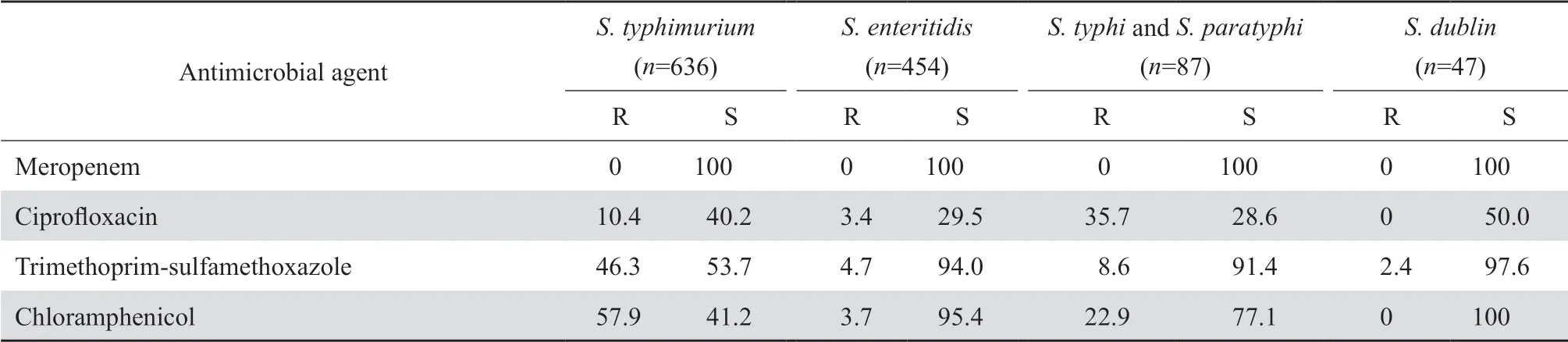
表8(续)Table 8(continued)(%)
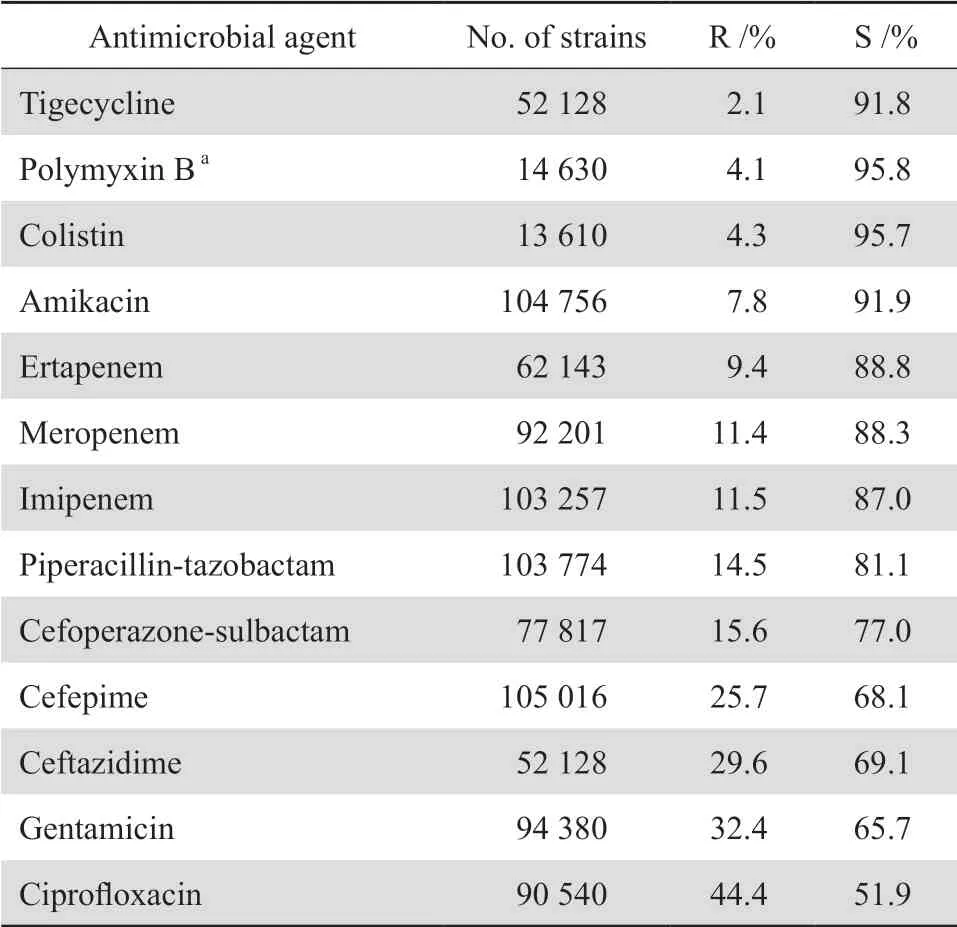
表9肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 9 Resistance and susceptibility rates of Enterobacteriaceae to antimicrobial agents
2.3.2 不发酵糖革兰阴性杆菌铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为27.5%和23.5%;对多黏菌素B、黏菌素和阿米卡星的耐药率分别为0.8%、1.1%和4.6%;对所测试的两种酶抑制剂合剂、庆大霉素、环丙沙星、左氧氟沙星、头孢吡肟和哌拉西林的耐药率<22%。不动杆菌属对亚胺培南和美罗培南的耐药率分别为73.6%和75.1%;对头孢哌酮-舒巴坦和米诺环素的耐药率分别为46.5%和46.2%,对多黏菌素B、黏菌素和替加环素的耐药率较低,为0.3%、0.5%和3.5%,对其他测试药的耐药率多在50%以上。嗜麦芽窄食单胞菌对甲氧苄啶-磺胺甲唑和米诺环素耐药率低于10%,对左氧氟沙星的耐药率为11.6%。洋葱伯克霍尔德菌对CLSI推荐的头孢他啶、米诺环素和甲氧苄啶-磺胺甲唑等抗菌药物的耐药率低,除对美罗培南和左氧氟沙星的耐药率分别为14.9%和25.2%外,对其他3药的耐药率低于10%。见表10。
2.3.3 其他革兰阴性杆菌9 623株流感嗜血杆菌中,儿童分离株和成人分离株分别占6 8.2%(6 562/9 623)、31.8%(3 061/9 623);β内酰胺酶的检出率分别为62.5%和49.3%。流感嗜血杆菌对氨苄西林的耐药率均近60%或以上。大多数流感嗜血杆菌对头孢曲松、美罗培南、左氧氟沙星和氯霉素均高度敏感,但对前三者均已出现不敏感株。不敏感率在儿童组约0.3%~2.1%,成人组约1.9%~6.4%。相比较而言,儿童分离株对氨苄西林、头孢呋辛、阿奇霉素和甲氧苄啶-磺胺甲唑的耐药率高于成人株。见表11。
3 讨论
碳青霉烯类耐药革兰阴性杆菌的流行播散是全球重大的公共卫生问题。由于碳青霉烯类耐药菌株往往对其他临床常用抗菌药物也耐药,使临床的抗感染治疗面临无药可用的困境,进而导致其所致感染的高病死率[7-9]。欧洲的一项耐药菌感染所致死亡率调查研究结果发现,虽然第三代头孢菌素耐药大肠埃希菌是引起感染死亡最多的病原菌,但碳青霉烯类耐药肺炎克雷伯菌和碳青霉烯类耐药大肠埃希菌感染均是导致死亡率上升速度最快的病原菌[10]。2005-2019年分离的肺炎克雷伯菌对碳青霉烯类的耐药变迁结果显示,2005-2018年,肺炎克雷伯菌对碳青霉烯类的耐药率呈持续上升趋势,其对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%快速上升至2019年的25.3%和26.8%。虽然2019年肺炎克雷伯菌对碳青霉烯类的耐药率较2018年略有下降,但其耐药率仍居高位(图1)。本次监测结果显示,12 712株CRE中,占比高的前三位是肺炎克雷伯菌(72.4%,9 209/12 712)、大肠埃希菌(8.6%,1 088/12 712)和阴沟肠杆菌(6.2%,785/12 712);从病房分布看,主要来源于ICU、呼吸科和神经外科;标本主要分离于呼吸道、血
液和泌尿道。碳青霉烯类耐药鲍曼不动杆菌(CRAB)标本来源同样如此。基于碳青霉烯类耐药菌株的广泛耐药特征,常规药敏试验结果往往显示仅对替加环素(铜绿假单胞菌天然耐药)、多黏菌素和头孢他啶-阿维巴坦敏感,为应对此类广泛耐药细菌所致感染,实验室需要积极与临床沟通,开展多黏菌素、替加环素和头孢他啶-阿维巴坦的药敏试 验。
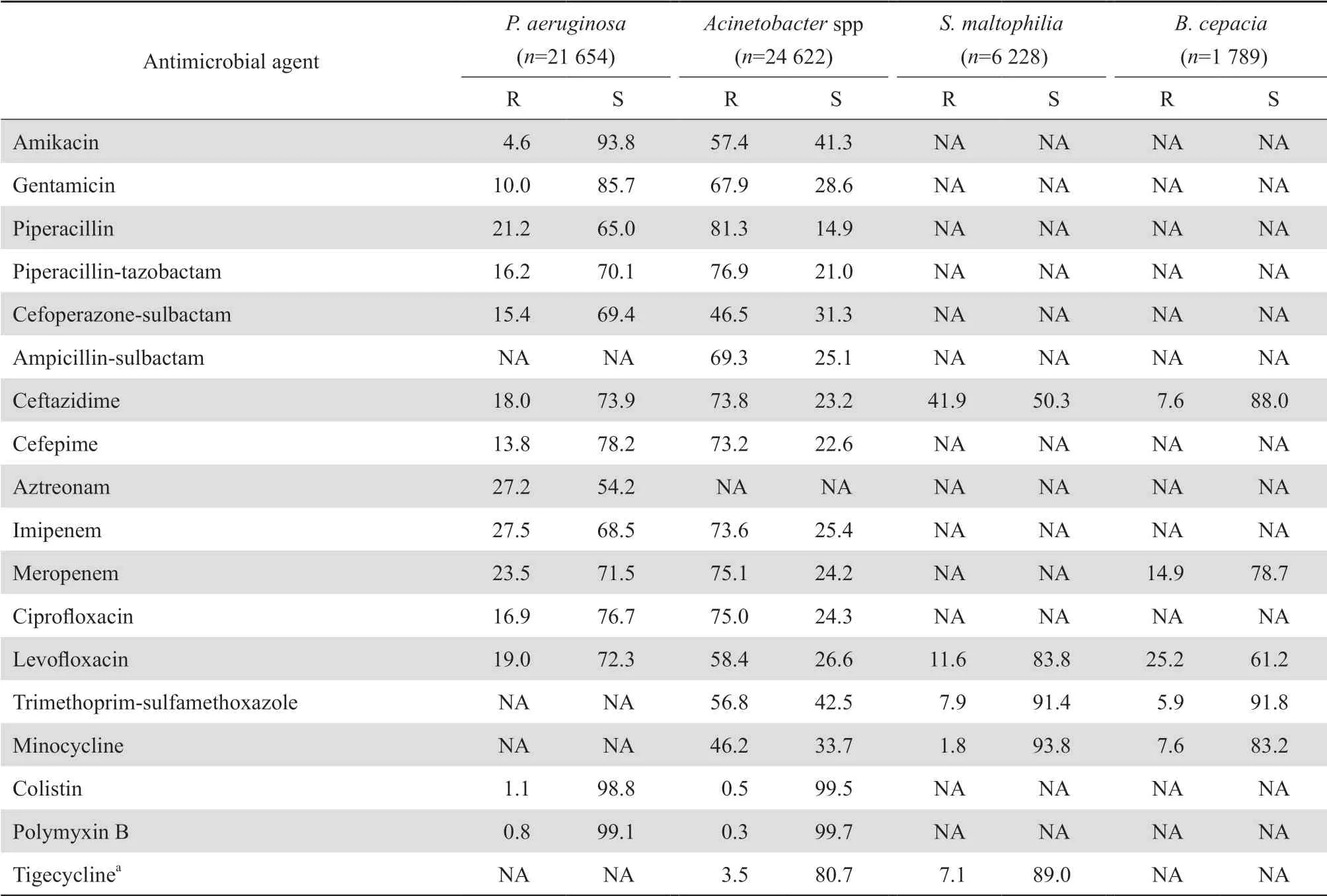
表10不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 10 Resistance and susceptibility rates of non-fermentative gram-negative bacilli to antimicrobial agents(%)
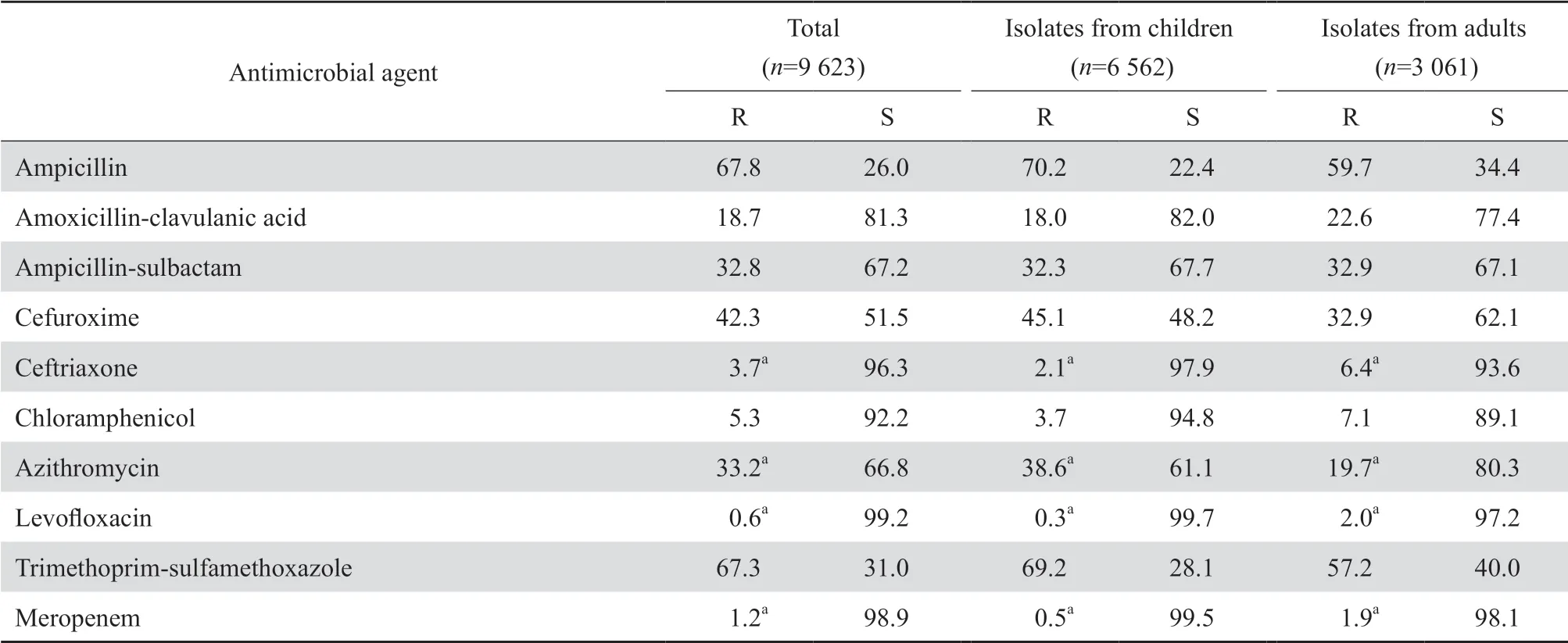
表11流感嗜血杆菌对抗菌药物的耐药率和敏感率Table 11 Resistance and susceptibility rates of H.influenzae to antimicrobial agents(%)
微生物实验室人员必须了解一些新型抗菌药物药敏试验的特殊性。如替加环素体外药敏结果受多种因素的影响,包括培养基的类型、配制时间、检测方法、菌种的类型、折点的选择等[11]。因此,实验室用纸片扩散法和自动化仪器测定替加环素敏感性时,若出现中度敏感或耐药结果时,需采用肉汤微量稀释法或含复敏液替加环素纸片法确认其敏感性。上海市细菌真菌耐药监测网联合8所医疗机构的多中心研究结果显示,与肉汤微量稀释法结果相比,含复敏液替加环素纸片法药敏结果检测替加环素的分类一致率为96.5%(372株碳青霉烯类耐药肺炎克雷伯菌)和91.0%(346株碳青霉烯类耐药鲍曼不动杆菌)。在进行多黏菌素类药物的药敏试验时需了解该类抗菌药物属于多肽类,分子量大,采用纸片法和琼脂稀释法均不利于黏菌素类分子在培养基介质中的扩散,因此CLSI和EUCAST工作组已共同发出呼吁:黏菌素类的药敏试验必须采用肉汤微量稀释法。同时工作组指出采用肉汤微量稀释法时不能用高分子材料(如吐温-80等)包埋过的U型底的96孔微孔板,否则会导致黏菌素被吸附致使培养基中游离黏菌素分子减少影响黏菌素的药效[12]。此外黏菌素和多黏菌素B两者为等效药物,根据黏菌素的MIC结果即可预报多黏菌素B的MIC结果[4],因此实验室在进行多黏菌素类药敏试验结果时,仅需测定其中一种药物即可。
碳青霉烯酶(包括KPC、NDM、OXA-48、VIM和IMP等)是肠杆菌科细菌对碳青霉烯类耐药最主要的耐药机制[13],不同患者提供的标本来源和不同碳青霉烯类耐药菌株所产的碳青霉烯酶有较大差异。研究结果显示,儿童患者分离的CRE菌株(包括肺炎克雷伯菌、大肠埃希菌和阴沟肠杆菌等)主要产生NDM型金属酶;成人患者分离的肺炎克雷伯菌主要产KPC型碳青霉烯酶。早年的研究中,大肠埃希菌主要产NDM型金属酶。近年来,碳青霉烯类耐药肺炎克雷伯菌中亦开始流行D类OXA-48型碳青霉烯酶。该家族包括OXA-181和OXA-232型碳青霉烯酶[14-15]。文献报道头孢他啶-阿维巴坦对产KPC或OXA-48型碳青霉烯酶菌株具有高度抗菌活性,但对产金属酶菌株的抗菌活性差[16]。因此,建议微生物实验室对于碳青霉烯类耐药菌株按CLSI建议的检测方法开展碳青霉烯酶耐药表型的检测;并同时进行头孢他啶-阿维巴坦药敏试验。如有可能,建议有条件的实验室还应开展联合药敏试验以筛选有效精准的治疗方案。如对于产KPC型碳青霉烯酶菌株可进行亚胺培南与克拉维酸的联合药敏试验[17]。除CLSI推荐的各种表型检测方法外,推荐采用酶抑制剂或免疫金标技术检测碳青霉烯酶[18]。前者如3-氨基苯硼酸和EDTA酶抑制剂,检测方法操作简单,结果容易阅读且成本低;其实验方法同常规纸片扩散法,可明确产A类丝氨酸碳青霉烯酶、B类金属酶以及同时产A类和B类碳青霉烯酶的菌株[19]。后者免疫金标技术则可在短短的20 min内快速检测并进一步对碳青霉烯类耐药菌株所产生的各种碳青霉烯酶进行分型,包括KPC、NDM、IMP、VIM、OXA-48型碳青霉烯酶等[20-21],是临床微生物实验室用于碳青霉烯酶检测的另一种重要选择。
纵观2019年全国36所CHINET三级医院临床分离菌的分布特征和对测试抗菌药物的耐药性监测,我国临床分离菌中甲氧西林耐药菌(MRSA、MRSE和MRCNS)、万古霉素耐药肠球菌、青霉素不敏感的肺炎链球菌、产ESBL肠杆菌科细菌、氟喹诺酮类耐药大肠埃希菌、碳青霉烯类耐药革兰阴性杆菌等多年来仍有较高的检出率,这些细菌对常用抗菌药物的耐药率亦仍呈增长趋势,这些问题仍然是今后细菌耐药监测中的主要任务和需密切关注的问题。
