昆虫气味结合蛋白的研究进展
2020-05-22杜亚丽赵慧婷刘玉玲牛庆生姜玉锁
杜亚丽, 徐 凯, 赵慧婷, 刘玉玲, 牛庆生,*, 姜玉锁,*
(1. 山西农业大学动物科技学院, 山西太谷 030801; 2. 吉林省养蜂科学研究所, 吉林吉林 132108;3. 山西农业大学生命科学学院, 山西太谷 030801)
众所周知,昆虫通过嗅觉来感知外界环境中各种气味物质,如信息素、花香物质和动物体表挥发物,从而来确定食物来源、选择产卵场地、寻找同伴、配偶和合适的寄主、躲避捕食者等(Breer, 2003; Fanetal., 2011; Huaetal., 2012)。识别并解析外界环境中的化学信号是维持昆虫生命的重要机制。在嗅觉信号转导启动之前,外界的疏水性分子必须渗入嗅觉感器(位于触角上的微小的毛状多孔表皮结构)内,穿过亲水性的感器淋巴液到达感觉神经元后刺激树突膜表面特定的嗅觉受体(olfactory receptors, ORs)(Britoetal., 2016)。在这个过程中,由专门的辅助细胞合成并被分泌到感器淋巴器中高浓度分布的气味结合蛋白(odorant binding proteins, OBPs)发挥着关键作用(Leal, 2013; 张玉等, 2019)。尽管在分子水平上对嗅觉机制尚未完全了解,但许多研究表明该类蛋白参与化学通讯过程,是最先参与嗅觉识别的嗅觉相关蛋白。OBPs具有多种生物学功能,其中研究得最多的是保护气味分子免受气味降解酶(odorant-degrading enzymes, ODEs)降解以及转运疏水性化学物质通过感器淋巴液到达嗅觉受体的作用(Pelosietal., 2018a)。
1 昆虫的外周嗅觉系统
昆虫对气味分子的识别过程非常复杂,可以分为两个系统:(1)外周嗅觉系统:对气味分子进行结合和转运,将化学信号转变为电生理信号并进行传导;(2)中枢神经系统:通过轴突传导至昆虫中枢神经系统,进而引发昆虫对气味分子作出识别反应(杜立啸等, 2016)。其中,昆虫外周嗅觉系统涉及多种蛋白,主要包括气味结合蛋白(OBPs)、嗅觉受体(ORs)、离子型受体(ionotropic receptors, IRs)、感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)、化学感受蛋白(chemosensory proteins, CSPs)和气味降解酶(ODEs)等(莫建初等, 2019)。
OBPs是一类可溶性蛋白,主要负责外部环境与ORs之间的连接(Liu Wetal., 2018)。外界环境中的气味分子一旦渗入触角表面的感器微孔,就会被OBPs结合从而增加其在感器淋巴液中的可溶性;气味分子-OBP复合物穿过感器淋巴液到达感器树突,激活树突膜上表达的ORs,引起嗅觉神经元的兴奋(Britoetal., 2016)(图1)。编码OBPs的基因数目因昆虫种类不同差异很大,有的物种含有几个,有的甚至高达上百个(Gongetal., 2014; Guetal., 2015; Zhouetal., 2015; Paulaetal., 2016; Heetal., 2017; Kimetal., 2017; Qiuetal., 2018; Quetal., 2019)。昆虫OBP家族还包括特异结合和转运信息素到信息素受体(pheromone receptors, PRs)的信息素结合蛋白(pheromone binding proteins, PBPs)(Dongetal., 2017; Yuetal., 2018)。关于OBPs的作用模式,目前有两种假设:(1)对蛾类和蚊类的研究表明,OBPs起被动载体的作用,且配体可以单独激活相应的ORs(Dambergeretal., 2007);(2)在某些情况下,OBPs似乎发挥更直接的作用,只有形成特定的OBP-配体复合物才能激活受体(Ronderos and Smith, 2010)。

图1 昆虫嗅觉过程的示意图(改自Brito et al., 2016)Fig. 1 Schematic view of the odorant perception process in insects (adapted from Brito et al., 2016)
CSPs是从多个目的昆虫中鉴定发现的另一类可溶性小蛋白。与OBPs相比,CSPs的分子量更小,组织分布更广泛,可以结合多种化学物质(Zhouetal., 2013)。免疫细胞化学定位研究表明,在嗅觉感受器淋巴液中的CSPs主要参与昆虫的化学信号传导,如红火蚁SolenopsisinvictaSinvCSP1在触角中高表达,在巢内同伴信号的识别过程中发挥重要作用(Gonzálezetal., 2009)。然而,一些在非嗅觉器官中表达的CSPs可能行使其他不同的生理功能(Ozakietal., 2008)。RNAi介导西方蜜蜂ApismelliferaAmelCSP5沉默后,胚胎形态异常,表明该基因参与蜜蜂胚胎表皮的形成(Maleszkaetal., 2007);斜纹夜蛾SpodopteralituraSlitCSP3,SlitCSP8和SlitCSP11在中肠中高表达,与寄主植物的选择有关(Yietal., 2017);东亚飞蝗LocustamigratoriaLmigCSP-II在成虫翅膀上的毛形感器中表达,可能参与接触性化学感受过程(Zhou SHetal., 2008);红火蚁4龄幼虫中高表达的SinvCSP9调控蜕皮过程(Chengetal., 2015)。
与可溶性的OBPs和CSPs相比,SNMPs基因编码的是一类跨膜蛋白,属于CD36蛋白家族的一个亚家族,在昆虫性信息素的化学通信中发挥作用(Pregitzeretal., 2014)。研究表明,黑腹果蝇DrosophilamelanogasterDmelSNMP1是T1感器检测性信息素Z11-18OAc(简称cVA)的必需蛋白(Bentonetal., 2007; Jinetal., 2008),而二化螟ChilosuppressalisCsupSNMP1也与触角中检测性信息素的神经元紧密相关(Liuetal., 2013)。
嗅觉受体(ORs)蛋白含有7个跨膜结构域,与脊椎动物GPCRs受体不同源(Benton, 2015)。昆虫ORs的膜拓扑结构与传统的GPCR相反,其N末端区位于细胞内(Bentonetal., 2006)。配体特异性ORs通常与高度保守的嗅觉受体共受体(odorant receptor co-receptor, Orco)以异源二聚体的形式组成一个配体门控离子通道,此结构可能与昆虫对外界气味物质及性信息素的识别和区分有关(Vosshall and Hansson, 2011)。气味分子可以特异性地结合ORs,因此Orco不直接参与气味识别(Guidobaldietal., 2014)。
离子受体(IRs)虽与离子型谷氨酸受体有关,但这两个家族在结构上差异较大,因为昆虫IRs没有谷氨酸结合位点(Knechtetal., 2016; Yuvarajetal., 2018)。IRs仅在不表达ORs或Orco的感觉神经元中表达,且与共受体共表达。目前尚未在异源表达系统中研究IRs的功能特性,但对其定位和结构特征分析表明IRs在配体诱导的离子通道过程中发挥主要作用(Bentonetal., 2009)。
对于以气味为导向的昆虫来说,嗅觉系统动力学要求在毫秒级的时间内迅速灭活杂散的气味分子(Szyszkaetal., 2014)。关于信号终止目前有两种假设:第1种假说为气味降解酶(ODEs)参与的配体降解,其速度非常快,可快速终止信号(Ishida and Leal, 2005);第2种假说认为存在一种尚不清楚的负责信号终止的“清道夫”(Kaissling, 2009)。
2 昆虫OBPs的一般特性及分类
昆虫OBPs是一类水溶性的小分子蛋白(13~17 kD),一般由130~150个氨基酸组成,呈酸性(Ahmedetal., 2017)。但有研究表明,双翅目的埃及伊蚊Aedesaegypti和半翅目的长红猎蝽Rhodniusprolixus基因组中发现的候选OBPs具有更广范围的等电点(pI)(Zhou JJetal., 2008; Mesquitaetal., 2015)。根据一级结构中氨基酸残基的数量,OBPs可分为长链OBPs(约160个氨基酸)、中链OBPs(约120个氨基酸)和短链OBPs(约100个氨基酸)。OBPs的氨基酸序列差异很大,同一物种OBPs间的氨基酸同源性可能低于10%,但通常含有6个位置相对保守的半胱氨酸(Cys)(张治科等, 2017)。实验证明,6个Cys形成了3个连锁的二硫键,其排列方式有助于蛋白质三维结构的稳定性,是昆虫OBPs的一个保守特征。这种Cys模式已经成为昆虫OBPs的“典型特征”(Pelosietal., 2014)。虽然脊椎动物中也发现了OBPs的存在,但这些蛋白属于脂质运载蛋白家族,Cys在蛋白稳定性方面并未起到关键作用(Bianchietal., 2019)。
根据功能和氨基酸序列的同源性,鳞翅目OBPs最初被细分为5类:信息素结合蛋白PBPs,I型普通气味结合蛋白(type 1 general odorant binding proteins, GOBP1s),II型普通气味结合蛋白(type 2 general odorant binding proteins, GOBP2s),I型触角结合蛋白(type 1 antennal binding proteins, ABP1s)和II型触角结合蛋白(type 2 antennal binding proteins, ABP2s)(Gong DPetal., 2009)。然而,这种分类并不适用于其他昆虫。根据保守Cys的模式,OBPs分为Classical OBPs, Minus-C OBPs, Plus-C OBPs, Dimer OBPs和Atypical OBPs。所谓的Classical OBPs氨基酸序列中含有6个保守Cys位点,而Minus-C OBPs只有4个或5个(Britoetal., 2016)。西方蜜蜂AmelOBP14是第一个确定晶体结构的Minus-C OBPs,仅含有2个二硫键(Spinellietal., 2012)。Plus-C OBPs至少含有2~3个额外的Cys,且在第6个Cys之后有1个保守的脯氨酸位点(Liu NYetal., 2018),如烟粉虱BemisiatabaciBtabOBP2就含有9个保守的Cys(谢红艳等, 2017)。Dimer OBPs是由2个典型的Cys基序聚合在一起形成的(Campanini and de Brito, 2016; Zengetal., 2019)。Atypical OBPs的N端区域比较典型,C端区域较长且特征不明显(Manoharanetal., 2013)。从冈比亚按蚊Anophelesgambiae中鉴定的Atypical OBPs实际上含有2个与Classical OBPs相同的结构域,因此又称为“two-domain OBPs”,但本质上还是属于dimer OBPs亚家族(Vieira and Rozas, 2011)。
3 昆虫OBPs在嗅觉感受系统中的作用
Vogt和Riddiford(1981)利用同位素标记法,在对鳞翅目多音天蚕蛾Antheraeapolyphemus雄虫的触角研究中发现并鉴定了首个PBPs,其能够结合雌虫分泌的性信息素。随后,Breer等(1990)在雌性柞蚕Antheraeapernyi触角中发现了一类可以结合并转运普通气味分子的GOBPs。生物化学结合动力学研究还发现,OBPs具有运载和灭活气味物质的双重作用(Vogtetal., 1991; Ziegelberger, 1995)。一项对黑腹果蝇突变体的研究表明OBPs参与气味分子向ORs的转运过程(Kimetal., 1998)。之后,对豌豆蚜AcyrthosiphonpisumApisOBP3(Qiaoetal., 2009)、梨小食心虫GrapholitamolestaGmolGOBP2(Lietal., 2016)、淡足侧沟茧蜂MicroplitispallidipesMpalOBP8(杨安, 2018)等的研究证明,OBPs能够特异性地识别和筛选特定的化学信号,而不只是被动运输。对果蝇突变体(Swarupetal., 2011)和蚜虫(Sun YFetal., 2012)的采集和交配行为分析也表明OBPs确实参与了化学物质的选择过程。此外,OBPs还可以提高嗅觉系统的敏感性(Vidicetal., 2008; Forstneretal., 2009)。家蚕BmorOR1(蚕蛾性诱醇bombykol受体)和BmorPBP1在黑腹果蝇的神经元细胞中共表达时,细胞对bombykol的敏感性显著高于单独表达BmorOR1时的敏感性(Syedetal., 2010)。类似地,二化螟C.supressalisPBPs与PRs共存时,PRs对信息素的敏感性可提高4个数量级(Changetal., 2015)。近几年的基因敲除、RNA干扰和电生理学等研究更是直接证明了OBPs是嗅觉系统正常运作必不可少的蛋白(Jiaetal., 2015; Pechlaner and Oostenbrink, 2015; Chenetal., 2018; Huetal., 2019)。
大量研究表明,OBPs在昆虫嗅觉系统中发挥着多种重要功能,主要包括:(1)特异性地识别并结合外界环境中不同结构的气味分子,过滤掉那些不需要的或有毒有害物质;(2)运输疏水性的气味分子穿过水溶性的感器淋巴液到达嗅觉神经元树突膜上的受体蛋白,调节其对气味物质的反应强度;(3)保护气味分子免受气味降解酶的降解;(4)在气味分子刺激受体后迅速地使其失活,避免持续刺激导致嗅觉神经元过度兴奋;(5)清除感器淋巴液中不需要的或有毒的物质(Fanetal., 2011; 张玉等, 2019)。
4 昆虫OBPs在非嗅觉组织中的生理功能
研究表明,行使嗅觉功能的大部分昆虫OBPs基因均在触角中特异性高表达,如嘴壶夜蛾OraesiaemarginataOemaPBP1(Fengetal., 2017)、红棕象甲RhynchophorusferrugineusRferOBP1768(Antonyetal., 2018)和玉米象SitophituszeamaisSzeaOBP35-36(Tangetal., 2019)。但随着OBPs基因家族成员的增加,人们发现并非所有OBPs只表达和分布于触角中,在口器、足、中肠、腺体等非嗅觉器官中同样有广泛的表达,暗示它们可能还参与除嗅觉感知以外的其他不同的生理功能。黑花蝇Phormiaregina口器中高表达的PregOBP56a对膳食脂肪酸具有增溶作用(Ishidaetal., 2013);埃及伊蚊卵巢中高表达的AaegOBP45可能参与卵膜的形成(Costa-da-Silvaetal., 2013);中华蜜蜂Apisceranacerana足中特异性高表达的AcerOBP15在采集花蜜和花粉时参与味觉识别过程(Duetal., 2019);黑须库蚊Culexnigripalpus(Smartt and Erickson, 2009)和长红锥蝽Rhodniusprolixus(Ribeiroetal., 2014)的肠道中发现的OBPs可能与营养物质或参与肠道功能的其他小分子物质的转运有关;棉铃虫HelicoverpaarmigeraHarmOBP10(Sun YLetal., 2012)和西方蜜蜂AmelOBP21(Lietal., 2013)在合成信息素的腺体中表达,参与化学信息素的合成、储存与释放过程;PxylOBP13有助于增强小菜蛾Plutellaxylostella对菊酯类杀虫剂的抗性(Bautistaetal., 2015)。此外,吸血昆虫的OBPs还具有一定的抗炎作用,可作为生物学标记来检测蚊和白蛉等引起的流行病(Pelosietal., 2018a)。
昆虫基因组预测获得的OBPs不一定都是嗅觉相关蛋白。例如,黑腹果蝇基因组中共有51个OBPs,但只有7个在成虫的嗅觉器官中特异性表达(Galindo and Smith, 2001)。家蚕基因组包含44个编码OBPs的基因,但目前只鉴定出1个PBP和多个GOBPs(Danietal., 2011)。冈比亚按蚊基因组中鉴定获得66个OBPs,大多数OBPs除嗅觉器官之外也能在非嗅觉器官中表达(Amenyaetal., 2010)。OBPs家族中的嗅觉蛋白和非嗅觉蛋白具有相同的结构特性,富含螺旋结构。这些蛋白能将疏水性气味物质和其他配体包裹在形成的空腔内,从而具有转运挥发性物质穿过水溶性环境的能力。因此,这种稳定的蛋白质可表达于各种需要在水相中转运疏水分子的组织中,保护化学物质免于降解,确保化学物质缓慢向环境中释放(Britoetal., 2016)。鉴于此,有学者认为应该将这些蛋白命名为“胶囊”,以暗示其具有结合并转运配体的一般作用(Leal, 2006)。
5 昆虫OBPs的三维结构及其作用机理
研究蛋白功能最基础的就是要搞清楚蛋白质及其复合物的三维结构,从而在分子水平上进行功能研究来阐明其本质。目前蛋白质三维结构的测定主要有三大技术:X-射线晶体学、核磁共振(NMR)和冷冻电镜三维重构技术,而昆虫OBPs的三维结构大多是利用前两种方法进行解析的。自Sander等(2000)首次采用X-射线晶体学获得BmorPBP1-bombykol的晶体结构(pH 8.2)以来,已对鳞翅目、双翅目、膜翅目、直翅目、半翅目、脉翅目、蜚蠊目等多种昆虫OBPs的单体或复合结构进行了解析(表1)。昆虫OBPs通常由6个α-螺旋结构域组成,由3个二硫键两两连接,折叠形成非常紧密和稳定的疏水性结合腔,在一定程度上增加了OBPs结构的稳定性(胡颖颖等, 2013)。这与脊椎动物折叠方式完全不同,其典型结构为8个反平行的β-折叠和1个短的α-螺旋(紧靠C端)(Floweretal., 2000; Ramonietal., 2007)。
昆虫OBPs的构象变化具有pH依赖性(Leeetal., 2002; Xuetal., 2010; Tianetal., 2016)。BmorPBP1的6个α-螺旋由3个二硫键连接,以锥形排列方式形成一个紧密结构(Sandleretal., 2000)。BmorPBP1的C端区域主要由非极性氨基酸组成,但位于螺旋表面的Asp132, Glu137和Glu141为酸性氨基酸。在酸性pH下,Asp132(或脐橙螟AtraPBP1的Glu132)和Glu141与质子化的组氨酸残基His形成盐桥,促进C端第7个α-螺旋形成并占据结合腔引起配体释放,该机制又被称为组氨酸质子化作用开关,是OBPs向ORs传递信息素的活性机制(Xu and Leal, 2008; Xuetal., 2010)。中性pH时,去质子化的His使盐桥破裂,导致第7个螺旋从结合腔向外排出,使蛋白核心中的疏水性残基暴露,与信息素相互作用并结合(Xu and Leal, 2008)。这种现象并非所有鳞翅目PBPs所共有。多音天蚕蛾ApolPBP1的α3中间存在一个扭结,使Asn53的侧链成为信息素结合腔的一部分,中性pH时一般不结合配体。酸性pH下组氨酸发生质子化,Asn53远离蛋白核心,引起α1, α3和α4重新定向,结合腔打开释放出配体(Zubkovetal., 2005; Gongetal., 2010)。此外,对舞毒蛾LymantriadisparLdisPBPs的配体反应动力学的研究发现,LdisPBP2首先与配体通过扩散控制碰撞形成中间复合物,然后配体从外部结合位点重新定位到不同的内部结合位点,从而产生更稳定的配体-OBP复合物,为鳞翅目OBPs配体结合的另一机制的存在提供了依据(Gong Yetal., 2009)。

表1 已解析三维结构的气味结合蛋白Table 1 Odorant binding proteins with three-dimensional structures resolved
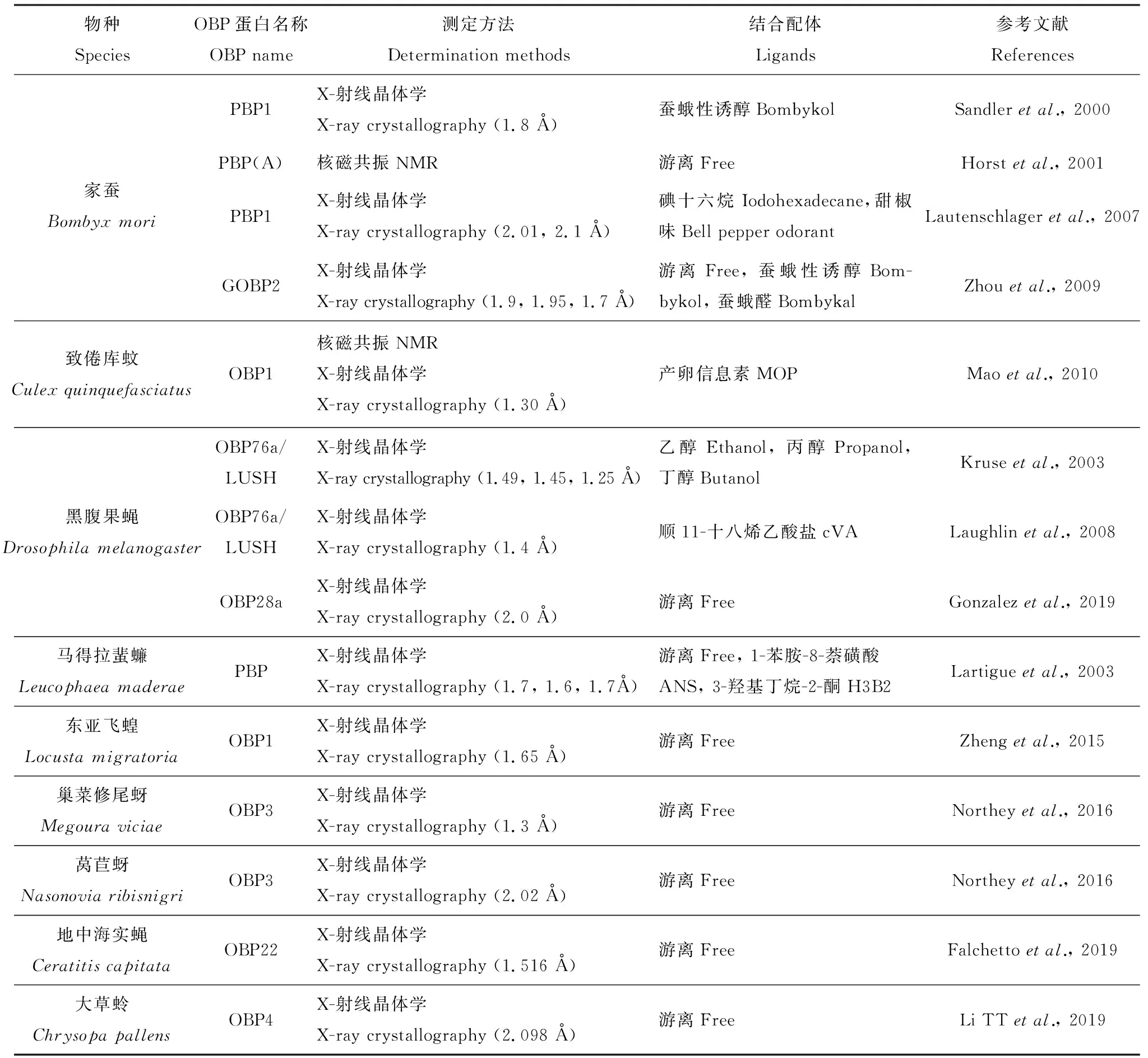
续表1 Table 1 continued
QMP: 蜂王上颚腺信息素Queen’s mandibular gland pheromone. 括号中文字表示X射线衍射的光波长。The text in brackets indicates the optical wavelength of X-ray diffraction.
与鳞翅目不同,大多数双翅目OBPs的C端区域较短,如同结合腔上的“盖子”,不能形成占据配体结合腔的新螺旋。比如,冈比亚按蚊AgamOBP1、埃及伊蚊AaegOBP1和致倦库蚊CquiOBP1的pH依赖性构象变化与结合亲和力的丧失相关(Wogulisetal., 2006; Leiteetal., 2009; Maoetal., 2010)。这个“盖子”是由3个对pH变化极其敏感的保守氢键在适当的位置形成的。此外,这些OBPs的C末端只有最后1个氨基酸存在差异,如AgamOBP1和CquiOBP1的Val125、AaegOBP1的Ile125,其羧酸氧基分别与Tyr54的羟基、His23的δ-氮基和Arg23形成氢键。当OBP-气味分子复合物到达树突膜附近的时候,局部pH降低,羧酸盐质子化使氢键被破坏,导致C末端远离结合腔,从而“打开盖子”并促进配体释放(Leiteetal., 2009; Maoetal., 2010)。
西方蜜蜂AmelASP1的配体亲和力虽呈pH依赖性,但作用方式与鳞翅目和双翅目OBPs正好相反。pH 4.0时,AmelASP1与蜂王信息素的主要成分9-ODA具有很高的结合亲和力,而pH 7.0时,ASP1疏松的C末端可以与另一个ASP1分子的N末端聚合形成结构域二聚体,其配体亲和力比酸性pH时低10倍。(Pesentietal., 2008)。该二聚化反应可能与Asp35密切相关,因此突变体Asp35Asn和Aps35Ala在不同pH条件下的单体结构完全相同(Pesentietal., 2009)。
虽然在NCBI GenBank中注册的半翅目昆虫OBPs已达到300多个,但直到最近才解析了蚜虫OBPs的晶体结构(Northeyetal., 2016)。巢菜修尾蚜Megouraviciae和莴苣蚜NasonoviaribisnigriOBP3的结构与Classical OBPs相似:6个保守的Cys形成3个二硫键,6个螺旋由延伸的环状结构连接。但这2个蛋白表面都有一个结合凹槽,主要由N端区域和部分螺旋α1和α2形成,没有明显的内部结合腔(Northeyetal., 2016)。分子动力学表明,两蛋白的Tyr30与配体间的互作及其结合前后的取向在配体结合过程中起关键作用,但这两个蛋白的特殊结构特征还需进一步评估,以充分阐明其在报警信息素感知过程中的作用。
6 昆虫OBPs的配体结合特性和激活ORs的作用模式
6.1 昆虫OBPs结合特性的研究方法
在早期的PBPs结合特性研究中,经氚及放射性标记的信息素常被用于定性结合分析(Plettneretal., 2000)。随着重组蛋白的可用性,Leal等(2005a)制定了一种不需放射性配体的“冷冻结合分析法”,能够在单一实验中从有机混合物中鉴定出OBPs的最佳配体。目前,荧光竞争结合实验是研究OBPs与候选配体结合特性最常用的方法,可通过比较OBPs与生理相关化合物的结合亲和力,评估它们优先转运某些配体的能力(Zhuangetal., 2013)。但该方法有一定的局限性,需要一种与目标蛋白质具有一定亲和力的荧光探针,比如1-氨基蒽(AMA)(Campanaccietal., 2001)、1-苯胺-8-萘磺酸(ANS)(Wojtasek and Leal, 1999; Lartigueetal., 2003)和N-苯基-1-萘胺(1-NPN)(Pelosietal., 2018c)。在找不到合适荧光探针的情况下,通过测定色氨酸的固有荧光以监控配体结合特性也是可行的(Lealetal., 2005a)。例如,对ApolPBP1与其信息素混合物组分(E6,Z11)-六癸二醛、(E6,Z11)-六癸二烯基-1-乙酸盐和(E4,Z9)-四癸二烯基-1-乙酸盐之间的固有荧光变化进行观察,发现ApolPBP1存在3种不同类型的配体结合模式(Betteetal., 2002)。
OBPs与不同配体之间的结合势也可以通过分子对接和分子动力学等电脑模拟进行估算(Venthuretal., 2014)。对金龟子甲虫HylamorphaelegansOBPs和矮假山毛榉Nothofagusobliqua挥发物的模拟分析表明,HeleOBPs与倍半萜烯类化合物有较高的互作能值,且疏水氨基酸主要参与这些互作(González-Gonzálezetal., 2016)。Song等(2018)也使用此方法评估了AcerOBP11与小分子物质之间的亲和力,发现Ile97, Ile140和Phe101是该蛋白的关键结合位点。
6.2 昆虫OBPs的配体结合特性
OBPs是昆虫体内多种疏水性物质的有效载体,与小分子有机化合物的结合力是OBPs生理功能研究的必要依据。PBPs(至少对鳞翅目昆虫来说)对信息素具有很强的结合特异性,比如BmorPBP1只能特异性识别bombykol(Sandleretal., 2000)。但也有证据表明,除了性信息素组分及其类似物外,PBPs还可以与普通气味物质结合(Jinetal., 2014; Jiaetal., 2015; Songetal., 2018)。相对于PBPs来说,GOBPs具有相当广泛的配体亲和特性,能够结合多种不同种类的气味物质,除结合宿主植物挥发物以外,部分还偏好性地结合特定的性信息素组分(Heetal., 2010; 陈东凯等, 2018; Jingetal., 2019)。例如,梨小食心虫GmolGOBP1对寄主植物挥发物和性信息素成分存在双重识别功能,而GmolGOBP2主要参与对十二烷醇(一种次要性信息素)的感知(Lietal., 2016);LstiGOBP2对植物挥发物(E)-2-己烯醛、(Z)-3-exen-1-ol和信息素组分(E)-11-十四烯-1-基乙酸盐均有很高的亲和力(Yinetal., 2012);中红侧沟茧蜂MicroplitismediatorMmedOBP18除与16种植物挥发物结合,还与性信息素组分(Z)-9-十四碳烯醛和(Z)-11-十六碳醛有较强的结合(宋玄等, 2019)。此外,OBPs还可以与非挥发性代谢物相结合。果蝇DmelOBP49a能够直接与苦味物质结合,并将其转运到味觉受体上(Jeongetal., 2013);苜蓿盲蝽Adelphocorislineolatus和三点盲蝽Adelphocorisfasciaticollis口器中高度表达的OBP11可以优先结合寄主植物的非挥发性次生代谢物,在味觉感受系统中发挥重要作用(Sunetal., 2016; Li ZBetal., 2019);黑花蝇唾液中的脂肪酶可将体内的甘油三酯水解为游离脂肪酸,这时对长链脂肪酸有高亲和力的PregOBP56a就会结合并将其转运至肠道(Ishidaetal., 2013)
6.3 OBPs激活ORs的作用模式
迄今为止,ORs的激活机制提出两个作用模型:第1个模型表明气味物质本身单独激活了受体,而第2个模型支持ORs被特定的OBP-气味复合物激活的观点。上述关于蛾类和蚊类的研究支持第一种假设,即气味分子被包裹在OBPs的结合腔中,协助其通过感器淋巴液,从而避免被ODEs降解;当复合物到达神经元树突区域时,OBPs-配体复合物在较低的pH下快速分离,配体以独立的方式激活ORs(Horstetal., 2001)。有研究表明,在OBPs缺失的情况下,ORs可以被其特定配体激活,与该模型完全一致(Nakagawaetal., 2005)。
然而,黑腹果蝇的气味结合蛋白LUSH的信号转导方式与第一种假设完全相反(Xuetal., 2005)。Lush缺陷突变体的研究表明,LUSH蛋白对于典型的cVA-诱导行为和T1神经元的正常敏感性是必要的(Stowers and Logan, 2008)。结构研究指出,LUSH不是cVA的被动载体,其构象变化主要通过OR67d和SNMP介导激活T1神经元,而LUSH从静息状态的非活性形式转化为能够触发T1神经元激活的活性构象正是由cVA刺激引起的(Jinetal., 2008; Laughlinetal., 2008)。这些结果与OBP-气味复合物激活ORs的模型相一致。也有学者对上述模型提出质疑,他们认为cVA可以在没有LUSH蛋白的情况下激活神经元,但不能没有SNMP或OR67d(Gomez-Diazetal., 2013)。
7 昆虫OBPs的应用现状
明确候选化合物与嗅觉相关蛋白的分子互作,有利于研制新的昆虫引诱剂或驱虫剂,对于制定能够干扰嗅觉介导行为反应的传播媒介控制新策略至关重要。由于气味分子在没有OBPs的情况下不能到达ORs,因此功能性OBPs可以作为筛选昆虫引诱剂或驱虫剂的分子靶点,其方法类似于“反向化学生态学”。此外,与ORs相比,OBPs具有分子量小、可溶性强、稳定性好、易于操作和修饰等优点,是更容易体外获得的研究对象。反向化学生态学方法依据化合物与嗅觉蛋白的结合亲和力,从而减少了气味候选化合物的数量,与在该领域常用的传统试错筛选法相比,节省时间并降低研究成本。该策略首次成功应用于脐橙螟引诱剂的研制(Lealetal., 2005b)。之后Leal(2013)以CquiOBP1为结合靶点,结合反向和常规化学生态学方法来鉴定非天然配体,该研究促进了商品化的致倦库蚊产卵引诱剂的研发。
目前,主要通过电脑模拟方法对“反向化学生态学”进行改进,以减少候选化合物的数量和加速新化学物质发现,具体方法为:先采用电脑模拟方法进行筛选,随后通过荧光光谱法、量热法、核磁共振或者测量结合配体的数量等不同方法来体外评估OBPs和预选配体之间的结合亲和力。最后,通过生物测定和田间试验验证昆虫对最佳配体的行为反应(Jayanthietal., 2014)。鉴于此,阎伟等(2017)结合同源建模和分子对接方法筛选潜在的活性挥发物用于防控锈色棕榈象Rhynchophorusferrugineus。
昆虫OBPs除了作为开发昆虫种群管理新产品的分子靶点之外,还在其他技术目的领域方面有一定的应用。OBPs对小分子有机物质具有亲和力和特异性。基于此,有学者合成了由家蚕BmorPBP1和致倦库蚊CquiOBP1衍生的亲和色谱柱(Margaryanetal., 2006)。同时,OBPs对酸碱、高温的耐受性高,也可作为一种生物敏感材料,通过模拟生物嗅觉来检测复杂环境中的不同化学物质(卢妍利, 2017; Pelosietal., 2018b)。Larisika等(2015)就设计了一种基于还原石墨烯氧化物晶体管的嗅觉生物传感器,该晶体管与AmelOBP14共同发挥作用,能够实时监测环境中的各种气味。类似地,桔小实蝇OBPs也被用于高阻抗嗅觉传感器来检测寄主植物挥发物(Luetal., 2015)。近年来,根据完整OBPs的结合域合成有效长度的小分子肽段,为高选择性生物传感器的研发提供了新的仿生材料(Wasilewskietal., 2019)。此外,OBPs对热变性和蛋白降解的特殊稳定性使其可以作为活性色谱相,直接用于分辨信息素或其他天然化合物的外消旋混合物(Pelosietal., 2014)。
8 小结与展望
尽管近十年来昆虫嗅觉领域的研究取得了显著的进展,但对于昆虫嗅觉感知的进一步研究还很匮乏,仍然无法揭示OBPs参与化学感受的分子机制。OBPs如何向ORs释放气味, ORs如何被激活, OBPs在这些分子的特异性选择中是否发挥作用,以及不同OBPs之间是否存在相关性等等,这些问题仍然是昆虫嗅觉领域争论的焦点。已有研究发现,昆虫嗅觉相关蛋白的作用和作用机制似乎在朝着不同的方向发展,但考虑到昆虫种类繁多,这也是正常的。不过,OBPs可以作为气味和信息素的载体,使其免受降解并顺利通过感器淋巴液,仍然是最广泛接受的假说。深入开展OBPs的生理功能研究有助于进一步揭示昆虫的化学感受机制,为昆虫引诱剂或驱虫剂、生长发育调节剂的研制提供新思路。此外,通过计算机软件模拟筛选OBPs的最佳作用配体,正在成为化学生态学领域的一个非常重要的工具,该技术的发展将为昆虫行为监控,虫媒传播疾病预防以及进一步的害虫防治提供一种有效策略。
OBPs能够行使除嗅觉以外的其他生理功能,值得进一步验证与研究。这将意味着昆虫OBPs不仅可以作为嗅觉传感器的仿生材料,还可用于环境、食品质量监控及医疗设备等领域。另外,由于昆虫OBPs易于修饰和表达,在不改变OBPs结构的情况下通过定点突变技术来获得更加稳定、高选择性、高灵敏度的特定OBPs,为生化检测和疾病诊断提供新机遇。
