NaCl胁迫对黑籽南瓜生长和生理特性的影响
2020-05-21高婷张杰马瑞红
高婷 张杰 马瑞红


摘要:分别采用0、50、100、150 mmol/L NaCl溶液胁迫处理黑籽南瓜(Cucurbita ficifolia Bouché)幼苗,处理后8、18 d分别测定幼苗丙二醛(MDA)、可溶性糖含量及过氧化氢酶(CAT)活性,处理后18 d测定幼苗主根长、茎粗、叶形指数等生长指标。结果表明,随NaCl胁迫浓度的增加,黑籽南瓜幼苗叶片MDA含量、CAT活性呈先增后降趋势,幼苗主根长、茎粗呈降低趋势,其中主根长受盐胁迫的影响较大,下降较为明显;随NaCl胁迫浓度的增加,处理8 d时的黑籽南瓜幼苗叶片可溶性糖含量呈增加趋势,处理18 d时的可溶性糖含量、叶形指数相互间差异不显著(P>005)。黑籽南瓜幼苗具有一定的耐盐性,可选择作为黄瓜的耐盐性砧木。
关键词:黑籽南瓜;盐胁迫;NaCl;丙二醛;生理特性;可溶性糖;过氧化氢酶
中图分类号:S642.101 文献标志码: A 文章编号:1002-1302(2020)06-0122-03
土壤盐渍化是影响作物生长的主要因素之一,盐胁迫可通过渗透胁迫、离子毒害、营养失衡等引起植物体内生理生化发生改变[1],最直接的伤害是细胞膜损伤,进而抑制植株生长,降低果实产量。目前,为满足蔬菜市场需求,反季节栽培及大量肥料的盲目使用已导致土壤盐渍化加剧[2],而选育耐盐品种,研究耐盐机制变得尤为重要。
不同植物的耐盐性不同,蔬菜作物的耐盐性普遍较弱[3]。黑籽南瓜(Cucurbita ficifolia Bouché)为南瓜属1年生或多年生草本蔓性植物,对低温、盐胁迫等逆境有一定的抗性。有研究表明,以黑籽南瓜作为黄瓜砧木,能增强黄瓜对盐胁迫的抗性,降低盐害指数[4-7]。有关黑籽南瓜耐盐生理生化机制方面,朱进等研究发现,在盐胁迫下,黑籽南瓜丙二醛(MDA)含量增高,超氧化物歧化酶(SOD)、过氧化物酶(POD)活性增强[8];蔡雁平等研究发现,在盐胁迫状态下,黑籽南瓜发芽率几乎不受影响,SOD活性有所下降,但比黄瓜和嫁接苗来说下降程度小[9]。但周俊国等研究认为,以黑籽南瓜为砧木,NaCl胁迫不仅会降低嫁接黄瓜的产量,而且还影响其果实品质,果实畸形率升高,风味变差,果實维生素C、游离氨基酸、可溶性糖含量及果实含水量减少,而纤维素、可滴定酸含量升高[10]。本试验通过对云南黑籽南瓜幼苗采取不同浓度的NaCl胁迫,考察其对黑籽南瓜幼苗叶片MDA含量、可溶性糖含量、过氧化氢酶活性(CAT)及幼苗生长指标的影响,以助于对黑籽南瓜幼苗耐盐机制作进一步解析,为耐盐材料的筛选奠定基础。
1 材料与方法
1.1 供试材料
绿皮黑籽南瓜种子,由云南农业大学蔬菜基地提供。
1.2 试验处理
选取饱满的绿皮黑籽南瓜种子,10% H2O2浸泡1 h;流水冲洗5~6次,放入带滤纸的培养皿中,28 ℃暗培养至露白;移栽至装有灭过菌基质的盆钵中,待子叶展开,每天浇灌等量浓度分别为0、50、100、150 mmol/L的NaCl溶液,重复3次。
1.3 测定内容与方法
浇灌处理8、18 d时,分别采集幼苗第1片真叶,分别采用硫代巴比妥酸(TBA)法、蒽酮比色法、氧量法测定其丙二醛(MDA)含量、可溶性糖含量、过氧化氢酶活性(CAT)等生理指标[11]。同时,于处理18 d时采用直尺和游标卡尺测量幼苗主根长、茎粗、叶片大小等生长指标,计算叶形指数。
1.4 数据处理及统计分析
采用Excel 2010对试验数据计算和统计,采用DPS 6.55软件进行方差分析。
2 结果与分析
2.1 盐胁迫对黑籽南瓜幼苗叶片MDA含量的影响
由图1可见,随着盐浓度的升高,黑籽南瓜幼苗叶片MDA含量呈先增后减趋势,NaCl浓度为100 mmol/L时,MDA含量相对最高,显著高于NaCl浓度为0、50 mmol/L处理的(P<0.05),与150 mmol/L处理的差异不显著(P>0.05);对同一NaCl胁迫浓度而言,胁迫8 d时的MDA含量始终高于胁迫18 d的,说明随着苗龄的增加,黑籽南瓜幼苗耐盐性可能增强。
2.2 盐胁迫对黑籽南瓜幼苗叶片可溶性糖含量的影响
由图2可见,胁迫处理8 d时,NaCl浓度为50、100、150 mmol/L处理的黑籽南瓜幼苗叶片可溶性糖含量显著高于无盐胁迫状态(0 mmol/L NaCl)(P<0.05),但这几个浓度处理相互间差异不显著(P>0.05),说明短期盐胁迫可能促进叶片可溶性糖的积累,是植物对逆境胁迫的一种响应;胁迫处理18 d时,不同浓度盐胁迫处理的黑籽南瓜幼苗叶片可溶性糖含量相互间差异不显著,且均低于胁迫处理8 d时的可溶性糖含量,说明苗龄增大,黑籽南瓜幼苗的耐盐性增强。
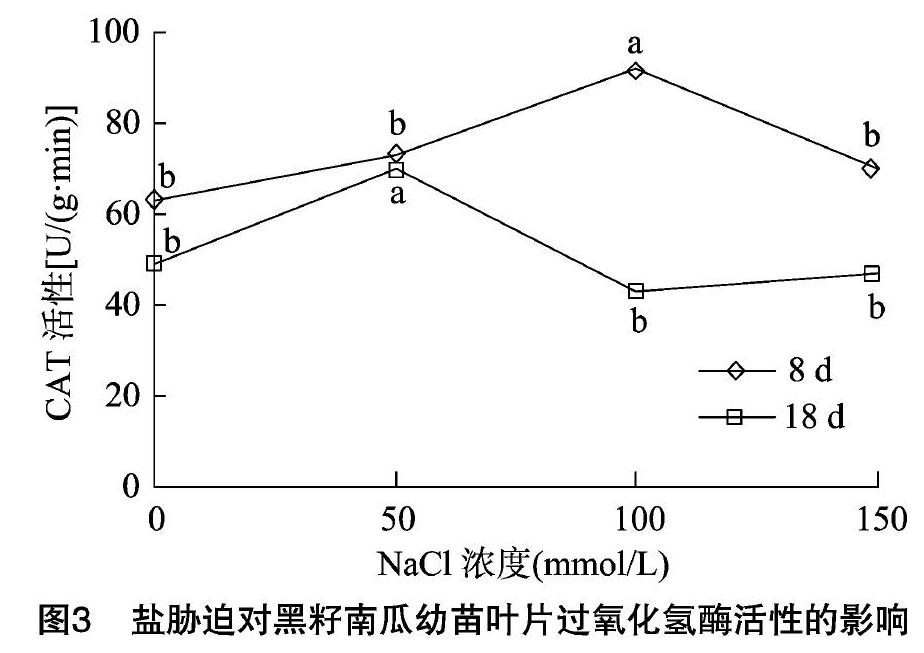
2.3 盐胁迫对黑籽南瓜幼苗叶片过氧化氢酶(CAT)活性的影响
由图3可见,随NaCl胁迫浓度的升高,黑籽南
瓜幼苗叶片过氧化氢酶活性呈先升后降趋势;胁迫处理8 d时,NaCl浓度为100 mmol/L处理的黑籽南瓜幼苗叶片过氧化氢酶活性相对最高,而此时MDA含量也相对最高,说明逆境胁迫下植物细胞膜脂过氧化会产生MDA,而为保持细胞内稳态,会相应产生CAT以清除多余的活性氧,当NaCl浓度达到 150 mmol/L 时,CAT活性较NaCl 100 mmol/L处理的有显著下降(P<0.05);胁迫处理18 d时,NaCl浓度为50 mmol/L处理的黑籽南瓜幼苗叶片过氧化氢酶活性相对最高,显著高于其他处理;对同一NaCl胁迫浓度而言,胁迫8 d时的CAT含量始终高于胁迫18 d的。
2.4 盐胁迫对黑籽南瓜幼苗生长指标的影响
由表1可见,随NaCl胁迫浓度的升高,黑籽南瓜幼苗茎粗、主根长呈降低趋势,其中主根长受盐胁迫的影响相对最大,减小趋势最为明顯,而叶形指数相互间差异不显著(P>0.05);NaCl胁迫浓度为150 mmol/L的黑籽南瓜幼苗茎粗显著低于无盐胁迫的(P<0.05)。试验过程中发现,在150 mmol/L NaCl胁迫下黑籽南瓜幼苗无植株死亡,说明150 mmol/L NaCl不是黑籽南瓜幼苗受盐胁迫的致死浓度。
3 结论与讨论
丙二醛(MDA)是膜脂过氧化的重要产物之一,在一定程度上MDA含量高低可表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱[12]。陈金龙对枸杞进行不同浓度的NaCl处理,结果表明,MDA含量与盐浓度成正比[13]。孙伟泽等研究表明,随盐浓度升高,苜蓿叶片中丙二醛含量呈逐渐上升趋势,并随胁迫时间的延伸,丙二醛含量逐渐下降,这说明随着时间推移,植株对盐胁迫产生适应性[14]。本试验中,NaCl胁迫处理8、18 d时,黑籽南瓜幼苗叶片MDA含量随盐浓度的升高呈先升后降趋势,而盐胁迫处理18 d的丙二醛含量均低于胁迫处理8 d的,说明黑籽南瓜幼苗对盐胁迫可能产生适应性,也有可能是由于黑籽南瓜幼苗苗龄增大,植株抵御不良环境的能力增强,这与Khoshgoftarmanesh等的研究结论[15]较为吻合。
可溶性糖是生物体内重要的细胞渗透调节物质,而过氧化氢酶(CAT)是植物保护酶之一,可通过清除逆境下膜脂氧化产生的活性氧来维持细胞内稳态。任贵军研究表明,在一定盐胁迫范围内,植物通过自身保护酶系统和渗透调节物质积累来有效降低活性氧的伤害[16]。Xiao等以互花米草为材料进行梯度盐胁迫处理发现,可溶性糖含量与胁迫盐浓度成正比,渗透调节物质是互花米草响应盐胁迫的关键因子,其含量变化可作为耐盐性的一个指标[17]。本试验结果表明,盐胁迫8 d时,黑籽南瓜幼苗叶片可溶性含量较清水处理有显著升高(P<0.05),而在盐胁迫18 d时相互间差异不显著(P>0.05),可能是苗龄较大的黑籽南瓜幼苗对NaCl耐性增强有关;随NaCl胁迫浓度的升高,黑籽南瓜幼苗叶片过氧化氢酶活性呈先升后降趋势,与贾漫丽等的研究结果[18]一致。
有研究表明,NaCl胁迫浓度为50 mmol/L时,可促进马齿苋、黄花菜等根的生长,之后随NaCl浓度的升高,根生长逐步受到抑制[19-20]。张凤银等研究不同菜豆品种对NaCl盐胁迫的响应时发现,高浓度盐溶液处理会降低菜豆幼苗的根长,低浓度处理对幼苗生长指标的影响与NaCl浓度、品种有关[21]。本研究结果表明,黑籽南瓜叶形指数受NaCl胁迫浓度的影响不大,而主根生长受到明显的抑制,随胁迫盐浓度的升高,黑籽南瓜幼苗主根长有明显减小。
综上可见,黑籽南瓜幼苗对盐胁迫具有一定的适应性,可选择作为黄瓜的耐盐性砧木,而其具体的抗盐机制还须进一步挖掘阐明。
参考文献:
[1]Gorham J,Wyn-Jones R G,McDonnell E. Some mechanism of salt tolerance in crop plants[J]. Plant and Soil,1985,89(1/2/3):15-40.
[2]王俊生. 蔬菜大棚土壤退化及其修复[J]. 河北农业,2018(8):28-29.
[3]Shannon M C,Grieve C M. Tolerance of vegetable crops to salinity[J]. Scientia Horticulturae,1998,78(1/2/3/4):5-38.
[4]田雪梅,魏 珉,刘 青,等. 不同抗性砧木嫁接黄瓜幼苗对NaCl胁迫的生理响应[J]. 应用生态学报,2012,23(1):147-153.
[5]张永平. 硝普钠对肉桂酸处理黄瓜和黑籽南瓜根生理特性的影响[J]. 西北农林科技大学学报(自然科学版),2019,47(2):1-6.
[6]Huang Y,Bie Z L,He S P,et al. Improving cucumber tolerance to major nutrients induced salinity by grafting onto Cucurbita ficifolia[J]. Environmental and Experimental Botany,2010,69(1):32-38.
[7]Zhou J G,Hu H L,Li X Z,et al. Effects of rootstock on fruit yield and quality of hydroponically cultivated grafted cucumber under NaCl stress[J]. Acta Horticulturae,2010(871):63-70.
[8]朱 进,别之龙. NaCl胁迫下温室内两个砧木的生理响应机制[J]. 农业工程学报,2008,24(8):227-231.
[9]蔡雁平,袁祖华,孙小武. 盐胁迫下嫁接黄瓜和自根黄瓜幼苗的保护酶活性变化[J]. 湖南农业大学学报(自然科学版),2008,34(5):554-556.
[10]周俊国,扈惠灵. NaCl胁迫对不同砧木的嫁接黄瓜产量和品质的影响[J]. 核农学报,2010,24(4):851-855.
[11]叶尚红,张志明,陈疏影. 植物生理生化实验教程[M]. 昆明:云南科技出版社,2004.
[12]陈 贵,胡文玉,谢甫绨,等. 提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J]. 植物生理学通讯,1991,27(1):44-46.
[13]陈金龙. 不同浓度盐分胁迫对枸杞生理指标的影响[J]. 林业科技通讯,2001(8):68-72.
[14]孙伟泽,韩 博,胡晓宁,等. 不同浓度盐胁迫下苜蓿丙二醛含量变化[J]. 安徽农业科学,2009,37(5):1905-1906,1911.
[15]Khoshgoftarmanesh A H,Khodarahmi S,Haghighi M. Effect of silicon nutrition on lipid peroxidation and antioxidant response of cucumber plants exposed to salinity stress[J]. Archives of Agronomy and Soil Science,2014,60(5):639-653.
[16]任贵军.干旱胁迫对油松生理指标的影响[J]. 辽宁林业科技,2018(5):1-2.
[17]Xiao Q,Zheng H,Chen Y,et al. Effects of salinity on the growth and proline,soluble sugar and protein contents of Spartina alterniflora[J]. Chinese Journal of Ecology,2005,24(4):373-376.
[18]贾漫丽,李 娜,李季生,等. 盐胁迫对4个桑树品种生理生化特性的影響[J]. 西北林学院学报,2016,31(5):96-101.
[19]胡水清青.杜红梅. NaCl处理对马齿苋植株生长的影响[J]. 上海交通大学学报(农业科学版),2018,36(5):67-72.
[20]韩志平,张海霞,刘 冲,等. NaCl胁迫对黄花菜生长和生理特性的影响[J]. 西北植物学报,2018,38(9):1700-1706.
[21]张凤银,陈禅友,高红霞. 不同菜豆品种对NaCl盐胁迫的响应[J]. 江汉大学学报(自然科学版),2018,46(4):293-298.赖 洋,朱 军,王 杰,等. 乌鲁木齐市冬季常绿植物园林应用价值评价[J]. 江苏农业科学,2020,48(6):138-146.
