尿液巨细胞病毒DNA检测在诊断婴幼儿巨细胞病毒感染应用中的价值
2020-05-21留静付金龙
留静 付金龙
人 类 巨 细 胞 病 毒(Human cytomegalovirus,HCMV)是引起围产儿感染最常见的病毒。HCMV侵入人体后可在宿主体内长期持续存在,免疫正常的个体感染HCMV后多无临床表现,但在免疫机制发育不成熟的胎儿、婴幼儿和其他免疫抑制个体中可侵袭多个器官、系统而产生严重疾病,且人群易感性年龄愈小,易感性愈高,症状也愈重[1]。因此,临床及早诊断和治疗对疾病的控制和预后具有重要意义。目前临床检测HCMV的方法主要有:血清学特意性抗体检查、HCMV病毒抗原检测,病毒学培养检查、实时荧光定量PCR法等。病毒的分离与培养既耗时、在临床又难以开展,IgM和IgG抗体的检测结果在特定情况下也不可靠,而实时荧光定量PCR(FQ-PCR)技术是诊断HCMV感染的快速、有效方法。
1 材料与方法
1.1 一般资料 本文为回顾性分析,收集2017年1月至2018年12月间在浙江大学丽水医院就诊的疑似HCMV感染的患儿256例,设为观察组,其中男155例,女101例;年龄0~3岁。主要临床症状为新生儿高胆红素血症、婴儿肝炎综合征、肺炎、发热、呕吐及腹泻。并选取同期在医院体检的健康婴幼儿130例设为对照组。
1.2 方法 (1)标本采集和处理:取患儿空腹全血2ml分离胶真空管,颠倒混匀,及时分离血清(离心4000r/min,5min)待检。不能及时检测的标本4℃保存,同时留取3ml的小便标本,放4℃冰箱保存,进行HCMV-DNA检测;为保证检验质量,同一批次的标本均于24h内完成检验。(2)HCMV DNA测定:严格按试剂盒(美国PerkinElmer公司)说明书操作。将50μl处理后的尿液、乳汁、血细胞沉淀物,以及等量DNA提取液加入1.5ml离心管中,100℃加热10min,12000r/min离心5min取上清液2μl做PCR扩增。FQ-PCR扩增条件(Applied Biosystems 7500 Real time PCR):93℃,2min预变性;93℃45s→55℃60s,10个循环;93℃30s→55℃45s,30个循环。结果判定由分析处理软件系统(7500 System software)自动生成。试剂盒检出限度为103copy/ml。(3)血清标本中HCMV-IgM的检测:化学发光仪上机检测:仪器(雅培I2000)及HCMV-IgM试剂由美国雅培公司生产。HCMV-IgM检测结果以Index值>1.00为阳性。
1.3 统计分析 采用SPSS 22.0统计软件。计量资料以()表示,两组间比较采用独立样本t检验;计数资料以%表示,组间比较采用χ2检验,计算一致性Kappa系数(Kappa>0.75表示一致性好,Kappa<0.4表示一致性差),考察各法检出结果的一致性。以P<0.05为差异有统计学意义。
2 结果
2.1 256例患儿一般情况分析 见表1。
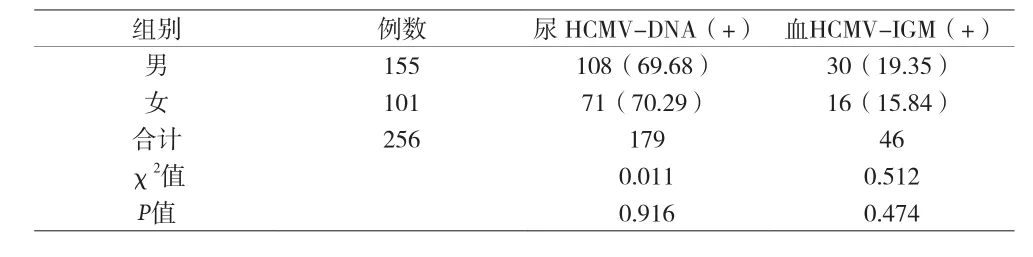
表1 256例不同性别患儿HCMV-IGM、HCMV-DNA检出率比较[n(%)]
2.2 256例患儿不同年龄组HCMV阳性率比较 见表2。
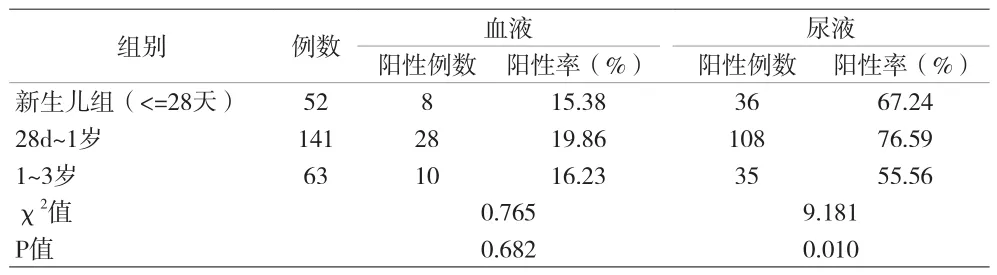
表2 256例患儿不同年龄组HCMV阳性率比较[n(%)]
2.3 两种检测方法的评价 尿液FQ-PCR检测HCMV-DNA的灵敏度为58.8%(179/306),特异性为96.3%(77/80),准确率为79.21%(306/386),化学发光法血HCMV-IGM的灵敏度为28.3%(46/175),特异性为99.5%(210/211),准确率为45.24%(175/386)。尿液FQ-PCR检测HCMV-DNA的灵敏度,准确率均高于化学发光法。见表3。

表3 两种检测方法的评价
2.4 两种方法检测结果比较 入组的256例患儿中,尿液FQ-PCR与化学发光法检测结果比较,尿液FQPCR阳性率明显高于化学发光法这2种检测方法所测结果没有相关性(χ2=17.652,P<0.05),Kappa值为0.114,结果缺乏一致性,见表4。
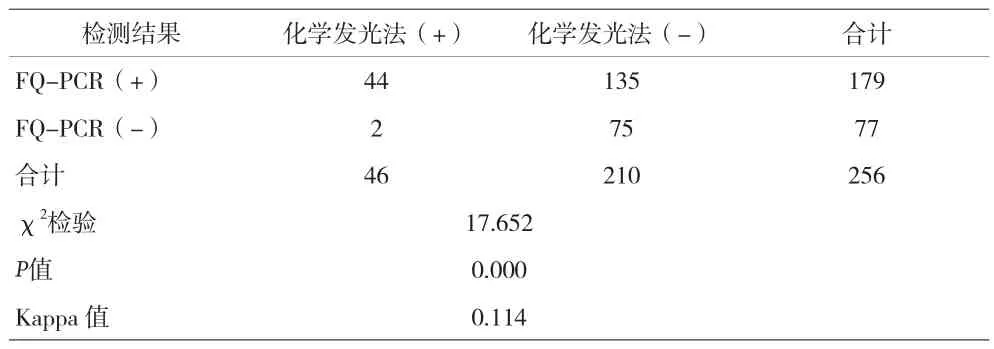
表4 化学发光法与FQ-PCR检测结果的比较
2.4 HCMV-DNA和血HCMV-IGM尿鉴别小儿巨细胞感染的ROC曲线 见图1。
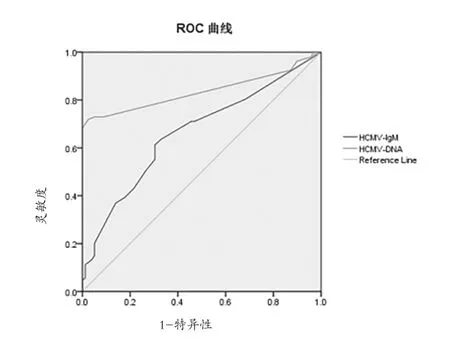
图1 HCMV-DNA和血 HCMV-IGM尿鉴别小儿巨细胞感染的ROC曲线
3 讨论
HCMV属人类疱疹病毒B亚科,为线性双链DNA病毒,原发性感染后会潜伏于人体组织形成终身感染[2]。在机体免疫功能正常的情况下多引起临床轻微症状或无症状,但是在免疫功能低下或缺陷的人群,以及免疫功能不成熟或低下的婴幼儿可引起严重疾病,广泛累及肝脏、肺脏、肾脏、心脏、淋巴细胞等多器官系统,危害巨大[3]。因此,对HCMV的早发现、早诊断、早治疗显得较为重要。
目前临床检测HCMV感染的主要标本来源有血、尿、唾液、乳汁、脐带血等[4]。本资料以患儿血、尿为观察对象,运用FQ-PCR法检测尿液标本中HCMV-DNA和化学发光法检测患儿血里面的HCMVIgM,结果提示FQ-PCR检测法检出率显著高于化学发光法,差异有统计学意义(χ2=17.652,P<0.05),由于在HCMV感染早期,机体刚开始产生的IgM时,血循环内只有微量的病毒颗粒,并未达到检测标本含有HCMV的IgM[5],但是此时体内病毒颗粒复制最为活跃同时随肾脏大量排出[6],尿液DNA可检测。随着机体免疫应答增强至抗体IgG大量产生后,体内病毒颗粒复制和排出缓慢下降,但是仍可持续通过肾脏排出[7]。但是由于肾小管为间歇排HCMV可能存在漏检,因此临床常检测血液HCMV-IgM,方便监测HCMV的感染情况,而尿液DNA检测有利于确诊。本资料在对观察对象的血液HCMV-IgM和FQ-PCR HCMV DNA发现其阳性率分别为17.96%和69.9%,Kappa值为0.114,两者结果缺乏一致性。而且尿液留取方便,对于小月龄的患儿检测尿液HCMV DNA对于HCMV感染及治疗效果监测更容易,更易让家长接受。
本资料对比各年龄段患儿发现,28d~1岁的患儿数量居多,检出的阳性率也偏高,尤其是尿液DNA检测阳性率达76.59%,对比其他年龄段差异有统计学意义(P<0.05)。新生儿巨细胞感染途径有三个:一个是孕妇子宫内感染;一个是分娩时的经产道感染;第三个是出生后的感染,前两种临床最多见,而新生儿出生后随着病毒量不断拷贝,临床症状也随之相应出现,所以28d~1岁之间感染的患儿检测人数增加,检出率也高于其他年龄段(P<0.05)。
综上所述,在抗HCMV治疗的疗效监测中,不能仅检测HCMV-IgM抗体的滴度,还应特别注意尿HCMV-DNA的监测,其对于临床随诊观察疗效的幼儿不仅取材更方便而且更具有临床指导意义。
