腹膜后副神经节瘤和神经鞘瘤的多层螺旋CT对比分析
2020-05-21赵丽赵振华毛海佳卢增新
赵丽 赵振华* 毛海佳 卢增新
原发腹膜后副神经节瘤和神经鞘瘤是后腹膜间隙的神经源性肿瘤,其术前诊断和评估主要依靠影像学检查,尤其是CT检查,而目前对这两种肿瘤的CT表现认识相对不足,易造成误诊,且两者术前准备方式有所不同。因此,分析这两种肿瘤的MSCT表现及其差异对术前诊断和鉴别诊断具有重要意义。本研究回顾性分析32例手术病理证实的腹膜后副神经节瘤和神经鞘瘤的MSCT表现,探讨MSCT对两者的诊断及鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾分析2010年1月至2019年6月共34例经病理证实副神经节瘤和神经鞘瘤,其中2例未行完整的腹部三期扫描而被排除,最终32例纳入研究,其中副神经节瘤15例(男9例,女6例),神经鞘瘤17例(男8例,女9例),临床症状均以腹部不适为主,其中副神经节瘤患者中4例伴高血压。
1.2 CT检查 采用Philips多排CT机(Philips 64,Philips Medical Systems,Cleveland,OH,美国)行平扫和增强扫描。扫描参数:视野360mm×280mm,螺距1.015,重建层厚3mm。增强使用高压注射器(密苏里TMXD2001,ulrich medical OR,德国)将1.8ml/kg非离子型对比剂(碘普胺300mgI/ml),以2.5~3.0ml/s的流率注入肘部静脉;注射对比剂后25s、60s分别行动脉期、静脉期扫描。
1.3 CT图像分析 所有病例图像均上传至PACS系统(Radinfo,美国)进行分析。由两名高级职称诊断医师在未知病理结果情况下进行分析,分析内容:(1)记录患者年龄、性别,病灶大小、形态、边界、均匀度、有无钙化、囊变/坏死、囊变分布位置(周边/中心)、出血。大小以最大径线测量肿块大小。(2)记录两组病变之间的平扫密度,各期增强CT值及动脉期、静脉期强化率[公式:(增强-平扫)/平扫×100%]。CT值测量:分别在两组病例的病灶实质画感兴趣区(ROI),测量在各期的CT值;测量时,ROI面积尽可能大,同时避免ROI内包含血管及坏死组织及钙化;测量病灶区3~5个ROI的CT值,计算平均CT值;同一病例不同时相的ROI部位、大小相同。
1.4 统计学分析 采用SPSS 21.0统计软件。患者的年龄,肿瘤最大径、肿瘤平扫、增强各期CT值和动脉期、静脉期强化率等计量资料先行正态检验,符合正态分布,再采用独立样本t检验,患者性别,形态、边界、均匀度、有无钙化、囊变和坏死、囊变分布位置(周边/中心)、出血等计数资料采用Fisher精确概率检验法。P<0.05时表示差异具有统计学意义。
2 结果
本资料中副神经节瘤组和神经鞘瘤组性别、年龄,肿瘤的形态、边界、均匀度、钙化、囊变和坏死、出血差异均无统计学意义,两种肿瘤形态规则,呈圆形或类圆形,边界清楚,囊变坏死常见,钙化少见(见图1、2,表1、2),3例均呈点状钙化,出血少见(见表2);神经鞘瘤肿瘤3cm左右密度较均匀,中心强化高于周边(见图3),副神经节瘤即使病灶体积较大,其密度也可表现均匀(见图4),副神经节瘤囊变/坏死的分布位置以周边为主(见图5),较神经鞘瘤组明显多见且差异有统计学意义(P=0.013)(见表2)。副神经节瘤组和神经鞘瘤组肿瘤平扫CT值、动静脉期CT值、动脉期强化率差异均有统计学意义(P<0.01),静脉期强化率差异无统计学意义(P=0.216)(见表3,图6);副神经节瘤组的强化模式表现为“速升缓降”,而神经鞘瘤强化模式表现为“渐升”型(见表3,图7)。

表1 副神经节瘤组和神经鞘瘤组间性别和年龄比较
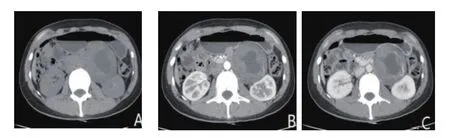
图1 神经鞘瘤的CT图像(男,51岁,A:CT平扫病灶呈等密度,密度不均匀,边界清;B:动脉期中度强化;C:静脉期进一步强化)
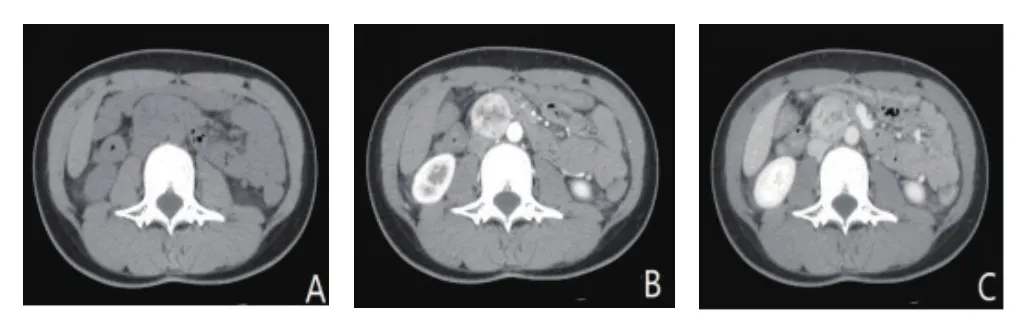
图2 副神经节瘤CT图像(女,28岁,A:CT平扫病灶等密度,密度不均匀,边界光整;B:动脉期肿瘤明显强化,中央有坏死灶;C:静脉期强化退出)
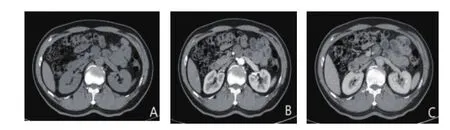
图3 神经鞘瘤的CT图像(男,54岁,A:CT平扫病灶密度均匀,最长径3.1cm;B:动脉期肿瘤轻度强化;C:静脉期强化呈瘤体中心明显云絮状强化,周边轻度强化)
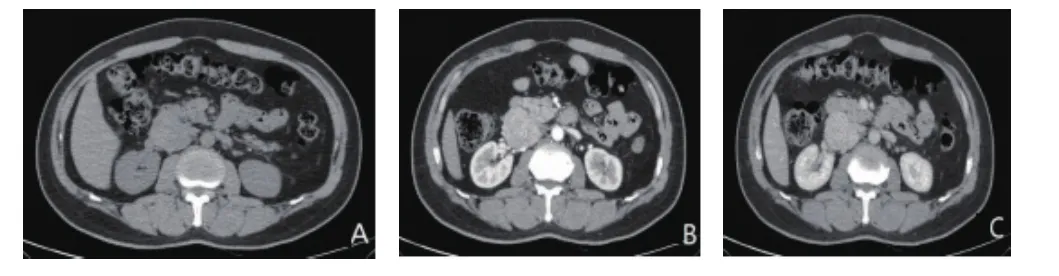
图4 副神经节瘤CT图像(男,54岁,A:CT平扫病灶密度均匀,最长径5.0cm,小点状钙化;B:动脉期肿瘤明显均匀强化;C:静脉期强化稍退出)

图5 副神经节瘤CT图像(女,70岁,A:CT平扫病灶密度不均匀;B:动脉期肿瘤明显不均匀强化,坏死区位于周边;C:静脉期强化稍退出,周边坏死区未见强化)

图6 副神经节瘤和神经鞘瘤在各期的CT值和强化率直方图
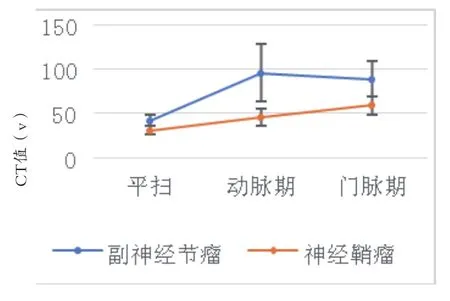
图7 副神经节瘤和神经鞘瘤在各期的CT值曲线图

表2 副神经节瘤组和神经鞘瘤组影像学表现的统计表(n)
表3 副神经节瘤组和神经鞘瘤组各期CT值及强化率的统计表()
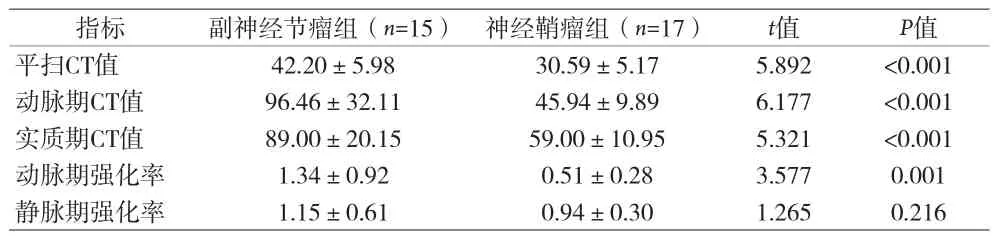
表3 副神经节瘤组和神经鞘瘤组各期CT值及强化率的统计表()
指标 副神经节瘤组(n=15) 神经鞘瘤组(n=17) t值 P值平扫CT值 42.20±5.98 30.59±5.17 5.892 <0.001动脉期CT值 96.46±32.11 45.94±9.89 6.177 <0.001实质期CT值 89.00±20.15 59.00±10.95 5.321 <0.001动脉期强化率 1.34±0.92 0.51±0.28 3.577 0.001静脉期强化率 1.15±0.61 0.94±0.30 1.265 0.216
3 讨论
副神经节瘤和神经鞘瘤是腹膜后相对少见的肿瘤[1-2]。关于这两种肿瘤的CT表现对比研究较少,且在临床实践中发现:两者之间的CT表现,尤其是在本应有明显鉴别意义的强化方式上尚存在影像学的交叉重叠,使其在诊断和鉴别诊断时存在困难。
3.1 副神经节瘤的病理特征和CT表现 副神经节瘤又称为异位嗜铬细胞瘤,起源于神经嵴嗜铬组织,其由主细胞和支持细胞2种细胞组成,主细胞多呈巢团状排列(形成所谓的“器官样”结构)或梁索状排列,而支持细胞则围绕在主细胞巢团周围,瘤体内有丰富的血窦[3]。肿瘤内间质成分形态也多变,可呈血管瘤样、粘液样和明显的硬化等[4]。副神经节瘤的特征是丰富血供肿瘤,及具有丰富的毛细血管网络,微循环不稳定[5]。这些组织学特征可导致自发的大量瘤内出血和坏死囊性变,本资料显示80%的副神经节瘤内出现囊变坏死,与其病理特征相符。增强CT显示病灶动脉期明显强化,与其瘤体内丰富的毛细血管网有关。副神经节瘤主要呈现“速升缓降”型,动脉期强化达到峰值,而静脉期强化减弱。但部分表现为“渐升”型,呈现轻中度持续强化。这可能与肿瘤血管的密集程度及血窦的丰富程度有关。
3.2 神经鞘瘤的病理特征和CT表现 原发性腹膜后神经鞘瘤是起源于外周神经鞘Schwann细胞的肿瘤,临床罕见[6-7],根据肿瘤细胞形态和分布不同,分为束状型(Antoni A型)和网状型(Antoni B型),其典型表现是富含梭形细胞的组织(Antoni A区)和少但为多形性细胞的组织(Antoni B区)的交替出现[8],Antoni B区易退化,其内粘液样成分较多,其囊变可能是由于神经鞘瘤血管壁玻璃样变性或血管内皮细胞增生引起[6]。囊变被认为是神经鞘瘤的影像学特征之一[6],但此影像学表现与副神经节瘤有重叠。有研究表明:神经鞘瘤的囊变以中心缺血性坏死发生为主[5,7],与本资料结果基本一致。在增强扫描中,神经鞘瘤强化方式多样,动脉期轻度为主,也可表现为明显强化,门脉期呈现“渐进性”强化模式,这可能与肿瘤细胞的分化程度或者与瘤体退变(如囊变坏死,出血)相关。3.3 副神经节瘤和神经鞘瘤的鉴别诊断 腹膜后神经鞘瘤在CT平扫以等密度为主,部分肿瘤血供丰富,强化程度与副神经节瘤相仿,因此,神经鞘瘤常被误诊为副神经节瘤。研究发现,副神经节瘤和神经鞘瘤两者均为软组织密度影,但两者CT平扫密度存在统计学差异,分析其原因为神经鞘瘤因Antoni B存在,容易细胞水肿,使其整体密度减低。作者发现副神经节瘤组和神经鞘瘤组均可表现为均匀密度,但神经鞘瘤以3cm左右密度尚可均匀,并且肿瘤增强后,瘤体中部呈散在云絮状明显强化,周围类环状轻度强化,随着肿瘤体积增大,几乎均有坏死囊变,而本资料发现3例副神经节瘤即使病灶体积较大(最大径均>4cm),亦可表现为均匀而无坏死囊变。同时副神经节瘤囊变坏死分布位于肿瘤的周边多见,而神经鞘瘤囊变坏死区域主要位于肿瘤的中心,这可能与副神经节瘤血管的分布有关,其瘤体中间血管网丰富,周围较少,肿瘤增大时易引起周围坏死囊变。研究表明神经鞘瘤和副神经节瘤两者均易出血[5],但本资料显示副神经节瘤的出血率为13%,神经鞘瘤为5%,两者出血率均不高,这可能与CT对于不同时期的出血检测的敏感性有关,其对非急性期出血的检出率较低。两种肿瘤在动静脉期CT值、动脉期强化率有明显的统计学差异,副神经节瘤的强化方式显示“速升缓降”模式,而神经鞘瘤表现为“渐升”的强化模式。
综上所述,副神经节瘤在CT平扫密度,囊变/坏死灶的分布位置、强化程度及强化模式与神经鞘瘤存在差异。作者认为,在临床实践中,上述的这些差异对副神经节瘤和神经鞘瘤的诊断和鉴别诊断具有一定的应用价值,结合临床病史可进一步提高术前诊断的准确性。
本研究的不足:首先,腹膜后副神经节瘤和神经鞘瘤的样本量相对较小,对研究的准确性存在潜在影响,同时也反映出这两种肿瘤的发病率较低。其次,因检查时间限制,未采用更精准的对比剂追踪扫描模式,使得各期病灶的CT峰值与实际CT峰值存有偏差。第三,病变主要表现为囊变、出血和坏死时,实性成分相对较少,这可能影响实性成分CT值测量。今后将进一步扩大样本量,完善扫描技术,增加磁共振方面的研究,以期为腹膜后肿瘤的诊断和鉴别诊断提供更多有价值的信息。
