一种生物防腐剂在呕吐毒素水提液中的应用
2020-05-20金晓林高晓芳张东升
金晓林 高晓芳 张东升
摘要 [目的]考察一種生物防腐剂ProClin 300在小麦、玉米及饲料水提基质液中的抑菌效果和对呕吐毒素(DON)的测定影响。[方法]采用微生物挑战性试验验证ProClin 300对5种指示菌的抑菌能力,同时采用免疫亲和柱净化-高效液相色谱法(IAC-HPLC)测定水提液中DON的含量。[结果]不同水提基质液中ProClin 300添加量为0.02% ~ 0.10%,分别于(28±1) ℃(霉菌试验)及(37±1) ℃(细菌试验)下放置21 d,7 d后均无菌落生长显示含0.02%及以上防腐剂对5种指示菌有杀菌作用,且呕吐毒素含量均未发生显著变化(P>0.05)。[结论]ProClin 300能有效抑菌,对呕吐毒素检测无影响,可延长水提样本液的保存期,有利于缩短阳性样本的前处理周期。
关键词 生物防腐剂;呕吐毒素;提取液;抑菌
Abstract [Objective]The research aimed to investigate the bacteriostatic effect of ProClin 300, a biological preservative, in wheat, corn and feed water extract matrix solution, and its influence on the determination of deoxynivalenol(DON).[Method] Microbial challenge test was used to verify the bacteriostatic ability of ProClin 300 against five kinds of indicator bacteria, and the content of DON in water extract was determined by high performance liquid chromatographic method with immunoaffinity column cleanup. [Result]The amount of ProClin300 added to different waterextracted matrix solutions was 0.02%-0.10%,and placed at 28±1 ℃ (mould test) and 37±1 ℃ (bacteria test) for 21 days respectively. There was no colony growth on the plate after 7 days,the results showed that the preservative containing 0.02% or more had bactericidal effect on five kinds of indicator bacteria, and the content of DON did not change significantly (P>0.05).[Conclusion]ProClin 300 can effectively inhibit bacteria, has no effect on the detection of DON, and can prolong the storage period of water extracted sample solution.
Key words Biological preservative;Deoxynivalenol(DON);Extract;Bacteriostat
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称呕吐毒素,是由小麦赤霉病菌禾谷镰刀菌复合群产生一种单端孢霉烯族真菌毒素[1]。联合国粮农组织(FAO)和世界卫生组织(WHO)已将DON确定为最危险的自然发生食品污染物之一[2],国际癌症研究中心(IARC)于1993年将其列为三类致癌物[3]。小麦和玉米是我国最大的粮食经济作物,受气候的影响极易发生镰刀菌的侵染,DON含量是当前食品安全、粮食安全及饲料安全风险监测中最重要的卫生指标之一。
仅2016年江苏省小麦粉中DON专项监测的样本数量达160份,2018年全国饲料质量安全监测的各类饲料产品7 424批次,2019年全国政策性粮食库存数量和质量大清查中,仅江苏省涉及DON检测的样本数量多达1 000份[4-6]。面对集中庞大的检测样本,通常采用快检初筛,阳性样本再经高效液相色谱仪确认[7],但繁琐的二次称量、提取、离心等工作必不可少,因DON易溶于水,常采用水提取,若不及时冷藏处理,样本提取液极易发生腐败变质影响后续检测,能否保持水提样本的基质不变化,便于后续液相分析前的富集净化,这对于缩短检测周期具有重要的现实意义。
新一代高效生物防腐剂ProClin,因具有广谱抗菌性、作用速度快、使用剂量少、pH适用范围广(pH 2.0~8.5)、化学稳定性好,毒性远低于硫柳汞、叠氮化钠等同类产品,且与水可以任意比混合等特点,被Supelco公司广泛应用于体外诊断试剂的防腐中[8-9]。ProClin 300主要活性成分是2-甲基-4-异噻唑啉-3-酮和5-氯-2-甲基-4-异噻唑啉-3-酮,在与细胞膜接触后可渗透到膜内抑制胞内酶的活性,降低胞内能量水平,从而抑制细菌、真菌和酵母等微生物的生长。为解决生物样本处理后保存期短的问题,笔者尝试在小麦、玉米及成品饲料的水提溶液中添加不同浓度的ProClin 300,(28±1)℃、(37±1)℃下放置21 d,考察其抑菌效果和对DON含量测定(免疫亲和柱净化-高效液相色谱法)的影响,评价其在样本处理液中的防腐能力和对净化过程中抗原、抗体的结合影响。
1 材料与方法
1.1 試验材料
1.1.1 材料。DON标准品[100.7 μg/mL,纯度≥98%,GBW(E)100304,溶剂乙腈],购自国家粮食科学研究院。ProClin 300,购自上海闪锦分子生物。甲醇、乙腈(色谱纯)购自德国Merck公司。其余试剂均为分析纯;试验用水均为超纯水。小麦、玉米来源盐城地方粮食储备库。饲料样本,由江苏省兽药饲料畜产品质量安全检测中心提供。白色念珠菌(CMCC(F)98001)、大肠埃希氏菌(ATCC8739)、金黄色葡萄球菌(CMCC(B)26003)、铜绿假单胞菌(CMCC(B)10104)、黑曲霉(CMCC(F)98003)均购自广东省食品微生物安全工程技术研究开发中心菌种保藏中心。大豆酪蛋白琼脂培养基、沙氏葡萄糖琼脂培养基、营养琼脂斜面培养基,均购自广东环凯微生物科技。沙氏培养基斜面,购自杭州滨和微生物试剂有限公司。
1.1.2 仪器。
BCM-1000A生物洁净工作台,苏州安泰空气技术有限公司;GHP-9270生化培养箱,上海一恒;T6新悦可见分光光度计,北京普析通用;LC-20AT 液相色谱仪(含SPD-20A紫外检测器),日本岛津;Amethyst C18-H色谱柱(4.6 mm×250 mm,5 μm),美国赛芬;AP-01P型真空泵,天津奥特赛恩斯;无菌溶剂过滤器,美国康宁;934-AH玻璃纤维滤膜(直径11 cm),英国Whatman;DON免疫亲和柱(柱容量≥1 200 ng/支,交叉反应:抗DON单抗与DON、15-Ac-DON、3-Ac-DON及NIV的交叉反应分别为100%、220%、<0.2%、<0.1%),无锡创谱生物科技提供。
1.2 试验方法
1.2.1 样本处理液的制备。
参照GB 5009.111—2016、GB 4789.15—2016及GB/T 30956—2014[10-12]前处理方法,略有改动。平行称取粉碎的小麦、玉米及饲料样本25.0 g各2份于无菌含玻璃珠的三角瓶中,加无菌水225 mL,振荡器往复振荡提取60 min,静置20 min。上清过0.45 μm无菌滤膜,合并平行滤液,每种样本分别取20 mL于50 mL无菌离心管中,共3组(细菌组、霉菌组、DON组),每组设定不同添加浓度的ProClin 300(0.02%、0.05%、0.10%),4 ℃备用。
1.2.2 微生物挑战性试验[13]。
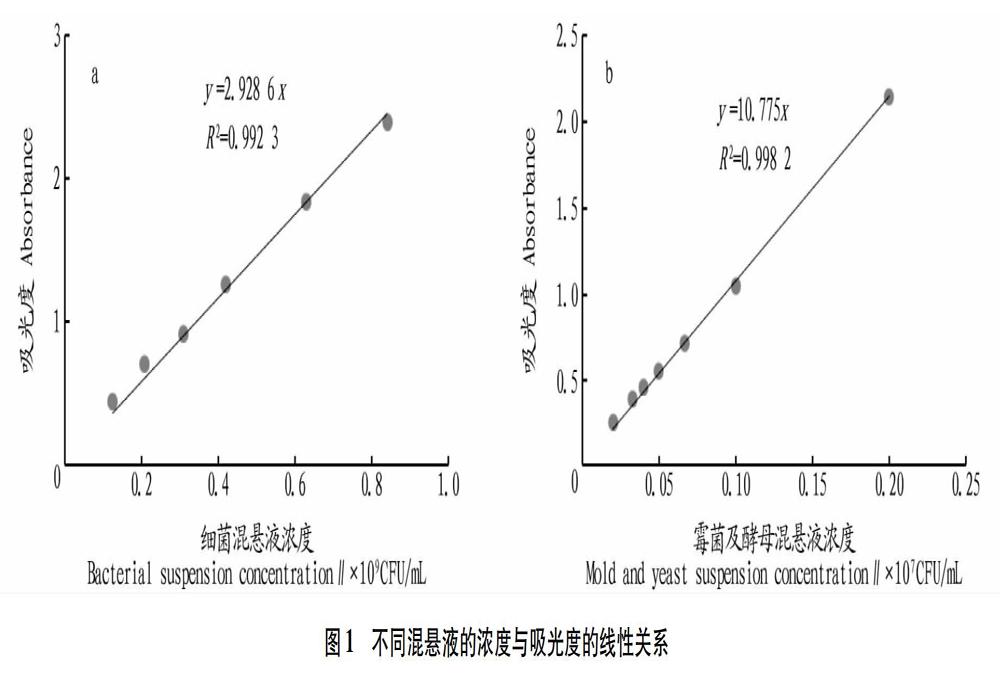
1.2.2.1 试验用菌液的配制。试验前各取1株标准菌株分别接种到普通斜面培养基上,细菌所需温度(37±1)℃,恒温培养48 h,霉菌所需温度(28±1)℃,培养6 d,直至产生孢子。用少量的无菌生理盐水分别将菌苔洗出,充分摇匀,离心,经适量无菌水稀释分别制成109 CFU/mL细菌悬液(以650 nm对应的吸光度0.15时的菌液浓度约108 CFU/mL进行推测[14])以及107 CFU/mL酵母和霉菌悬液(以650 nm对应的吸光度1.0时的菌液浓度约107 CFU/mL进行推测),混合细菌量比例采用体积1∶1∶1,霉菌和酵母混合比例也采用体积比1∶1。置4 ℃冰箱冷藏备用,且24 h内添加使用。以平板计数的浓度为横坐标、对应650 nm下的吸光度为纵坐标,考察混合菌悬液的线性关系。
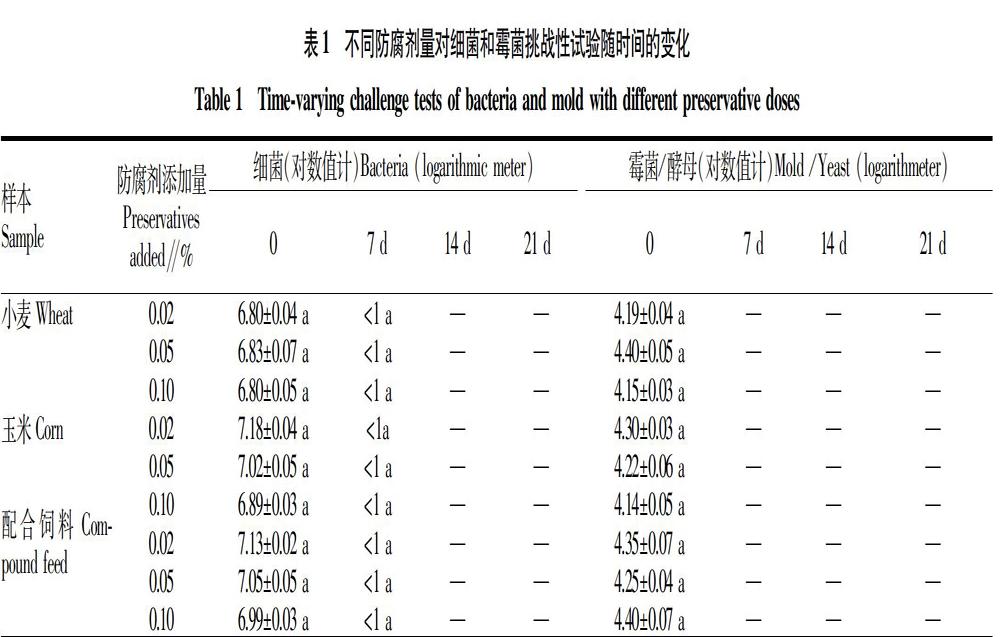
1.2.2.2 挑战试验。细菌组中加入0.2 mL细菌混悬液,霉菌组加入0.2 mL的霉菌和酵母孢子混悬液,使得受检样本最终含菌量分别达107、105 CFU/mL,充分混匀。分别将样品置于(37±1) ℃(细菌培养)及(28±1) ℃(霉菌及酵母)条件下,在接菌后0、7、14、21 d取样进行分析,每次取1.0 mL进行平板计数,以微生物浓度的对数值进行记录。
1.2.3 DON高效液相色谱测定。
取样时间同“1.2.2”,取DON组样本3 mL,PBS(0.01 mol/L,pH 7.4)稀释至30 mL,过玻璃纤维滤纸,取20 mL过免疫亲和柱净化,净化过程如GB 5009.111—2016及GB/T 30956—2014所描述。2.0 mL色谱纯甲醇洗脱,氮气挥干,1 mL流动相复溶,过0.22 μm有机相滤膜后HPLC测定。色谱条件:Amethyst C18-H柱(250 mm×4.6 mm,5 μm),岛津SPD-20A紫外检测器,检测波长220 nm,流动相乙腈-水(16∶84),等度洗脱,流速1.0 mL/min;柱温箱35 ℃,进样体积20 μL。
1.3 统计分析 应用SPSS 16.0软件,所有数据采用均值±标准差(±S)表示,数据对比采取新复极差分析,P>0.05,差异无统计学意义,不同小写字母具有显著性差异(P<0.05)。
2 结果与分析
2.1 不同菌吸光度与菌液浓度的线性关系
从图1a可以看出,3种致病菌菌悬液的混合,浓度在0.13×109~0.84×109 CFU/mL时,吸光度与浓度呈良好的线性关系,且1.0×108 CFU/mL的混悬液对应的吸光度在0.29,这与董自艳等[14]的研究报道基本一致。由于霉菌与酵母的个体直径远大于细菌,相同浓度下,其吸光度要高于细菌,由图1b可以发现在0.02×107~0.20×107 CFU/mL吸光度与浓度决定系数R2达0.998 2。
2.2 不同防腐剂量对细菌及霉菌挑战性试验
从表1的抑菌效果来说,ProClin 300对于霉菌及细菌的抑制效果非常好,7 d后不同浓度的添加均无菌落生长(细菌的稀释度为0.1和0.01,霉菌为原液),展示了低剂量具有较强的杀菌能力。小麦及玉米为农产品,收储过程未对带菌量进行限量要求,饲料的生产过程包括热杀菌过程,但是饲料的水提液营养极为丰富,虽然初始浓度较低,若不添加防腐剂,极容易腐败变质。从饲料卫生指标[15]中可知,饲料原料的细菌限量要求小于2×106 CFU/g,霉菌限量要求小于4×104 CFU/g。试验的添加浓度换算成固体浓度略高于限量值。
按照化妆品、盥洗用品与香料协会(CTFA)标准要求[16],在第7天时,细菌及霉菌数分别下降99.9%、90.0%,且28 d内呈现连续下降的趋势,则防腐效果优良。该试验结果显示,ProClin 300添加量≥0.02%时,7 d后细菌、霉菌对数值分别下降至1和0,通过了挑战试验。对比林竹[17]的研究报道,其固体化妆品细菌和霉菌混合试验菌添加浓度分别为106、105 CFU/g,优选的防腐体系苯氧乙醇(0.5%)与甲基异噻唑啉酮(0.06%)的结果显示7 d细菌对数值下降了2,霉菌对数值下降了4; 从固体换算至液体中的防腐剂浓度在0.050%和0.006%,抑制效果的差异主要受复合的防腐体系及浓度影响。
2.3 不同防腐剂量下DON含量检测
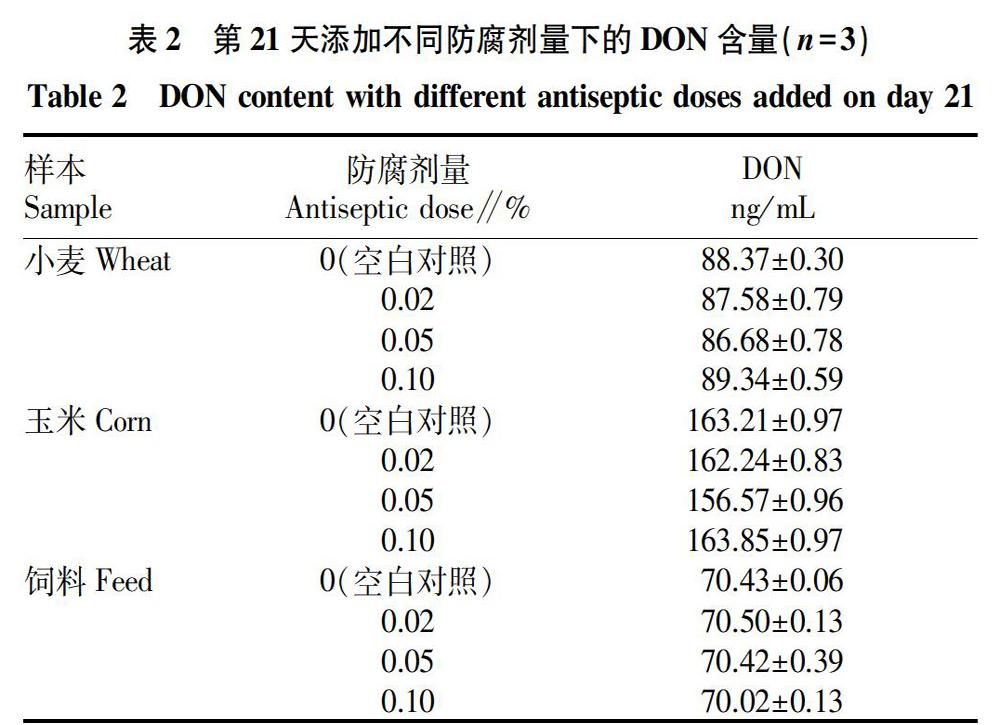
在不添加防腐剂的空白对照组,研究人员发现,水提液在24 h后,已经发生腐败变质,48 h后溶液的pH达4.5~5.0,为防止酸性溶液影响抗原抗体的结合,采用PBS緩冲溶液进行稀释后过免疫亲和柱,保证抗原抗体的结合。对不同样本第21天添加不同防腐剂量下的DON含量(表2)进行方差分析,发现F(27.86)>F0.05(2.30),表明不同防腐剂量间无显著差异。图2则说明在不同样本的水提液中,未添加防腐剂的空白对照和添加防腐剂在连续21 d下的DON含量无显著差异(P>0.05)。但腐败变质的气味会无法使分析人员愉悦地进行工作。
3 讨论与结论
评价一种生物防腐剂的效力通常需筛选最适pH和初始菌量。吴慧清等[18]研究报道在pH 6.0以下及起始菌悬液浓度均低的情况下,壳聚糖复合生物防腐剂对于5种指示菌抑菌的效果最好,但考虑到样本后期免疫亲和柱的净化,需磷酸盐缓冲溶液(0.01 mol/L PBS,pH 7.4)稀释至pH 7~8,以保证抗体有效捕获提取液中的DON,即使按照5倍稀释来说,净化2 mL的原液实际上过柱体积为10 mL,如此将延长净化处理的时间。对于防腐剂的添加量理应随初始带菌量的增加而增加,为保证ProClin 300添加浓度的适用性,研究人员进行了50份小麦、20份玉米及30份仔猪配合饲料的初始菌落总数、霉菌和酵母测定发现,原始样本菌落总数均小于105 CFU/mL,霉菌和酵母含量均小于105 CFU/mL,与狄元冉等[19]、高延玲等[20]报道生物饲料添加剂及饲料中致病微生物的污染水平基本一致。
从免疫亲和净化原理[21]来看,水提液中的DON通过层析柱,与固定在琼脂糖凝胶上的单抗发生抗原抗体的结合反应,淋洗环节可有效地去除包括防腐剂在内的杂质。已有研究报道[22-23],ProClin 不会对诊断试剂中的关键酶如辣根过氧化物酶(HRP)及碱性磷酸酶(AP)与底物的结合产生影响,研究人员在对比含DON的PBS溶液(添加ProClin 300至0.5%,对照组ProClin 300浓度0),过免疫亲和柱净化-液相测定后发现,相同浓度峰面积差异<5%,再次表明高浓度ProClin 300存在下对于抗DON抗体与抗原的结合反应没有影响。
该试验结果表明,添加≥0.02% ProClin 300的水提基质液可常温放置21 d,为阳性样本后续过免疫亲和柱净化,减少了繁琐的称量、提取、离心等前处理过程。添加了ProClin 300的样本提取液冷藏状态下存储时间更长,但氧化带来的风险仍需关注。另外,对于其他霉菌毒素的提取液(一定浓度的甲醇或乙腈溶液)是否有作用,还需进一步的探索。
参考文献
[1] 史建荣,刘馨,仇剑波,等. 小麦中镰刀菌毒素脱氧雪腐镰刀菌烯醇污染现状与防控研究进展[J]. 中国农业科学,2014,47(18):3641-3654.
[2] 武传欣,程小丽,孙伟. 粮食中呕吐毒素的研究进展[J]. 粮食加工,2016,41(4):48-51.
[3] 常敬华,赵月菊,邢福国,等. 脱氧雪腐镰刀菌烯醇(DON)的毒性及其生物转化研究进展[J].食品与发酵工业,2014,40(4):101-107.
[4] 关于印发《2016年江苏省小麦粉中脱氧雪腐镰刀菌烯醇专项监测方案》的通知[A/OL].(2016-08-10)[2016-08-10]http://wjw.zhenjiang.gov.cn/ywgl/swjd/gzdt/201608/t20160810_1760596.htm
[5] 国家发展和改革委员会,国家粮食和物资储备局,财政部,等.关于印发全国政策性粮食库存数量和质量大清查实施方案的通知[A/OL].(2019-02-12)[2019-02-12].http://www.cofeed.com/soybean/19022614555.html.
[6] 农业农村部办公厅关于2018年全国饲料质量安全监测结果的通报[A/OL].(2019-04-18)[2019-04-18].http://www.moa.gov.cn/govpublic/XMYS/201904/t20190424_6212564.htm.
[7] 季一顺,胡斌,周红梅,等.液相色谱检测脱氧雪腐镰刀菌烯醇前处理过程的优化[J].河南工业大学学报(自然科学版),2011,32(3):56-58.
[8] PROCLIN系列防腐剂[J].生命科学仪器,2004(1):23-24.
[9] MURAYAMA H,MATSUURA N,KAWAMURA T,et al. A sensitive radioimmunoassay of insulin autoantibody:Reduction of non-specific binding of[125I]insulin[J]. Journal of autoimmunity, 2006, 26(2):127-132.
[10] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定:GB 5009.111—2016[S].北京:中国标准出版社,2017.
[11] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2016[S].北京:中国标准出版社,2017.
[12] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.饲料中脱氧雪腐镰刀菌烯醇的测定 免疫亲和柱净化-高效液相色谱法:GB/T 30956—2014[S].北京:中国标准出版社,2015.
[13] 熊家娟.药品中防腐剂的抗菌效力测定与评价[J].中国药事,2005,19(10):592-594.
[14] 董自艳,戴翚,马仕洪,等.紫外-可见分光光度法快速确定细菌菌液的浓度[J]. 中国药品标准,2014,15(2):120-121.
[15] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.饲料卫生标准:GB 13078—2017[S].北京:中国标准出版社,2017.
[16] 张怡,王珊珊,龚盛昭,等.几种复合防腐剂在化妆品中的防腐效果及评价[J].广东化工,2014,41(6):78-80.
[17] 林竹.婴儿洗类产品防腐剂抑菌效果及评价[J].北京日化,2015(4):44-46.
[18] 吴慧清,吴清平,石立三,等.壳聚糖复合生物防腐剂的抑菌效果研究[J].食品科学,2007,28(10): 112-117.
[19] 狄元冉,李博,董鹏,等.生物饲料添加剂中微生物污染情况调查分析[J].饲料工业,2019,40(18):20-24.
[20] 高延玲,张发旺,班付国,等.饲料中致病性微生物监测结果分析[J].上海畜牧兽医通讯,2013(1):18-19.
[21] 袁藝,陆廷瑾,沈腾腾,等.免疫亲和柱的制备及在真菌毒素检测中应用的研究进展[J].食品工业科技,2013,34(24):396-400.
[22] 邹建文.BSA检测(ELISA)试剂盒的研制[D].咸宁:湖北科技学院,2019:22-29.
[23] 黄倩云,吴恩应,李慧,等.体外诊断试剂防腐剂的选择策略[J].生物技术通讯,2013,24(4):592-594.
