大鼠皮肤挫伤后Beclin1、LC3的表达及其与损伤时间的关系
2020-05-20颜峰平陈圆圆
颜峰平,叶 星,陈圆圆
(赣南医学院法医学系,江西 赣州 341000)
法医学损伤时间是指人体组织、器官损伤后至检验时所经历的时间间隔,损伤时间推断是法医病理学研究和实践的重点与难点内容。客观、准确的损伤时间推断能为划分嫌疑人范围、推测嫌疑人的作案意图、现场重建等提供重要依据,具有重要的法医学意义[1]。现有研究认为通过检测损伤修复过程中各种生物学指标的变化趋势,并结合损伤的形态学变化,可以为损伤时间推断提供良好依据[2]。
细胞自噬参与皮肤损伤的修复过程已被研究证实。本研究通过建立大鼠皮肤挫伤模型,研究不同损伤时间段后自噬相关分子Beclin1、LC3的mRNA及蛋白表达情况,并探讨Beclin1、LC3在法医学损伤时间推断中的价值。
1 材料与方法
1.1材料
1.1.1实验动物健康成年雄性Sprague-Dawley(SD)大鼠42只,体重180~200 g,购自上海杰思捷实验动物有限公司。
1.1.2主要试剂及仪器5%水合氯醛(Sigma),TRIzol试剂(Invitrogen),RIPA裂解液(碧云天生物技术公司),LC3抗体(CST),Beclin1抗体(CST),β-actin抗体(CST),HRP标记的二抗(CST),SYBR Green PCR试剂盒(Qiagen),PCR引物(上海生工生物工程股份有限公司),荧光定量PCR仪(Applied Biosystems),蛋白免疫印迹化学发光仪(天能),核酸电泳仪(天能)等。
1.2实验方法
1.2.1动物分组和模型建立SD大鼠随机分为正常对照组,皮肤挫伤后3 h、6 h、12 h、24 h、72 h组及死后皮肤挫伤组,每组6只,参考刘宁国等报道的方法构建大鼠皮肤挫伤模型[3]。在特定损伤时间后将大鼠颈椎脱臼处死,快速提取挫伤区皮肤组织置于-80℃冰箱冻存备用。正常对照组皮肤不作挫伤处理,取与挫伤组相同部位皮肤组织。
1.2.2总RNA提取和实时荧光定量PCR检测(RT-qPCR)挫伤组、对照组皮肤组织按TRIzol一步法提取总RNA,用紫外分光光度法检测所提取RNA的浓度和纯度,同时采用琼脂糖凝胶电泳判断提取的RNA质量。RNA在波长为260 nm和280 nm处的吸光度比值要求在1.8~2.2范围内,方可进行后续实验。
按照SYBR Green PCR试剂盒说明书配置RT-qPCR体系,然后在7500型荧光定量PCR仪上进行检测。荧光定量PCR引物序列见表1,GAPDH作为内参基因,采用2-△△Ct计算基因相对表达量。

表1 荧光定量PCR引物序列
1.2.3蛋白质免疫印迹反应(Westernblot)各组取适量皮肤组织加入裂解液匀浆,离心取上清液,按1∶1加入2X的SDS上样缓冲液中,放入100 ℃的沸水中加热10 min使蛋白变性,SDS-PAGE电泳分离蛋白质,电泳结束后,在转膜缓冲液中进行转膜,取出PVDF膜置于5%的牛奶中封闭1 h,封闭结束后,用TBST洗膜3次,5 min/次,在膜上敷上相应的一抗,4 ℃过夜。次日,TBST洗膜3次,5 min/次,加入相应的二抗,室温孵育1 h。最后配置ECL显色液(A∶B=1∶1),在化学发光仪上对孵有相应抗体的条带显色。

2 结 果
2.1挫伤后各组皮肤组织中Beclin1、LC3的mRNA表达变化RT-qPCR检测发现Beclin1 和LC3的mRNA含量在挫伤后均呈现先下降后恢复至正常水平的趋势。Beclin1、LC3分别在挫伤6 h、12 h下降最为显著,在24 h、72 h均恢复至正常水平,死后损伤组与对照组比较差异无统计学意义(图1、表2)。

图1 挫伤皮肤组织中Beclin1和LC3 mRNA水平检测
表2 荧光定量PCR检测各组皮肤组织中LC3和Beclin1 mRNA相对表达量
注:a为与对照组相比。
2.2挫伤后各组皮肤组织中Beclin1、LC3的蛋白表达情况与对照组比较,挫伤后24 h内Beclin1、LC3蛋白表达下降,其中12 h组下降最为显著;72 h组升高至正常水平;死后挫伤组皮肤组织中Beclin1、LC3蛋白表达无明显改变(图2)。
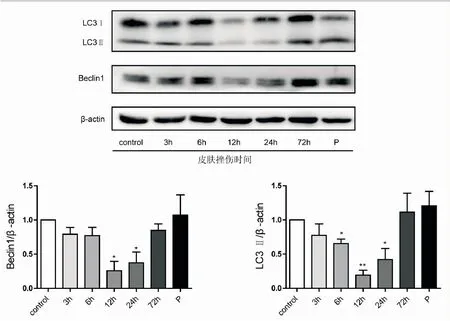
图2 挫伤皮肤组织中Beclin1和LC3蛋白水平检测
3 讨 论
损伤时间推断是法医病理学领域一直未解决的问题之一。研究人员通过酶组织化学、免疫组织化学、分子生物学等方法检测机体损伤后各种炎症因子、化学因子、生活活性酶、生长因子等的表达并结合损伤的形态学变化,筛选呈规律性表达的标记物,可以为损伤时间推断提供良好依据[4]。但在法医学鉴定实践中,人体皮肤损伤的位置、范围多变且损伤程度不一,损伤后会受体内外多种因素的影响,很难寻找到有确切时间变化规律、并能应用于法医鉴定的某种或某类生物学标记物。因此寻找与损伤时间具有相关性的标记物仍是法医学研究的重点。
细胞自噬是真核生物普遍存在的自稳机制,细胞通过启动自噬清除胞内受损的蛋白质、细胞器或入侵的病原体等,利用溶酶体途径降解、回收利用降解产物以维持细胞稳定。细胞自噬与皮肤损伤愈合过程关系密切。目前有关自噬与皮肤损伤的报道尚少[5]。赖红梅等在小鼠切创的动物模型中发现Beclin1、LC3转录水平与蛋白表达水平具有相似规律:小鼠皮肤损伤后1 h升高不显著,6 h升高较显著,24 h到达高峰,48 h至72 h有所下降,切创皮肤组织中Beclin1、LC3的整体水平高于正常皮肤组织[6]。Asai等通过免疫荧光计数LC3阳性自噬点方法观察皮肤创面愈合过程中自噬发生的情况,发现伤后7~9天成纤维细胞存在高水平的自噬[7]。但Kimura等研究小鼠皮肤损伤后较短时间内(24 h内)自噬蛋白LC3和p62的表达情况,结果显示损伤0.5 h后LC3表达下降,p62相对量增加,说明皮肤损伤抑制了局部的细胞自噬[8]。皮肤损伤后细胞自噬的情况,上述各类实验结果表现出了差异,仍有待进一步研究。
本研究通过建立大鼠皮肤挫伤模型,采用RT-qPCR和Western blot方法从转录水平、蛋白水平研究自噬相关分子Beclin1、LC3的表达变化。结果显示Beclin1、LC3 的mRNA和蛋白表达呈现相似的变化规律,随挫伤时间延长呈先降低后升高并接近对照组水平的趋势,其中Beclin1、LC3的mRNA水平分别在挫伤6 h、12 h组下降显著,24 h、72 h组均升至正常水平;Beclin1、LC3蛋白含量挫伤后24 h内表达下降,在12 h降低显著,72 h恢复至正常水平;死后挫伤皮肤组织自噬相关分子表达无显著变化。说明皮肤损伤后较短时间内细胞自噬被抑制,与前述Kimura的实验结果一致,而随着伤后时间的延长,细胞自噬水平升高。我们认为细胞自噬参与了皮肤损伤后修复、愈合的过程,在损伤后的不同阶段发挥了不同作用。同时,Beclin1、LC3的表达与皮肤损伤时间具有一定的相关性,可以为皮肤损伤时间推断提供参考依据。但本研究仅采用动物模型进行观察,缺乏人体样本验证,实际检案中皮肤的损伤不同于实验动物模型, Beclin1、LC3作为损伤时间推断标记物在实践中的有效性仍有待验证。
