中心静脉导管用于胸、腹腔积液引流的使用风险
2020-05-20
1.江苏省药品不良反应监测中心,江苏 南京 210002;2.国家药品监督管理局 药品评价中心,北京 100022
引言
中心静脉导管,通常以组包类产品形式供销,其基本组成有中心静脉导管、导丝(带助推器)、扩张管、肝素帽、移动限流夹、穿刺针、无菌注射针等,主要适用范围为经外周静脉进入中心静脉系统,进行持续或间断性静脉输液、输血或血液制品、监测中心静脉压力和/或全肠外静脉营养,同时还可允许进行中心静脉压监测、采集血液样本。导管内有多腔设计,便于同时进行以上数种程序。
近年来,中心静脉导管用于胸、腹腔积液引流的使用方法,由于操作方便、组织相容性好、患者舒适度高等优点,在医院临床逐渐普及[1-2]。通过检索国内外中心静脉导管有关产品注册证的适用范围,无一标明可用于积液引流。本文对江苏省2015—2018年收集到的中心静脉导管用于胸、腹腔积液引流有关的病例报告进行统计,结合对近20年有关文献资料的分析,对该种用法的风险与受益进行分析研究。
1 资料与方法
1.1 资料来源
2016年1月1日至2018年12月31日,江苏省药品不良反应监测中心收集到的中心静脉导管用于胸、腹腔积液引流的可疑不良事件报告。检索中国知网数据库,时间范围1999—2018年的文献,主题选取“中心静脉导管”并含“引流”,共检索到2661篇期刊论文。
1.2 方法
采用描述性研究分析方法,依托江苏省医疗器械不良事件监测数据库,运用Microsoft Excel软件,从病例数、产品来源、不良事件表现等方面进行统计和分析。将2661篇文献导入知识可视化软件VOS viewer,选择最小共词数为20,得到131个关键词,删除同义词频后,将余下51个形成主题聚类标签图,考察对中心静脉导管用于胸、腹腔积液引流的相关风险。
2 结果
2.1 不良事件情况
(1)不良事件数据情况。近三年,江苏医疗器械不良事件监测数据库共监测到中心静脉导管相关可疑不良事件共403例,其中用于胸、腹腔积液引流的病例共有58例。被动监测无法获知使用人群综述,无法估算不良事件发生率,以及引流用途的产品数量所占总数量的比例,相关数据,见表1。

表1 2016—2018年中心静脉导管不良事件情况(例)
(2)产品来源与预期用途。对58例中心静脉导管用于胸、腹腔积液引流的产品来源进行统计,49例为国内产品,9例为进口产品;对有关病例的预期用途进行统计,用于胸腔积液引流44例,腹腔积液引流10例,心包积液引流2例,用于治疗自发性气胸1例,相关数据,见表2。

表2 不良事件的产品来源与预期用途情况(例)
(3)不良事件表现情况。对58例中心静脉导管用于胸、腹腔积液引流的产品不良事件表现进行统计,伤害表现主要为积液无法持续引流、延误治疗和增加患者痛苦,还有形成局部皮下气肿2例,皮肤瘙痒1例。导管问题共43例,主要故障表现为堵塞、折叠、压扁不能回弹、断裂和渗漏;疑似质量问题共7例,豁免不良事件报告共5例。相关数据,见表3。
2.2 文献计量学研究
(1)年度分析。按照年份来看,文献数量从2003年开始逐年递增,到2011年达到263篇,随后文献数量逐年锐减,2018年年发表数量不足100篇(图1)。

表3 不良事件中器械故障情况(例)

图1 相关文献逐年发表数量
(2)机构分析。论文的研究机构涉及全国各个省、市、地区,各个等级的医疗机构,发表文献数量前十名的研究机构,见图2。从图2可以看出,排名前三的是新乡医学院第一附属医院(20篇)、河南省肿瘤医院(16篇)、山东省胸科医院(16篇),均为三级甲等医院。

图2 发表文献数量前十名的研究机构
(3)文献剂量学分析。对文献题录进行可视化分析,同时进行聚类,如图3所示结果可划分为四大领域,分别是对中心静脉导管的主要预期用途、次要预期用途、不良事件表现(器械故障和伤害表现)以及护理注意点,可视化分析,见图3。
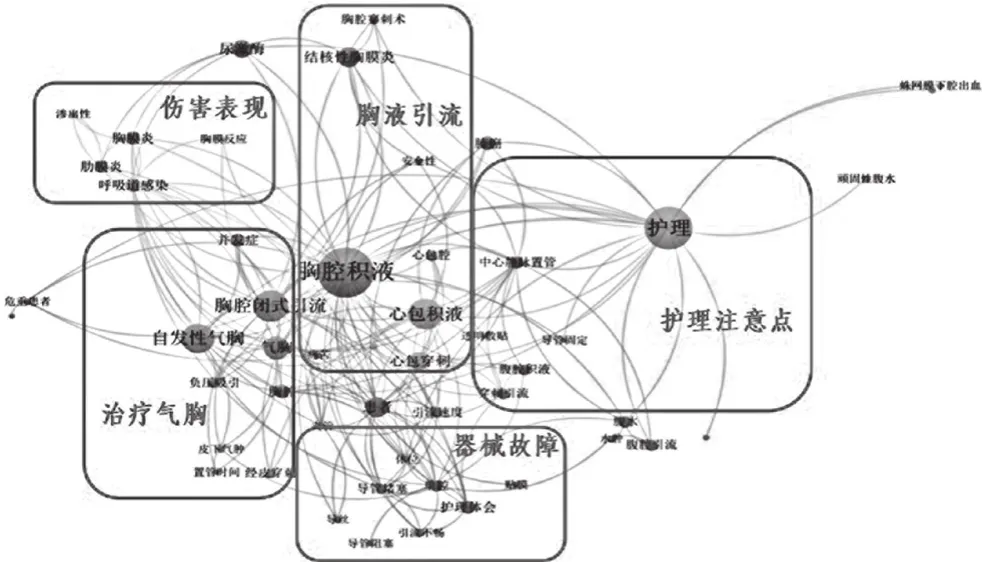
图3 相关文献可视化分析
3 讨论
(1)可视化分析结果。分析共词分析图谱,可得出对已有文献系统化研究的热点如下:① 主要预期用途为胸腔引流、腹腔引流和心包引流,可知国内大量研究工作关注于引流目的[3-4];② 除引流外,中心静脉导管还可用于治疗自发性气胸;③ 基于数据挖掘算法,本研究发现中心静脉导管用于引流时的器械故障为导管堵塞、引流不畅、导丝问题等,伤害表现主要有胸膜反应、渗出物、呼吸道感染等;④ 当前临床上的护理注意点主要集中在引流的速度、患者体位和导管固定上[5],这些注意事项获得大量研究者共识。
(2)不良事件情况。孟令香[6]报道了64例中心静脉导管用于引流的患者中,产生费用纠纷2例,术前准备不到位致术中突发事件应对不及时1例,置管后观察不到位致虚脱3例,伤口敷贴观察不到位发生渗液、皮肤过敏疱疹、伤口感染等5例,注意事项告知无效2例,胸腔积液不符合消毒要求4例,不良事件发生率大概为26%,并提出如果术前体征监测的设备准备不足,术中发生胸膜反应,患者可能会存在生命危险。袁小兰等[7]报道中心静脉导管小且轻,张力性气胸胸内压力大,容易将导管顶出胸腔而造成引流失败,不能用于张力性气胸。还有文献认为,导管的内径小,结核性胸腔积液引流通畅,但是恶性胸腔积液含絮状物,易堵管,如果无液体引流出来时,排除体位不当,用生理盐水正压冲洗管道,使之恢复通畅[8]。彭朝华等[9]比较了中心静脉导管引流与常规胸腔穿刺控制恶性胸腔积液的并发症,均出现发热、消化道反应、胸痛、包裹性积液及包裹性气胸,未见新的不良事件。
(3)企业调研结论汇总。在进行风险研究的过程中,通过与江苏省内企业交流,了解到中心静脉导管用于引流的风险点如下:① 功能差异,中心静脉导管的主要用途为输注及测压,在正常使用过程中是正压液体进入血管,如果用于引流,会造成胸腔内部负压容易导致导管塌陷打折;② 使用部位差异,且穿刺部位较为平坦,不会因为肢体的活动造成导管异位打折;③ 适用人群不同,如果患者有咳嗽症状,致胸腹腔压升高,可使导管在胸腹腔内发生异位、折叠、扭曲;④ 结构设计差异,一是中心静脉导管的管腔很细,特别是双腔和三腔,如果患者胸腔积血量大,或积液黏稠,可能引起引流不畅或者堵塞;二是部分规格的中心静脉导管的导管尺寸过短,容易导致移位脱落而造成引流不完全。
4 建议
(1)监管部门应提升风险警示。建议监管部门应进一步强化追溯机制,为产品问题发现与报告评价扫清障碍,督促生产企业在报告中完善患者、中心静脉导管的基本信息、伤害术语和使用过程,有利于分析和评价产品不良事件的发生原因;建立健全预警监测系统,搜集国内外的不良事件信息,及时发布医疗器械不良事件警示信息,督促相关企业采取修改说明书、加强培训等相应的控制措施;会同卫生行政部门,落实规范临床使用医疗器械的法规制度,降低产品固有风险和使用风险。
(2)生产企业应加强风险告知。生产企业一方面应改进产品设计,从材料选择、结构设计、说明书警示、配套工具包等角度不断提升产品安全性[10-11];另一方面,应加强风险告知,如修改中心静脉导管说明书,增加产品用于胸腔引流的禁用、慎用标识或注意事项,如标明首次引流量、每日引流量和引流速度,同时要关注引流时的患者体征项目和不良事件发生时的处理措施[12-13]。企业还应建立不良事件报告收集渠道和事件处理制度,及时采取风险管理措施,主动上报不良事件。
(3)使用单位应规范临床操作。建议使用单位加强培训与管理,医务人员应掌握规范的手术要求与操作技术,按照说明书要求合理用械,制定科学合理的治疗方案。根据临床实际,结合患者使用耗材次数、住院时间和X射线显影的经济成本,选用产品说明书中“适应症”中包含“积液引流”用途的留置引流管(俗称“猪尾巴”管);并配备多种规格、型号的引流管,应对不同部位、不同体征、不同预期用途的疾病情况[14]。有学者[15-16]报道了传统经皮穿刺针抽吸的结果与留置引流管引流的治疗效果荟萃分析,结果显示留置引流管引流组的成功率更高,需要更少的时间来实现临床改善,并且腔体尺寸减小50%,传统经皮穿刺针抽吸组并发症发生率低于留置引流管引流组。使用单位还应积极填报不良事件报告,发现突、群发的问题立即上报。
综上,中心静脉导管的功能、使用部位、适用人群、结构设计等方面,均不能确保用于引流用途时,可以安全且有效。因此,中心静脉导管用于积液引流,属于超适应症范围使用的情形。相关生产企业应尽量告知临床,该产品用于引流时可能存在的使用风险,并从材料选择、产品构造、说明书警示等角度不断提升产品安全性能。使用单位应严格按照说明书指导,在产品注册范围内规范用械。
