化学腐蚀对碳化硅纳米线的光致发光性能的影响
2020-05-19雷思洁王冬华
雷思洁,王冬华
(渭南师范学院 化学与材料学院,陕西 渭南 714099)
材料对于人们的生活必不可少,随着人们对材料要求的不断提高以及科技的不断发展许多新型材料也随之出现。纳米材料就是众多新型材料中的一种。纳米材料指的是在纳米尺度(1~100 nm)内调控物质结构制成的具有特异性能的材料。纳米材料性质上的变化是由晶体表面原子数与总原子数之比随着粒径变小而急剧增大而引起的。因此纳米材料相比于其他材料来说有着很多优势。碳化硅因其优异的物理、化学和电学性能、良好的强度、化学稳定性以及优异的抗氧化和抗热震能力[1-3]。相比于常规碳化硅而言纳米碳化硅受到低维数,量子限域效应以及特殊的形状的影响,因而具有优异的力学性能,光电特性,化学惰性和生物相容性等,因此纳米碳化硅被广泛应用于半导体器件、机械制造、航天工业、生物材料及陶瓷膜等众多领域,也是化学反应中一些催化剂载体的较理想材料。被成功的应用在一些比较重要的化学反应当中,显示了长远的应用前景。现如今对技术要求较低的碳化硅粗料已能大量供应,而对技术要求极高的纳米级碳化硅还不能大量供给。因此对纳米碳化硅的研究至关重要。
目前,已有多种制备SiC纳米材料的方法,如:等离子体法[4]、溶剂热法、模板法、气相沉积法[5]、碳热还原法[6]、电弧放电法[7]等。与这些方法相比,溶胶-凝胶法即能将纳米材料前驱体在特定的条件下水解,生成溶胶,之后将溶剂挥发形成凝胶,再经过加热干燥高温热处理等方法制备所需纳米材料。张洪涛等人就采用此方法制备了高纯度且含氧量低的β-SiC[8]。并且溶胶-凝胶法具有合成温度低,反应更容易进行,产率高等特点,并能在短时间内获得分子水平的均匀性及分子水平之上的均匀混合。且设备和实验操作简单,实验成本低。因此,该方法在陶瓷、玻璃、生物材料、催化剂载体、薄膜、以及复合材料等领域得到广泛应用。碳热还原法是在一定温度下用无机碳作为还原剂进行氧化还原反应的方法。这种方法可以通过改变反应物的种类、加热方式、加热温度和保温时间以及保护气体气流大小等参数控制反应速率,以此达到制备纯度较高、粒度较小的样品的目的。由于该方法原料成本低、实验反应简单,适用于大规模生产[9]。
有许多材料都能用于纳米碳化硅的制备,近年来研究者们也出于各种因素的考虑,例如价格低廉、产率高、对环境污染小等,尝试选择用不同的碳源材料。石墨粉的主要成分为碳并且石墨粉的颗粒细小与其他做碳源的原料相比具有更易反应与反应更加完全的特点,并且石墨粉的价格低廉容易购置。以高产、高效、快捷的条件来衡量选择石墨作为碳源十分合适。近年来研究者们已经通过不同的方法制备了不同形貌的碳化硅纳米线,例如:竹节状纳米线[10]、连珠状纳米线[11]、纳米弹簧[12]、项链状纳米线[13]等。除此之外也可将碳化硅样品进行一定程度的刻蚀,会得到不同形貌和结构的碳化硅材料,以满足在不同领域的特殊应用。对碳化硅的刻蚀一般有干腐蚀和湿腐蚀两种方法。干腐蚀法即指在没有水(包括但不限于液体水,水溶液或水蒸气)接触的情况下,引起的腐蚀或者氧化现象。干腐蚀法具有特殊的化学成分,因此在腐蚀过程中的选择性低,。例如:Lauermann[14]等采用干腐蚀的方法对所制备的碳化硅进行腐蚀,并研究其反应机理;Shor[14]等也使用干腐蚀法对所制备的碳化硅进行腐蚀,使其能达到制备特殊电子装备的要求。干腐蚀会极大的破坏原样品的材料结构[15]。相对于干腐蚀法,湿腐蚀法(指金属在有水存在下的腐蚀)对材料的结构破坏力小,选择性高。因此,湿化学法被用于对常规碳化硅进行腐蚀,而获得不同结构的纳米碳化硅材料。例如:Goknur[16]等选用湿腐蚀的方法对所制备的碳化硅进场腐蚀,得到了具有规则形貌的碳化硅,并讨论了腐蚀之后碳化硅纳米线不同部分的腐蚀状况。因此本实验采用湿腐蚀的方法对所制备的碳化硅进行腐蚀。可得到结构和性能明显不同的SiC材料。通过湿腐蚀法制备出来的纳米碳化硅具有特殊形貌,有一定的潜在价值。例如:腐蚀之后的纳米碳化硅能够用于制备灵敏电感器,医学上的探针或者捕获一些小尺寸的分子或者纳米粒子使其结构性能发生明显改善等[17]。
本实验采用石墨作为碳源,正硅酸乙酯(TEOS)作为硅源,硝酸铁作为催化剂采用溶胶-凝胶法和碳热还原法制备SiC纳米材料,并利用湿化学法对所得碳化硅纳米材料进行腐蚀。经过腐蚀之后发现碳化硅纳米线发生了选择性腐蚀,孪晶晶界间的立方相β-SiC碳化硅被腐蚀,但孪晶晶界却几乎没有发生改变。我们对腐蚀之后的纳米线进行探讨,研究其中的反应机理,腐蚀前后的形貌以及纳米结构的光致发光特性。
1 实验部分
1.1 实验药品
无水乙醇(CH3CH2OH),成都市科龙化工试剂厂;硝酸铁(Fe(NO3)3)、草酸(C2H2O4)、浓盐酸(HCl),天津市天力化学试剂有限公司;氢氟酸(HF),上海化学试剂有限公司;正硅酸乙酯(TEOS),天津市科密欧化学试剂有限公司;六次甲基四胺(C6H12N4),天津市福晨化学试剂有限公司;浓硝酸(HNO3),天津市富宇精细化工有限公司;石墨粉(C),天津市登科化学试剂有限公司。
1.2 实验仪器
X射线衍射仪(XRD日本岛津6100型);红外光谱仪(TENSORⅡ);场发射扫描电镜(FESEM Zeiss SIGMA 500型);高温管式炉(SGL-1600,上海大恒光学精密机械有限公司);荧光光谱仪(PLF-7000,日本日立公司);箱式电阻炉(上海锦凯SXJK8-13);恒温干燥箱;集热式恒温加热磁力搅拌器;电子天平。
1.3 碳化硅的制备
第一步:用称量纸在称量天平上称取15 g石墨备用,分别配置浓度为3.4%的草酸溶液和浓度为38.5%的六次甲基四胺溶液备用。
第二步:用称量纸称取3 g硝酸铁放入烧杯中加入100 mL无水乙醇后用磁力搅拌器搅拌直到硝酸铁完全溶解再加入50 mL正硅酸乙酯,用磁力搅拌器搅拌均匀后逐滴加入10 mL草酸溶液,用保鲜膜密封再均匀搅拌30 min(转速为600 r/min)。
第三步:向上述溶液中加入15 g石墨粉,再加入100 mL无水乙醇,用磁力搅拌器密封搅拌24 h后,逐滴加入10 mL六次甲基四胺,密封搅拌至凝胶状态,把保鲜膜打开一段时间,将得到的凝胶放入干燥箱中干燥7~8 h(温度为110℃烘干为止)。
第四步:将第三步得到的干凝胶样品研磨成粉装入瓷舟中放入通有氩气为保护气的管式炉中煅烧12 h(设定温度由室温升至反应温度1350℃用时5 h;1350℃恒温5 h;最后温度从1350℃降到500℃用时2 h等到温度降到500℃后关闭管式炉。在此过程中当温度上升到1000℃时要适当加大保护气流)。
第五步:待样品在炉内冷却至室温后取出,移至马弗炉中继续进行煅烧,将炉温设置为800℃(升温速率设置为20℃/min)持续煅烧2 h然后在炉内冷却至室温后取出,接着将样品置于塑料瓶中,用浓盐酸和氢氟酸为1∶3的比例酸化24 h,将酸化过后的样品用大量去离子水抽滤至中性,放入干燥箱中烘干。
第六步:重复第五步的操作步骤,等到样品完全冷却后,将样品装入干净的试剂瓶中,最终得到浅绿色的SiC样品。
第七步:将所得的一部分SiC样品放入塑料瓶中,用浓硝酸和氢氟酸比例为1∶3的比例腐蚀(在此过程中先加入浓硝酸)并将塑料瓶置于水温为80℃的水浴锅中腐蚀30 min。将腐蚀过后的样品用大量去离子水抽滤至中性,放入干燥箱中烘干。等到样品完全冷却后,将样品装入干净的试剂瓶中,最终得到颜色更浅的SiC样品。
1.4 产物的表征
1.4.1 X射线衍射分析(XRD)
通过XRD对制备的样品进行晶体衍射从而对其进行物质分析,以测定所制备的碳化硅样品纯度。测定条件为:铜靶,扫描速度为5°/min,2θ角扫描范围为10~80°,步长为0.02°。
1.4.2 场发射扫描电子显微镜(FESEM)
用扫描电子显微镜对腐蚀前后的碳化硅样品进行测定,因为扫描电镜的放大倍数约为原信号的20万倍左右,能对样品进行形貌,微区分析和晶体结构等多种微观组织结构信息的同位分析。通过扫描电镜的分析我们能清楚的观察到腐蚀部分的分布情况与腐蚀之后的形貌。
1.4.3 红外光谱分析
因为不同化学键对红外的吸收程度不同,用红外测得光谱后与标准图谱进行对比可研究碳化硅样品腐蚀前后化学键是否出现了变化。
2 结果与讨论
2.1 X射线衍射分析
SiC样品腐蚀前后均为浅绿色粉末,但腐蚀之后的颜色较浅。由图1可以得出,衍射谱图中各峰对应的2θ值分别为35.6°、41.4°、60.0°、71.8°、75.6°。这五个较强的衍射峰与立方晶型β-SiC的(111)、(200)、(220)、(311)、(222)的衍射面所对应[18],并且SiC样品腐蚀前后所测得的XRD图谱具有相同的特征峰并且没有其他特征峰出现,说明所制备的SiC样品腐蚀前后均为纯净物并无其他杂质存在。
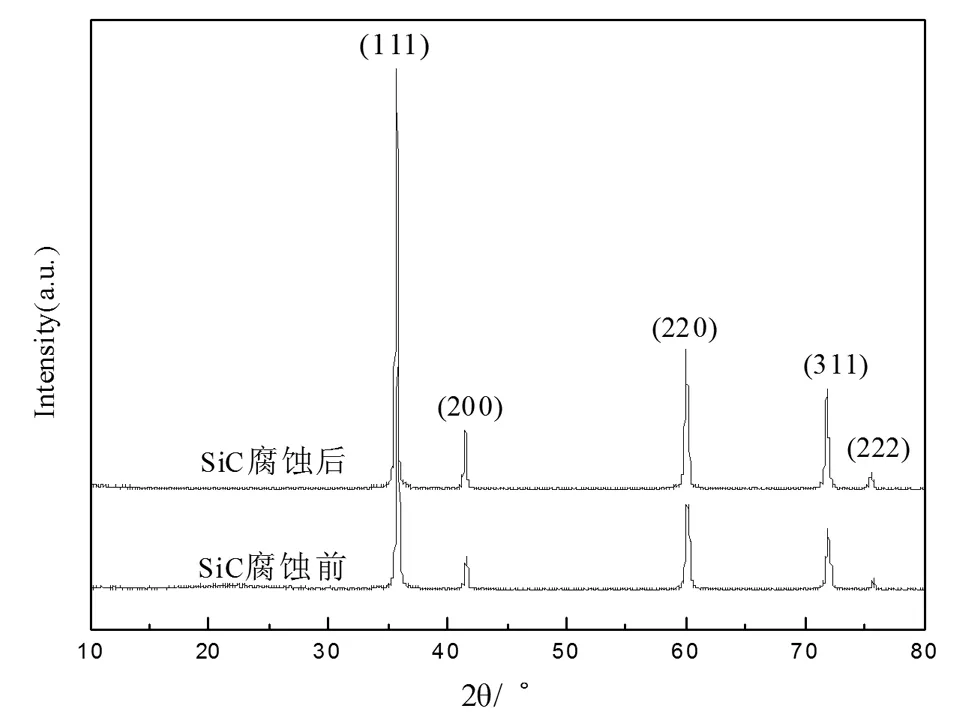
图1 腐蚀前后SiC样品的XRD谱图
2.2 样品形貌分析
如图2所示图中(a)、(b)表示的是未腐蚀之前的SiC样品的场发射扫描电镜照片。从图中可清晰的观察到纳米SiC样品为不规则团聚在一起的蠕虫状的纳米线。纳米线的直径在60~100 nm之间,长度为几个微米。而且每条纳米线的方向存在差异;还可以看出纳米线表面有凸起的现象。图(c)、(d)表示的是腐蚀之后的SiC样品的场发射扫描电镜图。从图中可以清楚的观察到腐蚀之后的纳米SiC样品仍为蠕虫状的纳米线且存在团聚现象,长度处于1~8 μm之间。在电镜下可清楚的观察到纳米线被酸腐蚀后出现了明显的片状结构,片层的直径约为几十纳米,片层厚度约为3 nm,片层之间的部分直径明显减小,这说明样品发生了选择性腐蚀,其原因可能为:
SiC + 2HNO3+2H2O → SiC4++ 4OH-+ 2HNO2(1)
SiC4++ 4OH-→SiO2+ CO2+ 2H2(2)
SiO2+ 6HF → H2SiF6+ 2 H2O (3)
总反应式为:SiC + 2HNO3+ 6HF → H2SiF6+ 2HNO2+ CO2+ 2H2(4)
在80℃的硝酸环境中,完好晶型的β-SiC表面被氧化,生成二氧化硅,同时放出二氧化碳及氢气,而二氧化硅则被氢氟酸溶解[16]。而晶体缺陷部分由于具有较强的抗腐蚀能力,在混合酸中并未被腐蚀,因此经过混合酸的腐蚀后出现了图中的结构。
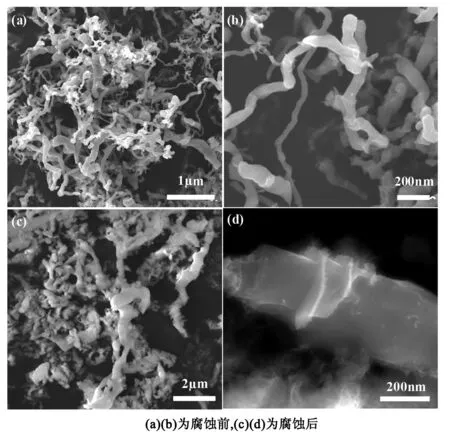
图2 腐蚀前后SiC样品的扫描电镜图
2.3 红外光谱分析
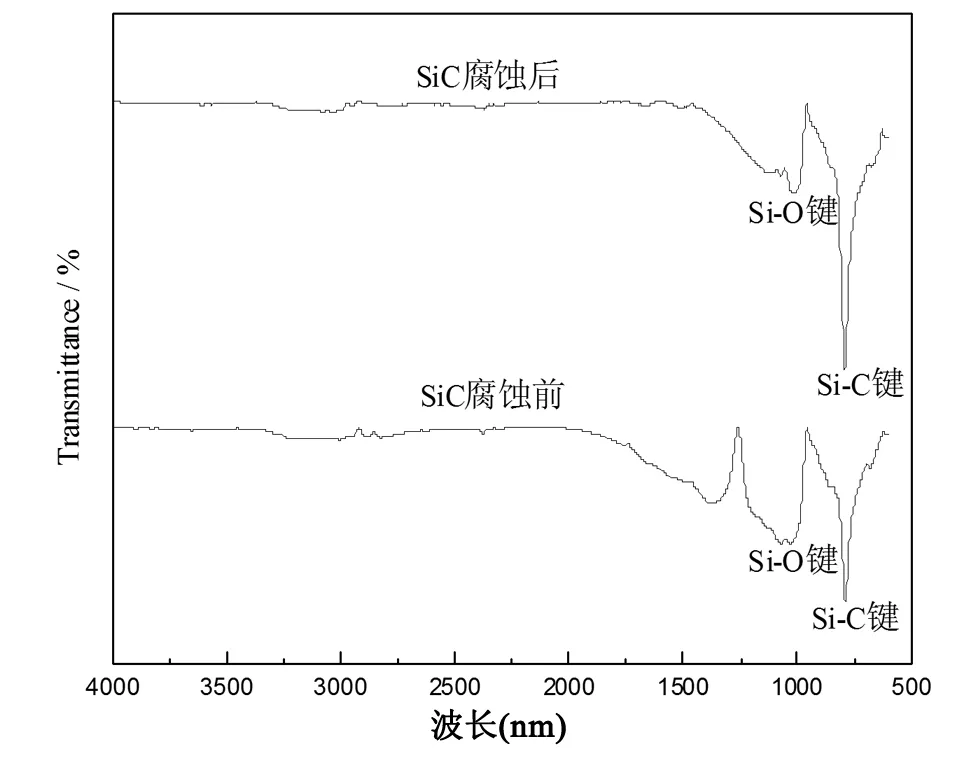
图3 腐蚀前后SiC样品的红外光谱图
图3是SiC纳米材料在混合酸腐蚀前后的红外谱图,从图中可以清楚的发现在770~970 cm-1附近腐蚀前后皆存在明显的特征吸收峰,此特征峰是由于Si-C键的振动吸收而产生的。因为样品经酸腐蚀后,一部分Si-C键被破坏,所以腐蚀后的特征峰值较小。在1000~1100 cm-1也存在一个特征峰,此峰为Si-O键的特征吸收峰,腐蚀前Si-O键的出现是由于纳米SiC颗粒直径较小,具有较高的表面能和比表面积,且在煅烧过程中极易被氧化形成SiO2薄膜[19]。腐蚀后Si-O的出现是由于反应过程中有SiO2生成,很大一部分与HF酸发生反应,但反应不完全,所以Si-O吸收峰强度较小。由图观察可得到在1100 cm-1处有一个弱的吸收峰,此峰是由于Si-O键的不对称伸缩振动引起的[20]。在3500 cm-1附近出现因物理吸附水而产生的-OH键特征吸收峰。
2.4 光致发光性能
图4 中的(a)、(b)为不同激发波长下SiC纳米材料腐蚀前后的光致发光图谱。从图中可得出,在相同激发波长下,样品腐蚀前后的发射中心发生了变化。对比在相同激发波长下SiC纳米材料腐蚀前后的光致发光图谱,可以得出,两者都有十分明显的发射峰出现,且发射峰的位置及发射峰强度有明显差异。由于腐蚀前的SiC样品具有良好的晶型,所以腐蚀前的SiC发射峰的强度较大。一些材料科学家认为:纳米碳化硅晶体的形貌不同,光致发光特性会有较大的区别[21-22]通过图谱对比可知,影响SiC光致发光特性的主要因素是样品的结构缺陷。原因是混合酸腐蚀掉了碳化硅纳米中的完整晶体,导致碳化硅纳米线由完整结构变为片状结构。从表1可以看出当激发波长由290 nm增加到340 nm时,腐蚀前发射峰的中心位置由375 nm减小到367 nm,腐蚀后发射峰的中心位置也由381 nm减小到370 nm。由数据分析可知,SiC样品腐蚀前后均发生了蓝移现象,但腐蚀后的蓝移现象更为明显。这可能是由所制备的样品缺陷引起的[23]。从表2可以看出当激发波长由290 nm增加到340 nm时,腐蚀前发射峰的强度由0.357增加到0.943。腐蚀后发射峰的强度由0.299增加到0.924。由数据分析可知,SiC样品腐蚀前后的发射峰强度都是随着激发波长的增加而增加的。腐蚀前的发射峰强度均大于腐蚀后的发射峰强度。这是由于腐蚀后一部分SiC被破坏,导致发射峰的强度降低。
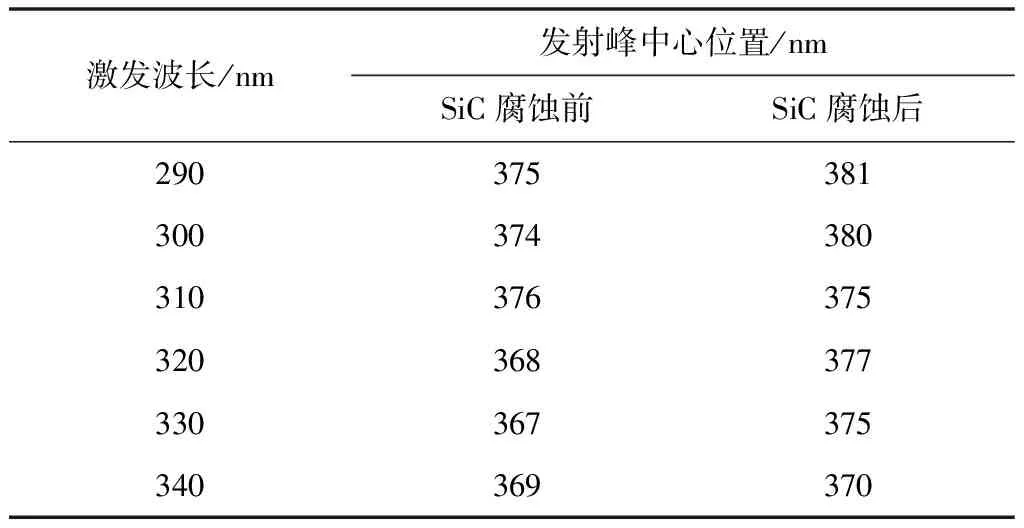
表1 腐蚀前后SiC样品不同激发波长下发射峰的中心位置
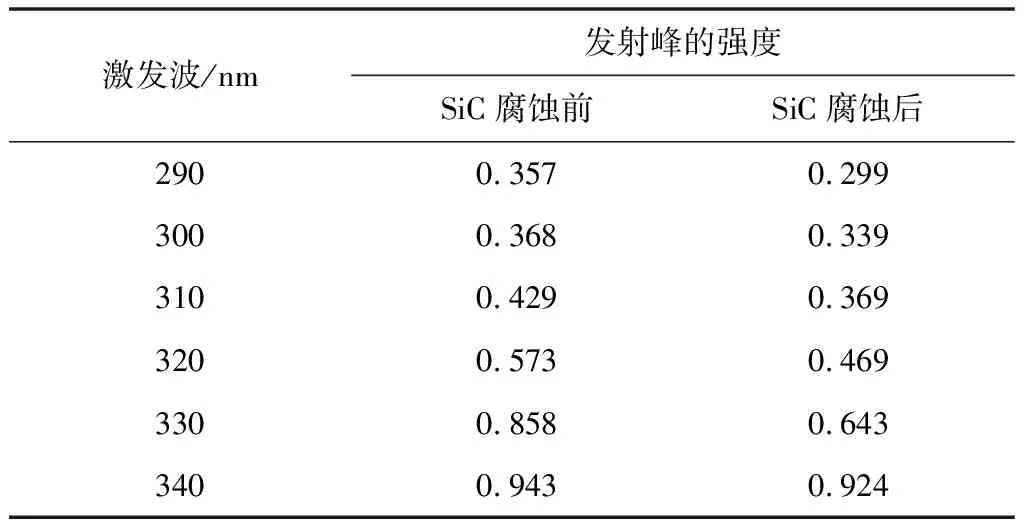
表2 腐蚀前后SiC样品不同激发波长下发射峰的强度
3 结论
(1)本实验以石墨粉作为碳源,正硅酸乙酯作为硅源,采用溶胶-凝胶法与碳热还原法来制备SiC纳米材料。用比例为1∶3的浓硝酸和氢氟酸对所制备的样品进行腐蚀。
(2)使用XRD检测得到SiC纳米材料发现其特征峰明显,且无其他杂峰出现,表明制备的样品为纯净的SiC纳米材料。对样品形貌进行分析发现酸腐蚀前后SiC的形貌差异大,纳米线的直径与长度有明显变化。
(3)通过对发射峰中心位置的分析,得出造成SiC光致发光性能的主要原因是晶体的结构缺陷。结构缺陷较多时,会使纳米材料表面满足量子尺寸效应发生的条件,从而使发射峰的中心位置发生明显的蓝移。
