大脑衰老过程中的免疫学机制研究进展
2020-05-19李基民王文杰尹秋丽戎瑞雪
李基民,王文杰,尹秋丽,戎瑞雪
(河北大学医学院,河北 保定 071000)
0 引言
脑神经元发生(Brain Neurogenesis)在人和小鼠的海马齿状回区(Dentated Gyrus of Hippocampus)和脑室下区(subventricular zone SVZ)普遍存在,且随年龄的增长而减弱[1-3];这一现象与记忆力减退、认知障碍等多种神经退行性变化有关[4]。具体的相关机制目前并不清楚,但最新的研究发现衰老个体大脑小胶质细胞激活量增加从而对海马齿状回区神经元发生产生影响,这一现象与大脑内皮细胞(Brain Endothelial CellsBECs)表面的粘附分子VCAM-1(CD106)有关[5]。另有研究团队通过对不同年龄小鼠的SVZ 进行单细胞RNA 测序,发现老年个体这一区域存在T 细胞浸润,同时发现浸润的T 细胞是克隆扩增的,这表明它们可能经历了特定抗原刺激[6]。这暗示,脑神经元发生随年龄增长而减弱并表现出认知障碍可能与免疫系统有关。基于这两项发现,下面将就VCAM-1 的相关研究和T 细胞对神经元的影响进行总结。
1 VCAM-1
1.1 分布、表达和功能。血管细胞粘附分子-1(Vascular cell adhesion molecule-1,VCAM-1/CD106)是Ig 超家族中的Ⅰ型跨膜糖蛋白,分子量100-110kDa,含有674 个氨基酸,广泛分布于活化的内皮细胞、平滑肌细胞、巨噬细胞及成纤维细胞等细胞表面;其配体为VLA-4(α4β1),主要分布于白细胞表面[7-9]。此外VCAM-1 可以被膜结合金属蛋白酶ADAM17 水解,组成性地脱落,产生可溶性VCAM-1(soluble VCAM-1 ,sVCAM-1)[9]。VCAM-1 在 体 内 炎症反应部位的内皮细胞上调,促进白细胞通过整合素受体VLA-4 连接并转移到组织中[10]。
关于VCAM-1 的表达调控,现有的研究发现在LPS 刺激人脐静脉内皮细胞后可激活PI3K/Akt 信号通路,p-PI3K、p-Akt 快速增加,并上调 VCAM-1 表达。使用PI3K 和Akt抑制剂后发现二者可以浓度依赖性抑制 VCAM-1 表达,也可以抑制VCAM-1mRNA 含量变化;该通路可以通过转录水平控制VCAM-1 的表达[11]。此外多种免疫调节因子作用相应细胞可激活NF-κB 通路,其单独或与其它因子协同作用,使VCAM-1 的表达增加[12]。
在VCAM-1 的功能方面仍在进行研究,目前认为VCAM-1 通过与相应配体VLA-4 特异性结合参与多种病理、生理过程[13-14]。总结主要有三个方面作用:
(1)参与免疫反应调节。白细胞穿血管内皮向炎症聚集是炎症反应中的重要生物学现象。VCAM-1 在白细胞的聚合、激发、牢固黏附和向炎症局部组织移行的各个过程中均起着十分重要的作用[13]。
(2)参与免疫应答。通过体外试验发现,VCAM-1 参与B 细胞的激活过程, 其可能是作为B 细胞的协同刺激分子而起作用[13-16]。
(3)参与淋巴细胞的归巢及再循环。炎症区域由于炎症因子的作用可促进血管内皮细胞表达VCAM-1,并与效应T 细胞和记忆T 细胞上的受体VLA-4 结合,所以T 细胞可优先归巢于炎症组织部位。另外,VCAM-1 还有参与细胞和组织的分化、发育以及肿瘤的扩散、转移等[15-17]。
1.2 VCAM-1 与大脑认知能力的关系。Tony Wyss-Coray等人的研究揭示了在海马区内皮细胞黏附分子VCAM1 在调节大脑衰老功能中的新作用。他们最初实验发现,年轻人或鼠的血浆注入老年个体循环系统可逆转老年个体认知功能和突触可塑性,反之老年人或鼠的血浆注入年轻个体循环系统会对年轻个体大脑认知能力产生损害[18]。进一步的研究结果使得科研人员得出假设:老年个体血浆中的炎症因子包括TNF-α 和IL-1β,诱导VCAM-1 在大脑内皮细胞(Brain Endothelial Cell,BEC)表达;VCAM-1 促进白细胞在该区域黏附,但不促进其迁移,从而维持BEC 炎症;发炎和活化的VCAM-1+BECs 向实质传递信号,激活小胶质细胞从而影响海马齿状回区神经元发生造成认知障碍[5]。
此前就有报道称,人在正常衰老过程中血脑屏障的主要细胞BEC 会上调表达VCAM-1[19],此外sVCAM-1 水平也随血液老化而增加[20-21]。目前尚不清楚介导该现象的具体循环因子,但可以证实的是随着年龄的增长,循环系统中细胞因子和对大脑有不利影响的趋化因子在血液中的水平增加,诱导内皮VCAM-1 的表达[5]。有趣的是,在680 名老年参与者中,sVCAM-1 水平与认知障碍和脑血管功能障碍呈负相关[22]。
值得注意的是,Tony Wyss-Coray 等人的研究团队利用VCAM-1 抗体对老年小鼠进行治疗,发现神经元发生水平改善、大脑功能障碍得到改善;同时实验VCAM-1 基因敲除的小鼠也观察到大脑衰老减慢的现象[5]。
Kokovay 等人结果表明,由于炎性细胞因子信号的增加,VCAM-1 在SVZ 的表达增加,亦会影响这一区域神经干细胞的增殖即神经元发生;心室内注射抗VCAM-1 抗体可激活该区域神经干细胞至增殖状态[23]。

图1 通过VCAM-1 激活海马区小胶质细胞
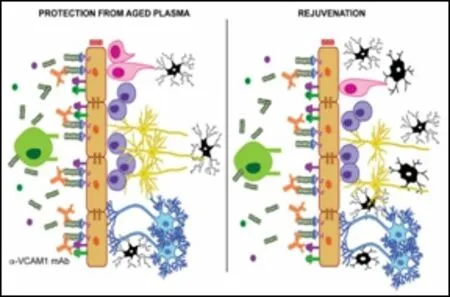
图2 应用抗VCAM-1 治疗、恢复
2 T 细胞
2.1 T 细胞迁移进入大脑实质和对神经元产生的影响。由于血脑屏障的存在,与大多数组织器官相比,血细胞进入大脑实质在很大程度上受到限制[24-26]。积累的证据表明,T 细胞在一些自身免疫性、传染性和退行性神经疾病中穿透进入中枢神经系统的实质[24-26]。与此同时我们不得不承认,中枢神经系统和免疫系统之间的相互作用存在平衡状态,以使免疫系统能够对抗入侵的病原体,同时防止该器官其重要功能和再生能力受到过度炎症性损伤[27]。
T 细胞进入中枢神经系统可通过直接穿过毛细血管和毛细血管后微静脉的血脑屏障,或间接通过脉络丛和蛛网膜下腔进入脑脊液的途径[28]。不管T 细胞进入中枢神经系统的途径如何,它的渗透依赖于许多涉及整合素、选择素和趋化因子的分子相互作用[29]。由T 细胞表达的α4β1 整合素与其配体血管细胞粘附分子(VCAM-1)和纤维连接蛋白之间的相互作用,似乎对有效穿透蛛网膜下腔的CD4+和CD8+T 细胞十分重要[30]。但是,两个T 细胞亚群,迁移到中枢神经系统的要求有显著差异。例如,脑内皮细胞组成性地表达MHC- I 类分子,因此仅允许抗原特异性的CD8 +T 细胞跨内皮细胞进入大脑实质[31]。此外,进入蛛网膜下腔的CD4+T 细胞需要由常驻抗原呈递细胞(APC)重新激活才能进入脑实质[32]。相关的具体机制目前仍在研究当中。
关于对大脑的不利影响,中枢神经系统内T 细胞和APC的激活导致局部释放炎症细胞因子和细胞毒性分子,如穿孔素、颗粒酶、死亡配体、一氧化氮、活性氧、谷氨酸等,可导致神经系统损伤[33]。这一过程在多种神经系统损伤疾病和大脑衰老过程中被证实[34-35]。
另一方面,神经元和T 细胞相互作用存在有利的一面。活化的人CD8+ T 细胞以直接接触但不依赖抗原的方式抑制轴突的生长,而活化的CD4+ T 细胞则可促进轴突的生长[36]。有趣的是,活化的T 细胞可以产生神经营养素,特别是脑源性神经营养因子[36-37]。
2.2 T 细胞在老年个体大脑中影响神经元发生。部分哺乳动物大脑中的神经干细胞集中于特定区域并与其他一些细胞共同构成神经源性小生境(neurogenic niches),随着年龄的增长,神经源性小生境的功能减弱,但该机制仍不清楚[38]。
Anne Brunet 的团队[6]近期通过单个细胞分析,观察到老年小鼠神经源性小生境内存在T 细胞浸润,这明显有别与年轻个体(如图3)。通过对这些T 细胞进行核酸分析,该研究团队发现它们是克隆增殖的;这极有可能是因为T 细胞识别出了老年大脑中的特殊抗原(如图4)。令人兴奋的是,该团队发现T 细胞可以通过分泌干扰素γ(Interferon-γ,IFN-γ),影响神经元发生。进一步研究发现T 细胞分泌的IFN-γ 在体内或体外均可对神经干细胞产生负面影响。
3 展望
随着年龄的增长,脑神经系统退行性改变的机制人们仍在不断研究。事实上,在神经元发生方面理解大脑衰老仅是其中一个方向。但是,近期Tony Wyss-Coray 团队及Anne Brunet 团队在海马齿状回区、SVZ 这两个大脑重要神经元发生区域的发现,令人兴奋。他们都为衰老期间神经元发生的下降提供了可能的原因,并提出了消除与年龄相关的认知障碍的途径。不论是阻断VCAM-1 还是阻断IFN-γ 来改善大脑状况,这些均在实验室小范围证实是可行的,但这些操作对于动物机体整体的影响尚不清楚,是否真正可行仍不明确,但这些足以让我们得到在改善和治疗大脑退行性病变方面的启发。
在物质世界中,生命是神奇的。在探索生命衰老这一问题上,人们孜孜不倦。科学就是在不断假设、推翻、证实中前进。科学家们在研究大脑衰老方面的脚步不会停止,更多的问题也会得以显现,它们等待着我们去解决。
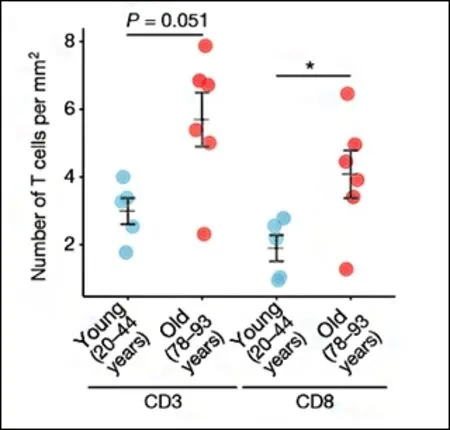
图3 不同年龄个体T 细胞在SVZ 的数量分布

图4 T 细胞核算分析
