烟草种子附生真菌群落结构与多样性
2020-05-18谢红炼汪汉成蔡刘体向立刚史彩华何永福
谢红炼 ,汪汉成,蔡刘体,向立刚, ,史彩华,何永福
1 长江大学农学院,湖北省荆州 434025;2 贵州省烟草科学研究院,贵阳 550081;3 长江大学生命科学学院,湖北荆州 434025;4 贵州省农业科学院 植物保护研究所,贵阳 550006
烟草(Nicotiana tabacumL.)是我国重要的经济作物,也是西南地区烟农脱贫致富的主要收入来源。我国烟草的产量和卷烟消费量均占全球市场的40%以上[1]。据报道,每年我国由烟草侵染性病害造成的损失在7亿元以上[2],其中,真菌性病害占侵染性病害的50%以上[3]。许多病原菌是由种子所携带的,病原菌通过附着在种子表面,或以病残体直接或间接混杂于种子之间,成为重要的病害初侵染源[4]和传播介体,每克烟草种子表面真菌数量可达2.0×103~3.8×104个[5]。已报道的烟草种传病害有:烟草立枯病、烟草炭疽病、烟草赤星病、烟草霜霉病等[6]。
前人利用分离培养的方法报道了烟草种子附生真菌有链格孢属(Alternariasp.)、茎点霉属(Phomopsissp.)、腐霉属(Pythiumspp.)、芽枝孢属(Cladosporiumspp)、曲霉属(Aspergillussp.)、镰刀菌属(Fusariumsp.)、青霉菌属(Penicilliumsp.)、赤霉菌属(Gibberellasp.)等[7,8,9]。但分离培养存在较大缺陷,仅能获得部分可培养真菌,且有研究表明纯培养获得的微生物种类只占环境微生物总数的0.1%-10%[10]。随着高通量测序技术的发展,Illumina高通量测序技术被广泛应用于环境[11,12]、肠道[13,14]、种子[15,16]等领域,但未见用于烟草种子附生微生物的研究。为此,本研究以4个品种的烟草种子(K326、云烟85、301和L8)为材料,采用Illumina高通量测序技术研究种子附生真菌的群落结构和多样性,以期指导烟草种子加工工艺。
1 材料与方法
1.1 样本采集
K326、云烟85、雪茄烟301及白肋烟L8裸种均由贵州省烟草科学研究院提供,未经洗涤,所有种子均于-80℃低温保藏。称取各品种裸种100 g,置于盛有250 mL无菌水的三角瓶中,170 r/min摇床震荡2 h后过滤获得种子洗涤液。将洗涤液10000 r/min离心10 min,弃除上清液,获得种子附生微生物样品,每品种3次重复。
1.2 样品DNA提取、扩增及测序
取上述种子附生微生物样品0.50 g,采用E.Z.N.A.® Soil DNA Kit(OMEGA)提取样品DNA,具体步骤按照其操作说明进行。利用NanoDrop 2000检测抽提DNA浓度和纯度,A260/A280值要求在1.8-2.0之间。
1.3 ITS文库构建及高通量测序
以样品DNA为模板,利用真菌rDNA ITS通用鉴定引物ITS1F (5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R (5’-GCTGCGTTCTTCATCGATGC-3’)对上述样品基因组DNA ITS区域进行PCR扩增,PCR反应体系(20 μL): 5×FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上、下游引物(5 μmol/L)各0.8 μL,FastPfu聚合酶 0.4 μL,BSA 0.2 μL和 DNA模板10 ng,ddH2O补足至20 μL。将反应体系置于ABI Gene Amp® 9700型PCR仪进行扩增,PCR反应条件:95℃预变性3 min,35个循环(95℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)回收纯化PCR产物,Tris-HCl洗脱,2%琼脂糖凝胶电泳检测PCR产物,将扩增产物送上海美吉生物医药科技有限公司,采用Illumina MiSeq测序平台进行测序,构建ITS文库。
1.4 测序数据处理与统计分析
测序原始数据使用Trimmomatic软件进行质控,使用FLASH软件进行拼接,根据重叠碱基将两端序列进行拼接,过滤掉重叠长度小于10 bp或错配比大于0.2的序列,根据序列首尾两端的引物和Barcode区分样品并调整序列方向,允许的Barcode错配数为0,最大引物错配数为2,去除存在模糊碱基的序列,得到优化序列。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),将序列以97%的相似度对进行OTU(Operational Taxonomic Units)聚类,同时去除单序列和嵌合体,生成OTU表格。利用RDP classifier(http://rdp.cme.msu.edu/)软件对序列进行物种注释,比对Unite(Release 6.0 http://unite.ut.ee/index.php)数据库,比对阈值为70%[17]。
以上述处理后的数据计算α多样性指数:Shannon指数、Simpson指数、Sobs指数、Ace指数、Chao指数等,进行α多样性分析;使用FastTree(version 2.1.3 http://www.microbesonline.org/fasttree/)软件以最大似然法构建进化树,然后利用FastUniFrac(http://UniFrac.colorado.edu/)软件得到样本间距离矩阵并绘制热图,进行β多样性分析;利用R语言进行PCA统计、作图,通过主成分分析比较样品间的差异,以此深入了解烟草种子附生真菌群结构与多样性。以上分析均在上海美吉生物医药科技有限公司I-Sanger生信云网站平台(http://www.i-sanger.com/project/index.html)完成[17]。
2 结果与分析
2.1 ITS序列测序深度分析
本研究对4组共12个烟草种子样品进行了测序。利用各样本在不同测序深度微生物Alpha多样性指数构建稀释曲线(图1),随着测序数量的增加,样本稀释曲线趋于平缓,当reads数在2500时,测序数据达到饱和,能够覆盖微生物群落的绝大部分真菌物种,为此,本次测序的数据量满足后续分析需求,继续增加测序量对样本信息的贡献很小。
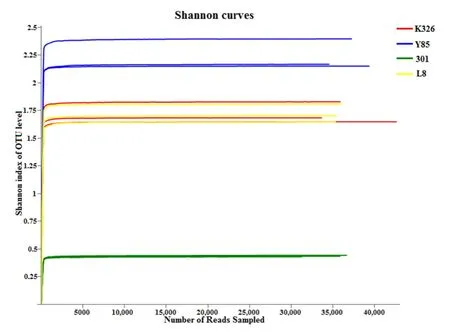
图1 稀释曲线(OTU水平Shannon指数)Fig.1 Rarefaction curve (Shannon index of OTU level)
2.2 数据质控
本次测序12个样品,经优化处理后,共得到高质量序列片段434358条,碱基共110915955个,序列平均长度为255 bp。其中,K326、云烟85、301和L8的样品分别得到112446、111395、103523和106994条高质量序列,28283847、27564919、26848028和28219161个碱基,序列平均长度分别为251、247、259、和 264bp。
2.3 OTU聚类分析
在97%相似度水平对样品序列进行OTU聚类,4个品种的烟草种子附生真菌共鉴定得出5个门、21个纲、43个目、74个科、131个属、193个种、227个OTUs。其中,K326的3个样品共鉴定得出3个门、12个纲、24个目、36个科、57个属、87个种、117个OTUs;云烟85的3个样品共鉴定得出4个门、19个纲、34个目、60个科、97个属、135个种、188个OTUs;301的3个样品共鉴定得出3个门、10个纲、19个目、30个科、46个属、59个种、76个OTUs;L8的3个样品共鉴定得出4个门、13个纲、27个目、41个科、60个属、91个种、114个OTUs(表1)。
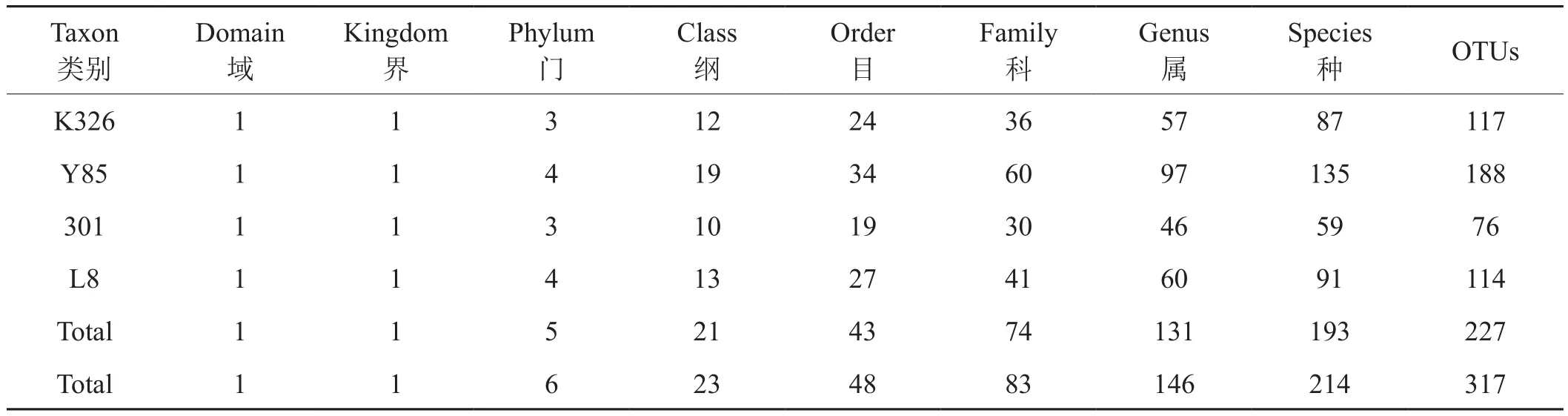
表1 4个品种烟草种子附生真菌不同分类水平数量Tab.1 The total amount of adnascent fungal communities of four varieties tobacco seeds at different taxonomic levels
Venn图分析结果表明(图2),在属和OTU水平,K326和云烟85附生真菌共有的OTU较多,附生真菌种类较为接近。云烟85的附生真菌种类最多,所含属和OTU远高于其他品种,且独有的OTU和属也最多。4个品种种子附生真菌群落中共有的OTU和属的数量分别为34和24(图2),其中丰度较高的属包括:赤霉菌属、链格孢属、镰刀菌属和隐球菌属(图5)。
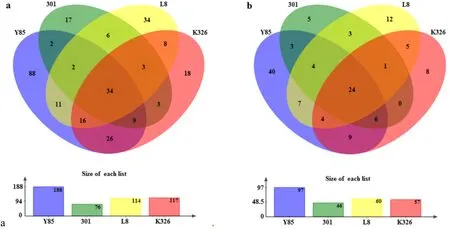
图2 4 个品种烟草种子附生真菌群落Venn图Fig.2 Venn diagram of adnascent fungal communities of four varieties tobacco seeds
2.4 附生真菌多样性指数分析
Alpha多样性指数表(表2)显示,4个品种种子样本的覆盖度指数(Coverage index)均在0.99以上,表明测序数据合理。K326、云烟85、L8种子样本附生真菌群落丰富度、均匀度、多样性均高于301种子样本附生真菌群落丰富度(Simpson指数越大,样本的多样性越低)。在OTU水平的Shannon指数图(图3)表明,K326、云烟85和L8种子附生真菌群落多样性远高于301。

表2 4个品种烟草种子附生真菌Alpha多样性指数(OTU level)Tab.2 Alpha diversity index of adnascent fungi of four varieties tobacco seeds (OTU level)

图3 Alpha多样性指数(OTU水平Shannon指数)Fig.3 Alpha diversity index (Shannon index of OTU level)
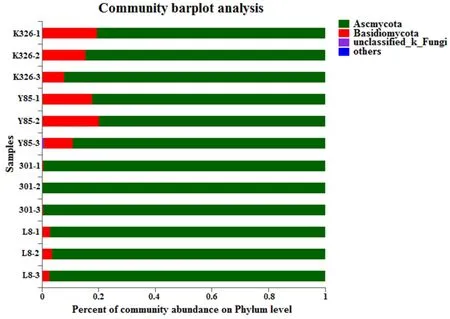
图4 4 个品种烟草种子附生真菌在门水平上的相对丰度Fig.4 The relative abundance of adnascent fungi of four varieties tobacco seeds at Phylum level
2.5 附生真菌群落基本组成和结构分析
在门水平,K326、云烟85和L8种子附生真菌主要分布在子囊菌门(Ascomycota)和担子菌门(Basidiomycota),301种子附生真菌主要分布在子囊菌门(Ascomycota)。子囊菌门在K326、云烟85、301和L8附生真菌群落中的占比分别为86.23%、83.70%、99.66%、97.03%;担子菌门在K326和云烟85样本的附生真菌群落中的占比超过百分之十(分别为13.70%、16.02%),在301和L8样本附生真菌群落中较少(占比分别为0.33%、2.95%)。
在属水平,将占比≥1%的菌属划分为优势属[18-19],K326附生真菌群落中的优势属为链格孢属(Alternaria)(56.83%)、赤霉菌属(Gibberella)(22.02%)、隐球菌属(Cryptococcus)(10.72%)、镰刀菌属(Fusarium)(3.42%)、红酵母属(Rhodotorula)(2.49%)、小画线壳属(Monographella)(1.93%),同时该品种还鉴定出大团囊菌属(Elaphomyces)(0.02%)、Gibellulopsis(0.43%)、属水平未分类的 核盘 菌科(unclassified_f_Sclerotiniacceae)(0.88%)、属水平未分类的小戴卫霉科(unclassified_f_Davidiellaceae)(0.48%)真菌。云烟85的优势属为赤霉菌属(39.24%)、小画线壳属(13.49%)、链格孢属(11.82%)、红酵母属(10.83%)、镰刀菌属(7.50%)、大团囊菌属(6.11%)、节担菌属(2.41%)、隐球菌属(2.12%)、曲霉菌属(Aspergillus)(1.33%)、裂壳菌属(Schizothecium)(1.17%)、Gibellulopsis(1.11%),同时该品种还鉴定出属水平未分类的小戴卫霉科(0.29%)真菌;301的优势属为链格孢属(95.85%),同时该品种还鉴定出赤霉菌属(0.30%)、镰刀菌属(0.95%)、隐球菌属(0.32%)、小画线壳属(0.07%)、属水平未分类的小戴卫霉科(1.36%)和属水平未分类的核盘菌科真菌(0.40%)。L8的优势属为链格孢属(51.06%)、曲霉菌属(23.22%)、镰刀菌属(7.19%)、赤霉菌属(2.73%)、隐球菌属(2.68%),同时该品种还鉴定出Gibellulopsis(0.24%)、属水平未分类的核盘菌科(7.04%)和属水平未分类的小戴卫霉科(3.84%)真菌。
在属水平上,K326的3个样品附生真菌群落组成不存在差异性。云烟85中的Y85-3样品与其它2个样品存在差异性,主要由于其中存在裂壳菌属(3.50%)和大团囊属(18.28%)真菌。301的3个样品不存在差异性。L8的L8-1样品与其它2个样品存在差异性,主要由于其中存在科水平未分类的格孢腔菌目(1.38%)真菌。

图5 4个品种烟草种子附生真菌在属水平上的相对丰度Fig.5 The relative abundance of adnsacent fungi of four varieties tobacco seeds at Genus level
本研究选取不同烟草种子样本丰度高的30个真菌属绘制丰度热图,通过颜色直观反映了各样品的丰度前30属的含量情况。图6上方的样本层级聚类树显示:每个品种的3个样品附生真菌群落结构与组成最为相似,都分别单独聚为一类。由于链格孢属真菌都占有最大比例,K326和301聚为一个分支,L8的3个样品与该分支类聚。由于云烟85种子的3个样品中存在最大比例的赤霉属真菌,因此聚类分支的距离最远。从整体上来看,大多数的菌属在不同样品中的丰度存在一定的相似性。
2.6 样本比较分析
样品距离热图(OTU 水平)反映了样品间附生真菌群落结构与多样性的差异。同一品种的3个样品真菌群落结构与多样性基本一致;云烟85的3个样品与其他品种的9个样品距离最远(图7),表明云烟85种子与其他品种种子样品间的附生真菌群落结构差异大,K326与301以及L8样品间的附生真菌群落结构差异小,云烟85与301以及L8样品间存在较大差异。
基于Bray-Curtis距离的PCoA分析研究了4个品种烟草种子附生真菌群落组成,结果显示,第1主成分PC1和第2主成分PC2对样品的贡献率分别为70.37%、18.48%,是影响烟草种子附生真菌群落结构的主要因素,且PC1显著大于PC2。云烟85烟草种子样品与第1主成分呈正相关,其他品种烟草种子样品与第1主成分呈负相关,L8烟草种子样品与第2主成分呈正相关,其他品种烟草种子样品与第2主成分呈负相关。在PC1和PC2的作用下,K326和301的距离最近,真菌群落结构差异性最小。
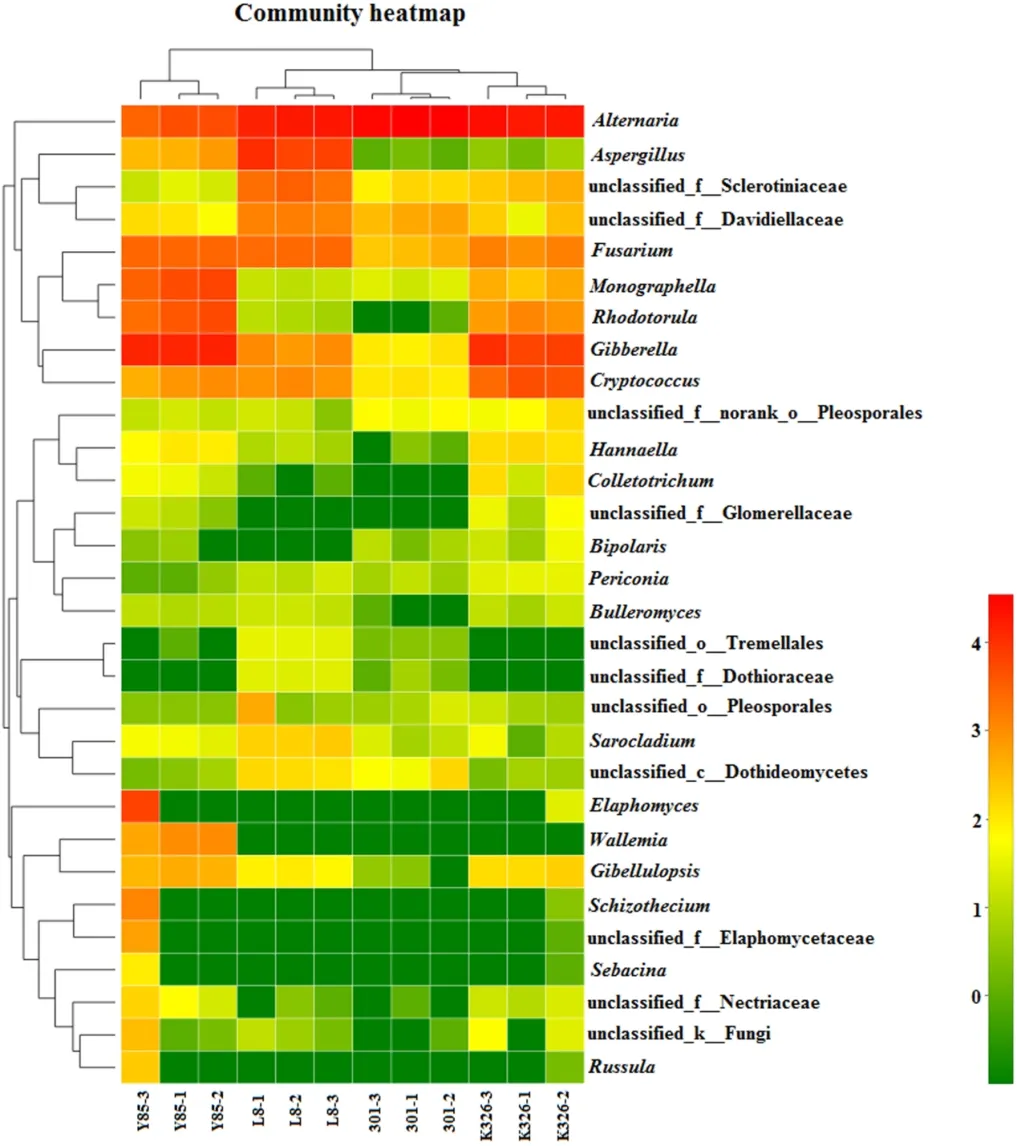
图6 属水平下4个品种烟草种子附生真菌的相对丰度热图Fig.6 Heat map of the relative abundance of adnascent fungi of four varieties tobacco seeds at genus level

图7 OTU水平4个品种烟草种子附生真菌距离heatmap图Fig.7 Distance Heat map of adnascent fungi of four varieties tobacco seeds on OTU level
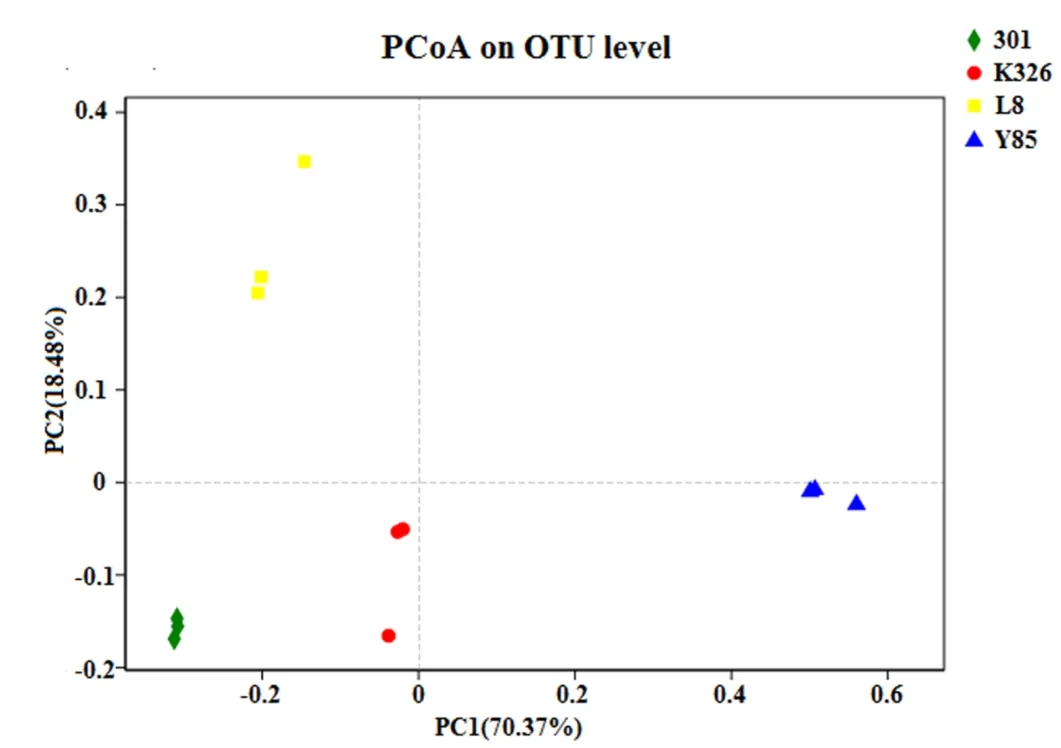
图8 OTU水平烟草种子附生真菌主坐标分析Fig.8 Principal coordinate analysis of adnascent fungi of tobacco seeds at OTU level.
3 讨论
由于种子附生微生物影响种子质量及子代健康,近年备受重视[20],利用Illumina高通量测序可以获得更多的微生物信息。本研究中采用的测序平台和数据处理方法与“烟草种子内生细菌群落结构与多样性[17]”研究中一致,以期更全面了解烟草种子相关的微生物。Alpha多样性指数分析结果表明,K326、云烟85和L8附生真菌的多样性指数和丰富度指数都高于301。其中,云烟85的多样性指数和丰富度指数最高,鉴定出的OTU数目远高于其它品种,云烟85附生真菌的种类和数量最多。由于烤烟品种云烟85和K326为田间收集的裸种,雪茄烟301和白肋烟L8裸种采自温室大棚,可见真菌群落组成与多样性与生长环境存在一定关系。此外,还与种子的结构等有关[21-22]。K326和301的附生真菌群落组成均不存在差异性,云烟85和L8中均分别有1个样品与其它样品存在差异性,但由丰度热图和距离heatmap图的聚类结果显示,每个品种的3个样品附生真菌群落间的差异性并不显著,可能是取样存在的允许误差。
在门水平,4个品种种子的附生真菌主要分布于子囊菌门和担子菌门。在属水平,4个品种鉴定出链格孢属、赤霉菌属、隐球菌属、镰刀菌属、红酵母属、小画线壳属、曲霉菌属及Gibellulopsis属真菌,其中,共同菌属为链格孢属、赤霉菌属、隐球菌属、镰刀菌属。据报道,链格孢菌可引起烟草赤星病[23],镰刀菌可引起烟草枯萎病和根腐病[24],曲霉菌可引起烟草储存期病害[25],核盘菌可引起植物菌核病[26]。以上有害真菌会侵染种子或者烟苗,在烤烟种子加工过程中有必要对种子进行消毒处理。赤霉菌分泌的赤霉素可以促进种子的萌发以及植株的生长[27],因此,可以考虑在包衣剂中添加赤霉素类植物生长素,提高种子的发芽率。
除已有研究中存在的菌属之外,还鉴定其他种类的菌,如隐球菌属、红酵母属、小画线壳属、大团囊菌属、裂壳菌属、节担菌属和Gibellulopsis属真菌。隐球菌属、红酵母属、小画线壳属和大团囊菌属真菌环境中常见真菌[28-30],目前未见为害烟草的报道。云烟85种子鉴定出节担菌和Gibellulopsis属真菌。节担菌又称噬干菌(xerophile),会引起低水分食物霉变[31],其对大丽花轮枝孢(Verticillium dahliae)和尖孢镰刀菌(Fusarium oxysporum)有很强的抑制作用,并且在YG培养基上生长的菌丝具有较高的核糖核酸酶活性[32],Gibellulopsis属真菌是菊科植物和生菜的病原菌,尤其在苗期[33-35]。为此,节担菌和Gibellulopsis属真菌是否会侵染烟草有待进一步研究。
