透明质酸/壳聚糖双层修饰的介孔生物活性玻璃的制备与性能研究
2020-05-18仇可新
仇可新
(上海双申医疗器械股份有限公司,上海 201707)
在骨修复领域,骨组织工程支架近年来向着生物活性支架方向发展,这样不仅在结构上能够支撑细胞的粘附,还能够在组成上提供生物活性因子来促进骨的再生[1-2]。具体地,一方面是支架结构的限制,即支架中心的营养供应和细胞活力经常受到严重阻碍,这主要是因为细胞生存所需的营养和氧气的扩散距离在150~200 μm[3],因此可以通过改变支架结构来解决这个问题,制备大孔结构的生物支架,对细胞的生长具有促进作用[4]。另一方面,研究表明在支架表面能够形成小于5 mm的组织层,这会导致支架中心的细胞密度降低,而且容易产生细胞坏死[5]。因此,为了解决这个问题,在支架上负载骨形态发生蛋白等生物活性因子,能够刺激细胞的分化和组织的生长[6-7]。
近年来,介孔生物活性玻璃(MBG)在骨组织工程领域已经引起了广泛的关注[8-9]。与无介孔结构的生物活性玻璃(BG)相比,MBG具有不同的介孔结构和生物活性,在结构上具有更高的比表面积和更大的容积,不仅能够传输蛋白或药物分子,增强体外的生物活性,而且可以缩短降解时间[10],在骨组织工程和药物传输方面具有巨大的应用前景。
然而,MBG负载生物活性因子容易发生泄漏和浪费问题,将MBG的孔道进行包裹以使生物活性因子缓释发生作用,对MBG支架的生物活性和生物活性因子的利用率具有促进作用[11]。因此,采用透明质酸(HA)和壳聚糖(CS)双层修饰MBG,制备复合支架MBG-HA/CS,选择地塞米松(DEX)进行负载,研究其缓释效果和生物相容性。
1 材料和方法
1.1 试剂与仪器
P123(EO20-PO70-EO20,Mn -5800)、聚 氨酯海绵、壳聚糖(CS,Mw 50000-190000 Da)、透明质酸(HA,Mw 500000 Da)、正硅酸乙酯(TEOS,98%)、3-氨基丙基-三乙氧基硅烷(APTES,98%)、磷酸三乙酯(TEP,99.8%)和地塞米松(DEX)购于美国Sigma-Aldrich公司。盐酸(HCl,分析纯)、硝酸钙(Ca(NO3)2·4H2O, ≥99.0%)、1-乙基-3(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC, Mw 191.70)、N-羟基丁二酰亚胺(NHS, Mw 115.09)和其它化学试剂采购于国药集团。FITC标记的鬼笔环肽溶液购买于碧云天生物技术有限公司。
扫描电子显微镜(SEM,日本Hitachi),透射电子显微镜(TEM,日本Hitachi),X射线多晶衍射仪(XRD,日本Rigaku),热重分析仪(TG,Germany),激光共聚焦显微镜(CLSM,德国Carl Zeiss LSM 700)。
1.2 MBG的制备和修饰
以聚合物P123(EO20-PO70-EO20)和聚氨酯海绵作为共模板剂制备具有介孔结构的MBG多孔支架[12]。P123用于制造支架的介孔结构(介孔尺寸为几个纳米),而聚氨酯海绵制造支架的的大孔结构(大孔径为几百微米)。将12 g P123、20.1 g TEOS、4.2 g Ca(NO3)2·4H2O、2.19 g TEP和3 g HCl(0.5 mol/L)溶于180 g乙醇中,室温搅拌24 h。然后,用蒸馏水将聚氨酯海绵清洗干净,烘干后备用。将聚氨酯海绵放入上述混合溶液中完全浸泡10 min,然后转移到培养皿中,在室温下晾干,此过程重复3次。待样品完全干燥后,置于650 ℃的马弗炉中煅烧5 h,最后得到具有介孔结构的MBG多孔支架材料。
随后,MBG多孔支架进行氨基化处理[13]。将1 g MBG放入含有1 mL APTES的无水乙醇中浸泡24 h。取出后用无水乙醇冲洗3次,除去多余的APTES,得到氨基修饰的MBG支架(记为MBG-NH2)。
MBG-NH2支架进行HA和CS修饰。称取0.2 g EDC和0.37 g NHS溶于20 mL去离子水中,称取113 mg HA溶于60 mL去离子水中;然后将两种溶液混合,使用三乙胺溶液调节溶液pH至9.0。将1 g MBG-NH2放入上述混合溶液中,保持38 ℃条件下搅拌过夜,最后用去离子水清洗样品[14]。使用质量分数为1%的乙酸溶液配制2 mg/mL的壳聚糖溶液,将MBG-HA支架置于上述溶液中,浸泡1 h,然后用去离子水冲洗并真空干燥,最后得到透明质酸和壳聚糖修饰的MBG支架(记为MBG-HA/CS)[15]。
1.3 支架的表征和性能测试
通过扫描电子显微镜和透射电子显微镜观察MBG支架的表面形貌和内部结构;使用X射线多晶衍射仪对MBG支架的物相进行分析;通过热重分析仪对MBG-HA/CS的物料变化进一步分析。
1.4 DEX的负载和释放
DEX为合成糖皮质激素,被广泛用于骨组织工程中,研究表明DEX能够诱导骨细胞的分化和骨组织形成[16-17],因此选用DEX用于药物释放的研究。0.1 g MBG-HA/CS支架材料放入5 mL乙醇溶液中,加入5 mg DEX[18]。在室温下,避光搅拌12 h,再放入真空干燥箱内促使乙醇溶液的蒸发和药物的吸附。随后,将载药的支架材料(DEX@MBG-HA/CS)放入磷酸缓冲液(PBS)中清洗数次,除去样品表面的药物。收集所有的清洗液,通过紫外-可见分光光度计在242 nm下进行吸光度的测量,借助DEX的标准曲线计算DEX@MBG-HA/CS支架中DEX的装载量。经计算,DEX@MBG-HA/CS中DEX的装载量为2.28 mg/g。
将DEX@MBG-HA/CS浸泡在5 mL PBS(pH 7.4)中,保持在37 ℃条件下。在每个设定的时间点,取出缓释溶液并进行收集,然后加入同体积的新鲜PBS溶液。通过紫外-可见分光光度计测量收集的缓释液的吸光度,分析计算DEX的释放量,最终得到每个时间点DEX累计释放量并绘制释放曲线。每个时间点设置3个平行样。
1.5 细胞相容性研究
所有的支架样品经环氧乙烷灭菌处理。分别将无菌的MBG和DEX@MBG-HA/CS支架置于24孔培养板内,并用无菌钢环压住,然后以5×104细胞/孔的密度接种小鼠MC3T3-E成骨细胞。将其置于恒温细胞培养箱中培养1 d、3 d和5 d,期间每2 d更换一次新鲜培养基。待到预定的时间点,将培养基移除,用4%多聚甲醛固定细胞30 min。用PBS冲洗2遍每个样品孔,先用0.1%曲拉通X-100溶液进行通透5 min,再用1% BSA溶液处理20 min。用PBS洗净后,加入FITC标记的鬼笔环肽溶液(165 nmol/L)对细胞进行染色30 min。最后,样品经PBS洗后用激光共聚焦显微镜(CLSM)进行观察并拍摄照片。
2 结果
2.1 扫描电镜和透射电镜观察
由SEM照片(图1A、B和C)可以看出,MBG支架呈现明显的多孔结构,孔与孔之间具有高度连通性,孔的直径为100~300 μm。由TEM照片(图1D)可以清晰看到MBG支架介孔孔道结构,孔道直径约为3 nm,并且均一有序。因此,MBG支架的大孔和多孔结构有利于细胞所需的营养物质输送,而其介孔结构可以用于药物等生物活性小分子的运输[19]。
2.2 X射线衍射分析
XRD图谱(图2)显示MBG支架没有明显的晶体特征峰,在2θ=23°中心处有一个宽峰,表明制备的MBG支架是无定型的[12,20]。

图1 MBG支架的SEM照片和TEM照片

图2 MBG支架的XRD图谱
2.3 MBG、MBG-HA和MBG-HA/CS的热力学性能分析
通过热重分析法分析MBG、MBG-HA和MBGHA/CS的热力学性能。由图3可以看出,在100 ℃之前,MBG、MBG-HA和MBG-HA/CS的热量均有所降低,这主要是水分蒸发引起的。随后主要是残留的模板剂、包裹的HA和CS的分解,导致样品质量的下降。最后MBG、MBG-HA和MBG-HA/CS支架的残留量分别为90.73%、88.14%和87.08%。该结果表明MBG上HA和CS的成功包裹。
2.4 药物释放曲线
由图4的DEX释放曲线可以看出,释放主要表现为两个阶段:DEX在开始7 d以较快的速率进行释放,在随后的21 d表现为稳定长期的释放过程。这可能是由于DEX负载于MBG-HA/CS的孔道和HA/CS的包裹层内,当样品置于PBS缓释液中,HA/CS包裹层内的DEX快速释放到溶液中;随后,MBG-HA/CS孔道内的药物逐渐释放出来。在28 d时,DEX@MBG-HA/CS支架的DEX累计释放量为75%,表明DEX从DEX@MBG-HA/CS支架中释放呈现较好的缓释效果。
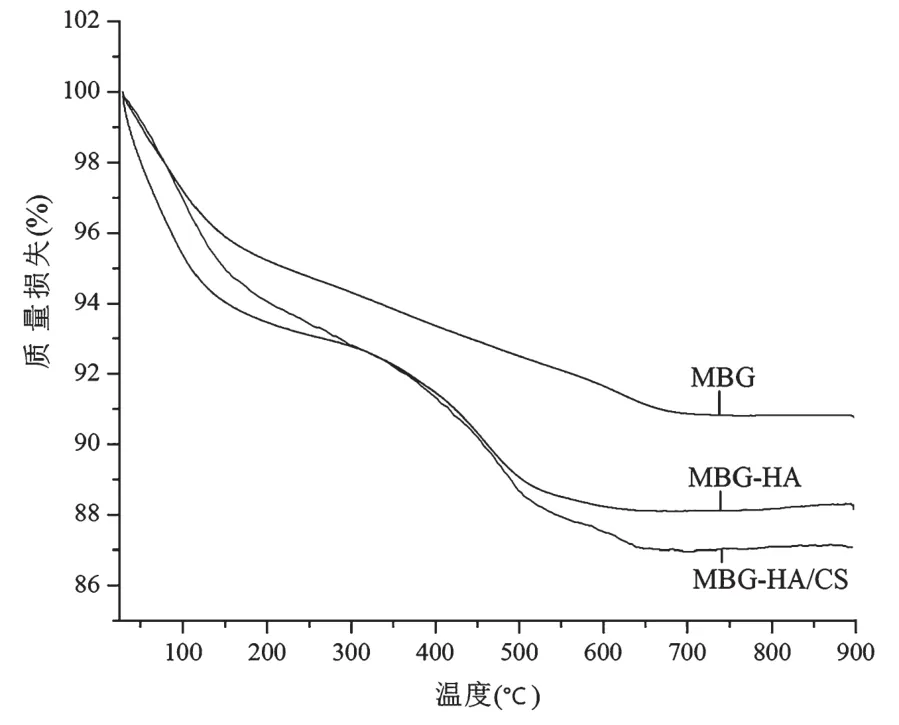
图3 MBG、MBG-HA和MBG-HA/CS的TGA曲线

图4 DEX释放曲线
2.5 细胞相容性研究
将成骨细胞MC3T3-E1接种到MBG和DEX@MBG-HA/CS支架上,培养1 d、3 d和5 d后,对细胞质进行染色后通过激光共聚焦显微镜(CLSM)进行观察。由图5可以看出细胞能够在MBG和DEX@MBG-HA/CS支架上粘附和生长,随着时间的延长,细胞的尺寸开始慢慢变大,由圆点形状逐渐变成海星形状。尤其在DEX@MBG-HA/CS支架上,相比与MBG支架上,成骨细胞伸展良好,出现更多丝状伪足,粘附在支架上,这说明释放的DEX能够促进细胞的粘附和生长。
3 结论
本文制得的MBG支架具有孔径为100~300 μm相互连通的大孔结构和孔道大约为3 nm的介孔结构,并通过透明质酸和壳聚糖双层修饰后负载地塞米松(DEX),成功制得复合载药支架(DEX@MBGHA/CS)。DEX的释放行为表现为开始7 d快速释放,随后21 d长期缓慢释放,起到一定的缓释作用。成骨细胞在DEX@MBG-HA/CS培养后,细胞粘附和生长良好。生物活性玻璃经修饰后表现出的优异载药性能,应用到骨修复中具有良好的前景。

图5 细胞激光共聚焦显微照片(200倍)
