胃癌患者血清miR-21、miR-181表达与临床病理参数、预后的关系
2020-05-15李伟潘静陈曦
李伟,潘静,陈曦
胃癌是世界上最常见的恶性肿瘤类型之一,其死亡率和发病率均较高,在肿瘤中的死亡率仅次于肺癌,位居第二位[1]。我国是胃癌的高发国家,尽管已有早期胃癌筛查的指南颁布,但胃癌的早期诊断率依然较低,一方面是胃癌诊断的“金标准”胃镜检查为侵入性检查,人群接受度低,另一方面胃癌患者在早期无明显的特异性症状,难以在发病初期察觉,待确诊时多处于中晚期[2-3]。胃癌的发生发展是一个极其复杂的过程,主要与一些原癌基因和抑癌基因的异常表达相关[4]。微小RNA(microRNA,miR)是一组长度为22~28个核苷酸序列的小内源性非编码RNA调节分子,广泛存在于真核生物中,参与了人类将近1/3的基因表达调控[5]。目前有大量研究证实,多种miRNA在恶性肿瘤中的存在异常表达,可发挥癌基因或者抑癌基因的作用[6-7]。miR-21在人体的多种组织中普遍存在,而且在乳腺癌、肝癌、肺癌、胃癌等肿瘤中均存在异常表达,其含有独立的启动子,能够通过和目的基因的mRNA的3′端UTR(非翻译区)特异性结合使mRNA停止转录,进而调节基因表达[8-9]。成熟的miR-181家族有miR-181a、miR-181b、miR-181c、miR-181d等4个成熟序列,它们在多种恶性肿瘤如乳腺癌、肺癌、胰腺癌、胃癌等的增殖、分化、凋亡等过程中发挥着重要的作用[10]。本研究检测了miR-21和miR-181在胃癌患者和健康志愿者血清中的表达水平,并进一步分析其与胃癌患者的预后、临床病理参数之间的关系,现报道如下。
1 资料与方法
1.1 研究对象
收集于2012年6月至2014年4月入住我院的97例胃癌患者的血清样本,同时收集同期100例于我院进行体检的健康志愿者的血清样本。97例胃癌患者年龄(55.67±10.21)岁,<60岁患者59例,≥60岁患者38例;男性55例,女性42例;低分化48例,中高分化49例;有淋巴结转移45例,无淋巴结转移52例;浸润深度:黏膜下各层33例,浆膜层64例;有远处转移44例,无远处转移53例;TNM分期:Ⅰ+Ⅱ期32例,Ⅲ+Ⅳ期65例。健康志愿者年龄(54.12±11.32)岁,男性61例,女性39例。两组年龄、性别差异无统计学意义(P>0.05)。本研究经医院伦理委员会审核同意,伦理号:伦(审)JK2012-04-02。
1.2 纳入与排除标准
1.2.1 纳入标准 ①胃癌的诊断以病理学检查为依据;②采血前胃癌患者未经过放疗或化疗等治疗;③临床资料及随访资料齐全,患者签署知情同意书。
排除标准 ①在手术前已经进行抗肿瘤治疗;②临床资料或随访资料有缺失;③患者患有肝肾等疾病;④合并其他恶性肿瘤。
1.3 样本采集及检测
于入院后采集胃癌患者的空腹静脉血5 mL,于体检时采集健康体检志愿者的空腹静脉血5 mL。于4 ℃、转速为3 000 rpm的离心机中离心10 min,收集上层血清至新的离心管,-80 ℃保存备用。
1.4 血清总RNA提取及实时荧光定量PCR(qRT-PCR)检测
Trizol LS试剂提取患者血清中的总RNA。逆转录试剂盒(TaKaRa microRNA transcription kit,TaKaRa)对mRNA进行逆转录。运用SYBR Green(TaKaRa)试剂盒进行实时荧光定量PCR。反应条件为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s,共42个循环。U6正向引物:5′-CTT CGG CAG CAC ATA TAC T-3′,U6反向引物5′-AAA ATA TGG AAC GCT TCA CG-3′;miR-21正向引物:5′-ACG TTG TGT AGC TTA TCA GAC TG-3′,miR-21反向引物5′-AAT GGT TGT TCT CCA CAC TCT C-3′;miR-181正向引物:5′-AGT GAA CAT TCA ACG CTG TCG GT-3′,miR-181反向引物5′-GCC ATA GGG TAC AAT CAA CGG TCG-3′。以2-ΔΔCT公式计算miR-21和miR-181的相对表达量。
1.5 随访
通过电话或者门诊复查的方式对患者进行随访,每3个月随访1次,随访的时间为确诊后1~60个月,直至患者死亡或者停止随访。
1.6 统计方法
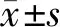
2 结果
2.1 不同研究对象血清miR-21、miR-181表达情况
qRT-PCR实验结果显示,胃癌患者血清中miR-21、miR-181相对表达量均高于健康志愿者,差异有统计学意义(P<0.05),见表1。

表1 miR-21、miR-181在不同研究对象血清中的相对表达量比较
2.2 胃癌患者血清miR-21、miR-181水平与临床病理参数的关系
胃癌患者血清中miR-21表达水平与有无淋巴结转移、分化程度、浸润深度有关(P<0.05),而与患者年龄、性别、TNM分期、有无远处转移无关(P>0.05);胃癌患者血清中miR-181表达水平与有无淋巴结转移、肿瘤TNM分期有关(P<0.05),而与患者年龄、性别、浸润深度、分化程度、有无远处转移无关(P>0.05)。见表2。

表2 胃癌患者血清中miR-21和miR-181表达与临床特征的关系
2.3 胃癌患者血清miR-21、miR-181水平与预后的关系
采用单因素分析miR-21对胃癌患者预后的影响,以中位数为界,将胃癌患者分为miR-21高表达组(n=49例)和miR-21低表达组(n=48例)。Kaplan-Meier生存曲线分析结果显示,miR-21高表达组与低表达组术后5年累积生存率分别为18.4%(9/49)和25.0%(12/48),术后中位生存时间分别为17个月和50个月,差异有统计学意义(Log rank2=4.704,P=0.030),见图1。
采用单因素分析miR-181对胃癌患者预后的影响,以中位数为界,将胃癌患者分为miR-181高表达组(n=49例)和miR-181低表达组(n=48例)。Kaplan-Meier生存曲线分析结果显示,miR-181高表达组与低表达组术后5年累积生存率分别为14.3%(7/49)和29.2%(14/48),术后中位生存时间分别为15个月和43个月,差异有统计学意义(Log rank2=7.339,P=0.007),见图2。
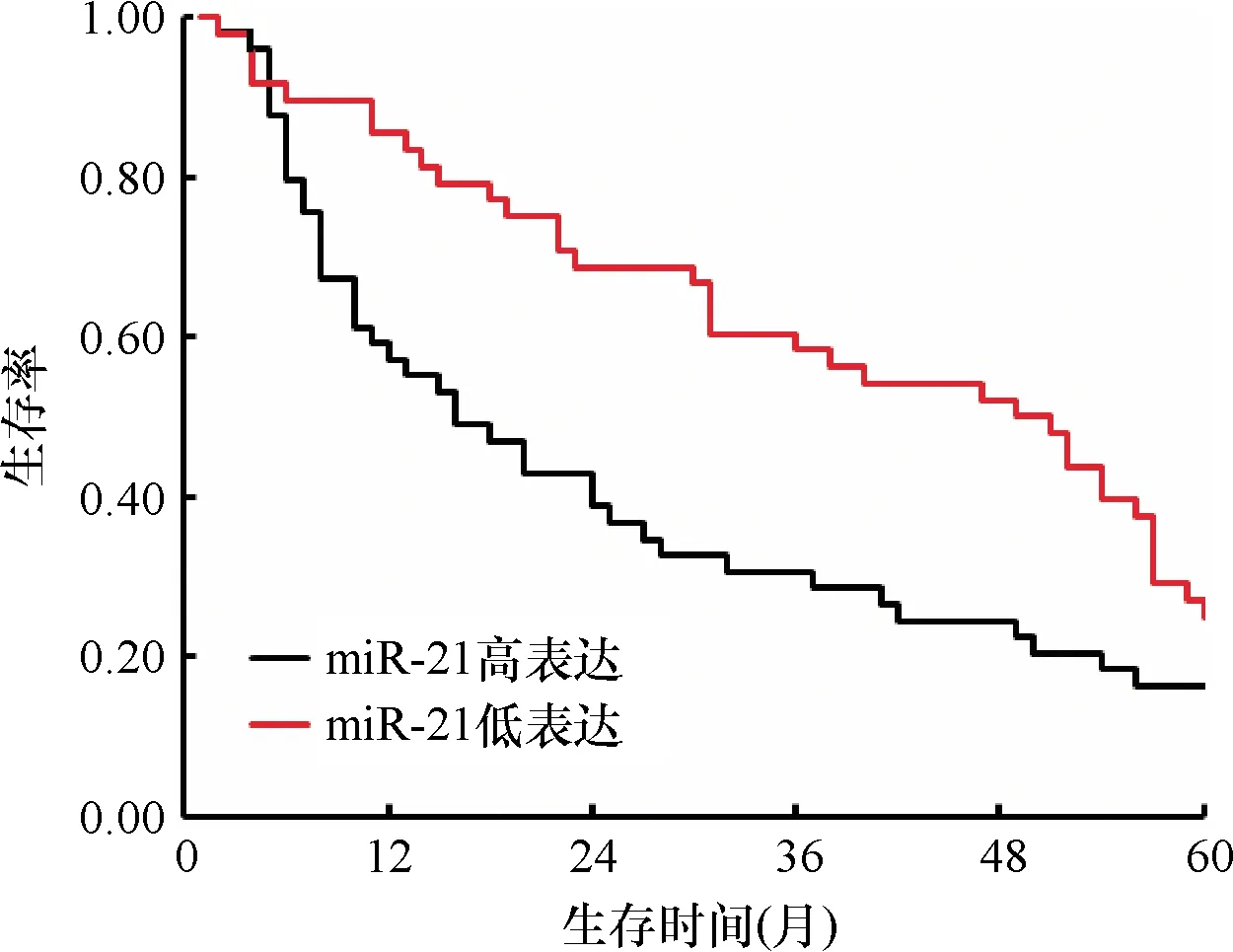
图1 miR-21表达与胃癌患者预后的Kaplan-Meier生存曲线
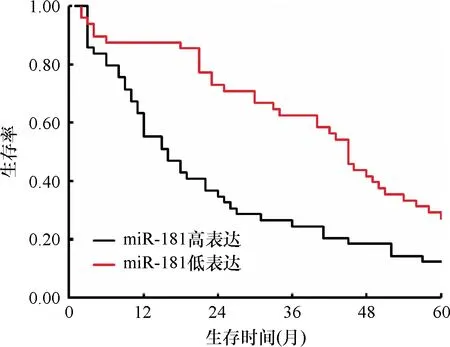
图2 miR-181表达与胃癌患者预后的Kaplan-Meier生存曲线
2.4 血清miR-21、miR-181水平对胃癌预后的预测价值
以5年中死亡的患者资料为阳性样本(即预后不良,n=76),以仍然存活的患者资料为阴性样本(n=21),采用ROC曲线进行分析,结果显示血清miR-21、miR-181对胃癌预后有较好的预测价值,ROC-曲线下面积(AUC)分别为0.765、0.796,分析结果列于表3,ROC分析曲线见图3。
二者联合检测时仍使用各自的诊断阈值,采用并联诊断的方式,即二者中一个为阳性结果即为阳性,二者均为阴性结果才为阴性。结果显示,联合应用的预测价值得到进一步提升,虽然特异性下降至0.667,但敏感度和约登指数分别提升至0.908,0.574。见表3。
3 讨论
目前手术切除是治疗胃癌的主要策略,虽然手术切除后胃癌患者生存率将得到极大提高,但由于大多数胃癌患者被确诊时已处于中晚期,错过了治疗的最佳时期,因此大部分患者的预后仍然较差。血清学指标具有取样方便、可重复性好、人群接受度高等特点,近年来临床越来越重视恶性肿瘤患者血清学生物标志物的研究,血清胃蛋白酶原、胃泌素17、肿瘤标志物等已在胃癌的筛查、诊断中得到了一定的应用[11]。miRNA具有广泛的生物学作用,且其在血清、精液、尿液等体液中都能保持稳定状态,能通过检测体液中的miRNA水平来反映其在机体中的表达情况。目前人体发现的miRNA已达数百种,miRNA在多种肿瘤中存在异常表达,miRNA的异常表达能够调控众多的细胞进程,如细胞凋亡、肿瘤的侵袭和迁移等,是导致恶性肿瘤发生的原因之一[12-13]。因此miRNA能够作为恶性肿瘤的重要标志物,对恶性肿瘤的诊断、治疗疗效评估以及预后判断中均可发挥重要的辅助作用。近年来发现多种miRNA与胃癌的发生、发展密切相关,如miR-145、miR-494等[14-15]。
图3 血清miR-21、miR-181对胃癌患者预后预测的ROC曲线
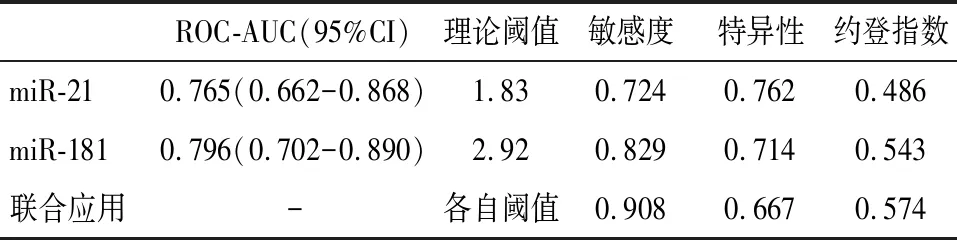
表3 血清miR-21、miR-181指标及其联合应用的预测价值分析结果
本研究结果发现,相对于健康志愿者,血清miR-21和miR-181在胃癌患者中均出现高表达。通过对胃癌患者的临床病理参数进行分析,结果显示有淋巴结转移、低分化、浸润深的胃癌患者血清miR-21的表达水平更高,而有淋巴结转移、肿瘤TNM分期高的胃癌患者血清miR-181的表达水平更高,可见二者均可能在胃癌的发生、发展过程中发挥促癌的作用。miR-21是目前研究最多的miRNAs之一,miR-21的成熟形式也被称作hsa-miR-21或miRNA21,主要有MIR21基因编码[9]。miR-21在乳腺癌中表现为高表达,对患者的预后具有重要的指导意义[16];同时miR-21能够调控胰腺癌细胞的增殖和迁移,影响胰腺癌的发生和发展[17]。Sha M等[18]人的研究显示,miR-21抑制剂可降低PI3K/Akt-NF-κB信号通路的活性,而上调miR-21的表达则增强该信号通路的活性,减少胃癌细胞凋亡。miR-181是人类中普遍存在的一类miRNA,其能够通过调节K-ras等基因,影响肿瘤的进展,在胃癌、肝癌、肺癌等肿瘤的发生和发展过程中发挥重要的作用[10]。Troiano等[19]人研究表明miR-181可以通过调节细胞的运动,进而对口腔鳞状细胞癌的发生和发展进行调控,miR-181的异常表达与口腔癌患者淋巴结转移、血管侵袭和不良预后密切相关。有研究发现在胃癌中,miR-181a通过调控KLF6基因从而影响胃癌细胞的生长和迁移[20];余钧辉等[21]人通过细胞实验证实,上调miR-181a可以通过调控细胞周期调控蛋白、凋亡相关蛋白的表达来促进胃癌细胞AGS增殖,抑制细胞凋亡。第10号染色体缺失性磷酸酶和张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)是一种抑癌基因,其可调节恶性肿瘤细胞增殖、迁移等,Liu[22]、Wang[23]等人研究发现miR-21能够通过调节肿瘤抑制因子PTEN的表达水平,进而影响非小细胞肺癌及胃癌的增殖和侵袭。Xu等[24]人也通过细胞实验发现,在宫颈癌细胞中下调miR-181可增加PTEN的表达,进而影响细胞的增殖、侵袭以及凋亡,可见PTEN相关通路可能是miR-21、miR-181调控恶性肿瘤进展的重要通路。
从miR-21、miR-181与胃癌患者临床病理特征的关系可以看出二者可能参与了胃癌的进展,有作为评估胃癌患者预后生物标志物的潜质。本研究结果显示,miR-21以及miR-181高表达的胃癌患者5年生存率以及生存时间均较低,提示二者与胃癌患者的预后密切相关。通过ROC曲线分析,miR-21、miR-181的AUC均在0.7以上,提示二者对患者的预后具有较高的预测价值。为更好的发现预后不良的患者,在联合应用时采用并联诊断的方式,结果显示在适当牺牲特异性的基础上,敏感度和约登指数均有明显的提升,这表明,血清miR-21、miR-181联合检测对胃癌患者的预后情况有较高的预测价值。
综上所述,胃癌患者血清miR-21、miR-181表达水平高于健康人群,且表达水平与患者的部分临床病理特征及预后有关,血清miR-21、miR-181联合检测对胃癌预后的预测具有较高的敏感度和特异度,可为临床在评估胃癌患者的预后时提供重要的参考。然而本文研究对象数量有限,miR-21和miR-181能否作为常规指标评估胃癌患者的预后,仍需大规模的临床研究进行验证,且miR-21、miR-181调控胃癌进展的具体机制尚未完全阐明,后续将通过基础实验进行进一步的探索。
