江南油杉苗期在低锰环境下的生理响应
2020-05-14刘雄盛黄荣林韦铄星
刘 菲,蒋 燚,姜 英,刘雄盛,黄荣林,宋 倩,韦铄星,黄 云,蒋 琳
(1.广西壮族自治区林业科学研究院 广西优良用材林资源培育重点实验室 国家林业和草原局中南速生材繁育实验室,广西南宁 530002;2.广西壮族自治区农业科学院,广西南宁 530007;3.广西国有六万林场,广西玉林 537000;4.广西国有黄冕林场,广西柳州 545600)
锰(Mn)是植物生长发育必须的元素,在植物的氮代谢和光合过程等方面发挥着重要的作用。Mn也是许多重要酶类物质的激活物,是构成光合作用中水解酶的基本组分之一,适量的Mn有益于维持植物正常的生理代谢,缺锰则影响植物的光合作用和地上部分干物质积累[1-2],同时对植物代谢产生重要影响。江南油杉(Keteleeria fortunei var.cyclolepis)为我国特有种,在我国的广西、福建、广东、湖南、贵州、浙江、江西和云南等南方地区海拔300~1 000 m的山地有天然分布,是松科(Pinaceae)油杉属高大常绿针叶乔木,为油杉(K.fortunei)的变种[3]。其适应性强,主干端直,树型美观,木材硬度适中、纹理通直、结构细致和耐腐蚀性强,是众多行业发展(如建筑、造船和家具等)所需的优良珍贵木材[4]。部分国内学者在江南油杉的生态学特征[5-6]和植物学特性[7-8]方面开展了研究,得到了江南油杉群落结构分化明显、垂直分布稳定和优势地位明显等结论。还有一些学者在江南油杉的优树选择方法[9-10]、幼苗培育技术[11-12]、苗期抗旱生理特征[13]和栽培技术[14-15]等方面开展了诸多研究,发现江南油杉适应性强,能适应一定程度的重度干旱胁迫,后期生长迅速,可对其扩大利用。但低Mn环境对江南油杉的影响未见相关报道,本研究通过人为控制Mn含量,探索江南油杉苗期在低Mn环境下的生理响应特征,旨在为江南油杉培育中Mn的施用及江南油杉的保护提供理论依据,补充江南油杉抗逆理论。
1 材料与方法
1.1 试验地概况
试验地位于广西壮族自治区林业科学研究院科研苗圃(108°21′E,22°56′N),地处广西南宁市北郊,海拔约90 m,属丘陵地带,成土母质为寒武纪砂岩,土壤为赤红壤,年均气温21.6℃,≥10℃年积温7 200℃,最低气温-2.1℃,最高气温40.4℃,干湿季明显,属湿润北热带季风气候,年均降水量1 347.2 mm,平均相对湿度80%左右,5—9月为雨季,月平均降水量100 mm以上;10月—翌年4月为旱季,月平均降水量80 mm以下。
1.2 试验材料
材料为项目组2016年从田林县收集的江南油杉种子繁育的幼苗,于2016年10—11月对优树进行球果采摘,随后在阴凉干燥处将球果晾干,并将种子从果壳中剥出,2017年2月在沙床进行催芽,3月将已生根的幼苗移栽至5 cm×9 cm的无纺布轻基质育苗袋中,基质配比为椰糠∶珍珠盐=1∶3,并统一放入育苗托盘,进行常规育苗管理。
1.3 研究方法
胁迫处理采用Hoagland营养液[16]+MnCl2·4H2O为胁迫溶液。共设3个处理,以Hoagland营养液(营养液配方中含9.146 μmol/L MnCl2)培养的幼苗作为对照(CK),并设置T1中度低Mn(20% 营养液)、T2重度低Mn(5%营养液)作为胁迫处理。每处理4次重复,每重复5株。将江南油杉幼苗整株放入玻璃容器内,置于光线充足且通风良好处,加入足量处理溶液,以没过植株基部为准,放入通气泵,24 h通气,每3 d更换1次相应浓度的处理溶液。胁迫开始时间为2018年8月7日,试验开始后测定每株江南油杉幼苗的株高和地径,共取样2次,分别于第10 d(8月17日)和第20 d(8月26日)上午8:00~11:30测定株高、地径生长量和生物量,并取成熟叶片和根系保存至-10℃冰箱备用,以测定生理指标。
1.4 指标测定
使用钢卷尺对幼苗株高(H)进行测量(精确至0.1 cm);使用数显游标卡尺对幼苗地径(D)进行测量(精确至0.01 mm)[17]。在处理开始前和处理结束后分别测量每株江南油杉幼苗的株高和地径,分别记为H始和D始,及H终和D终。运用公式△H=H终-H始和△D=D终-D始,计算株高生长量和地径生长量,其中△H为株高生长量,△D为地径生长量。
采用收获取样法[15]测定生物量,在试验结束时分别采集各处理幼苗的根、茎和叶,先在烘箱105℃下杀青15 min,然后调节温度为85℃,烘至质量恒定,待自然冷却后分别测定各器官绝干后的质量,以茎和叶的生物量之和为地上部分生物量,根的生物量为地下部分生物量,各组分生物量之和为总生物量。
采用丙酮浸提法[18]测定叶绿素总含量,采用烘干称量法[18]测定叶片相对含水量,采用电导率法[19]测定细胞膜透性,采用蒽酮比色法[16]测定叶片可溶性总糖含量,采用酸性茚三酮法[16]测定叶片脯氨酸含量,采用硫代巴比妥酸法[19]测定丙二醛(MDA)含量,采用NBT光还原法[19]测定超氧化物歧化酶(SOD)活性,采用愈创木酚法[19]测定过氧化物酶(POD)活性。
1.5 数据处理
采用Excel 2007和Origin Pro 8.0软件对数据进行处理与分析。采用SPSS 19.0软件进行方差分析及LSD比较。
2 结果与分析
2.1 低Mn环境对江南油杉幼苗生长的影响
与CK相比,幼苗在低Mn环境下10 d时,叶片出现部分褪绿和发黄现象,少部分叶片出现掉落现象,部分植株茎部略有发黑,根部颜色未见明显变化;20 d时,褪绿和发黄叶片的数量较10 d时增加,叶片掉落加剧,植株茎部和根部发黑数量增多,发黑程度略有加重。株高和地径生长量随Mn浓度降低逐渐下降(图1)。10 d时,T1处理的株高和地径生长量较CK分别下降11.20%和1.55%,T2处理分别下降30.25%和9.53%;20 d时,T1处理的株高和地径生长量较CK分别下降47.85%和26.41%,T2处理分别下降52.12%和36.88%。20 d时,CK的株高和地径生长量较10 d时分别上升60.50%和66.46%;T1处理的株高生长量较10 d时小幅下降(2.23%),地径生长量上升24.43%;T2处理的株高和地径生长量较10 d时分别上升14.29%和16.13%。10 d时,各处理间的株高和地径生长量均差异不显著;20 d时,CK的株高生长量与T1和T2处理差异显著(P<0.05),各处理间的地径生长量均差异不显著。20 d时各处理的株高和地径生长量与10 d时差异不显著。
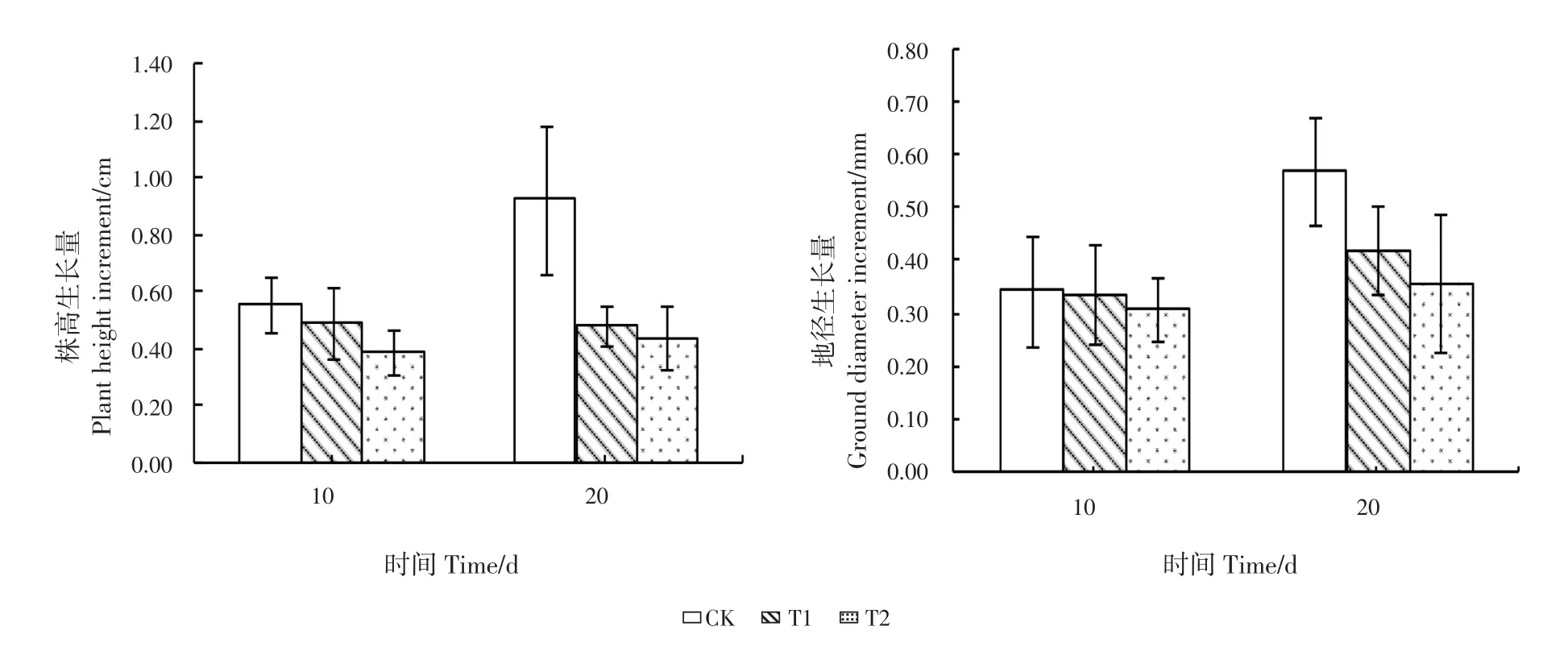
图1 低Mn环境对江南油杉幼苗株高和地径生长量的影响Fig.1 Effects of low manganese environment on increments of plant height and ground diameter of K.fortunei var.cyclolepis seedlings
2.2 低Mn环境对江南油杉幼苗生物量的影响
幼苗地上部分生物量、地下部分生物量和总生物量随Mn浓度降低逐渐下降(图2)。10和20 d时,CK、T1和T2处理的地上部分生物量、地下部分生物量和总生物量均为CK>T1>T2。10 d时,T1处理的地上部分生物量、地下部分生物量和总生物量较CK分别下降29.95%、22.24%和27.28%,T2处理分别下降39.60%、29.66%和36.16%。20 d时,T1处理的地上部分生物量、地下部分生物量和总生物量较CK分别下降21.65%、67.74%和40.00%,T2处理分别下降38.22%、70.67%和51.14%;CK的地上部分生物量、地下部分生物量和总生物量较10 d时分别上升4.15%、30.14%和13.15%;T1处理的地上部分生物量较10 d时上升16.50%,地下部分生物量和总生物量分别下降46.02%和6.64%;T2处理的地上部分生物量较10 d时上升6.52%,地下部分生物量和总生物量分别下降45.73%和13.41%。10 d时,各处理间的地上部分生物量和地下部分生物量均差异不显著,CK与T2处理的总生物量差异显著(P<0.05)。20 d时,CK的地上部分生物量与T2处理差异显著(P<0.05),与T1处理差异不显著;CK的地下部分生物量和总生物量与T1和T2处理均差异极显著(P<0.01);T1与T2处理间的地上部分生物量、地下部分生物量和总生物量均差异不显著。20 d时各处理的地下部分生物量、地上部分生物量和总生物量与10 d时差异不显著。

图2 低Mn环境对江南油杉幼苗生物量的影响Fig.2 Effects of low manganese environment on biomass of K.fortunei var.cyclolepis seedlings
2.3 低Mn环境对江南油杉幼苗膜脂过氧化和细胞膜透性的影响
随着Mn浓度降低,幼苗的MDA含量逐渐上升(图3)。10 d时,T1和T2处理的MDA含量较CK分别增加12.89%和13.83%;20 d时,T1和T2处理的MDA含量较CK分别增加16.01%和67.26%;CK与T1处理在20 d时的MDA含量较10 d时分别下降29.72%和27.78%,T2处理较10 d时增加3.27%。10 d时,各处理间的MDA含量均差异不显著;20 d时,T2处理与CK和T1处理差异显著(P<0.05);20 d时各处理的MDA含量与10 d时差异不显著。
电导率随Mn浓度降低逐渐升高(图4)。10 d时,T1和T2处理的电导率分别比CK高20.69%和28.01%;20 d时,T1和T2处理的电导率分别比CK高34.10%和111.87%;20 d时,T2处理的电导率较10 d时上升37.63%,T1处理下降7.60%。10 d时,各处理间的电导率均差异不显著;20 d时,CK的电导率与T2处理差异极显著(P<0.01);20 d时各处理的电导率与10 d时差异不显著。

图3 低Mn环境对江南油杉幼苗MDA含量的影响Fig.3 Effects of low manganese environment on MDA content of K.fortunei var.cyclolepis seedlings

图4 低Mn环境对江南油杉幼苗电导率的影响Fig.4 Effectsoflowmanganeseenvironmenton conductivity of K.fortunei var.cyclolepis seedlings
2.4 低Mn环境对江南油杉幼苗叶绿素总含量的影响
幼苗叶绿素总含量随Mn浓度的降低逐渐下降(图5)。10 d时,各处理叶绿素总含量为CK>T1>T2,T1与T2处理的叶绿素总含量较CK分别下降17.69%和22.75%;20 d时,T1与T2处理的叶绿素总含量较CK分别下降2.71%和3.95%;20 d时CK、T1和T2处理的叶绿素总含量较10 d时分别增加2.62%、21.30%和27.59%。10 d时,CK的叶绿素总含量与T1和T2处理差异显著(P<0.05);20 d时,各处理间的叶绿素总含量均差异不显著;20 d时T1与T2处理的叶绿素总含量与10 d时差异显著(P<0.05);20 d时CK的叶绿素总含量与10 d时差异不显著。

图5 低Mn环境对江南油杉幼苗叶绿素总含量的影响Fig.5 Effects of low manganese environment on total content of chlorophyll of K.fortunei var.cyclolepis seedlings
2.5 低Mn环境对江南油杉幼苗渗透调节物质的影响
Mn浓度降低的环境下,10 d时,幼苗的脯氨酸含量呈先上升后小幅下降的趋势,T1和T2处理的脯氨酸含量较CK分别上升42.25%和39.95%;20 d时,脯氨酸含量呈逐渐上升的趋势,T1和T2处理的脯氨酸含量较CK分别上升57.45%和76.55%;20 d时CK、T1和T2处理的脯氨酸含量较10 d时分别上升27.95%、41.62%和61.41%(图6)。10 d和20 d时,各处理间的脯氨酸含量均差异不显著,20 d时各处理的脯氨酸含量与10 d时差异不显著。
幼苗的可溶性糖含量在Mn浓度下降的情况下,10 d时呈上升趋势,20 d时呈下降趋势(图7)。10 d时,T1和T2处理的可溶性糖含量较CK分别上升25.43%和30.15%,20 d时分别下降12.13%和30.08%。20 d时,CK与T1处理的可溶性糖含量较10 d时分别上升57.87%和10.59%,T2处理下降15.18%。10 d时,CK的可溶性糖含量与T2处理差异显著(P<0.05);20 d时,CK的可溶性糖含量与T2处理差异极显著(P<0.01);20 d时CK的可溶性糖含量与10 d时差异极显著(P<0.01),其他处理20 d时的可溶性糖含量与10 d时差异不显著。

图6 低Mn环境对江南油杉幼苗脯氨酸含量的影响Fig.6 Effects of low manganese environment on proline content of K.fortunei var.cyclolepis seedlings

图7 低Mn环境对江南油杉幼苗可溶性糖含量的影响Fig.7 Effects of low manganese environment on soluble sugar content of K.fortunei var.cyclolepis seedlings
2.6 低Mn环境对江南油杉幼苗保护酶活性的影响
幼苗SOD活性随Mn浓度降低整体呈先上升后下降的趋势(图8)。10 d时,SOD活性为T1>T2>CK,T1和T2处理的SOD活性较CK分别增加62.47%和49.75%;20 d时,SOD峰值在T1处理中出现,T1和T2处理的SOD活性较CK分别增加75.11%和39.81%。20 d时CK、T1和T2处理的SOD活性较10 d时分别下降39.24%、34.51%和43.27%。10 d和20 d时,各处理间的SOD活性均差异不显著;各处理在20 d时的SOD活性与10 d时均差异不显著。
幼苗POD活性随Mn浓度降低呈逐渐下降的趋势(图9)。10 d时CK的POD活性较T1和T2处理分别增加0.75%和33.18%,20 d时分别增加12.42%和30.49%;20 d时CK、T1和T2处理的POD活性较10 d时分别增加87.74%、65.66%和95.30%。10 d和20 d时,各处理间的POD活性均差异不显著;各处理20 d时的POD活性与10 d时均差异显著。

图8 低Mn环境对江南油杉幼苗SOD活性的影响Fig.8 Effects of low manganese environment on SOD activity of K.fortunei var.cyclolepis seedlings

图9 低Mn环境对江南油杉幼苗POD活性的影响Fig.9 Effects of low manganese environment on POD activity of K.fortunei var.cyclolepis seedlings
3 结论与讨论
随着Mn浓度降低,江南油杉幼苗的生长受到抑制。株高和地径生长量、地上部分生物量、地下部分生物量和总生物量随Mn浓度降低逐渐下降,这与武泰存等[20]对小麦(Triticum aestivum)的研究结果相似。细胞受损和膜脂过氧化程度加重,叶绿素总含量逐渐降低;脯氨酸含量在短时间内随Mn浓度降低呈先上升后小幅下降的趋势,随着胁迫时间增加,含量逐渐上升;可溶性糖含量在短时间内随Mn浓度降低呈上升趋势,随着胁迫时间增加,含量逐渐下降;SOD活性呈先上升后下降的趋势,POD活性逐渐下降。
Mn元素参与光合作用中水裂解氧及叶绿素合成的过程,植物在缺Mn环境下,易造成叶绿体细胞膜成分(糖脂和多聚不饱和脂肪酸等)含量的下降和结构性变差[21-23]。江南油杉幼苗叶绿素总含量在低Mn环境下,短时间内下降显著,随着胁迫时间的增加,各处理间的叶绿素总含量差异程度下降,可能是由于幼苗叶片细胞的质膜受到损害,导致细胞质膜透性下降,不饱和脂肪酸发生过氧化作用,产生MDA[24],导致膜脂过氧化程度加重,叶绿素的合成受抑制程度加剧。
植物在逆境下,会在体内发生一系列复杂的生理过程,积累大量脯氨酸和可溶性糖等渗透物质,以调节与维持植物生长[25-26]。在短时间的低Mn环境下,重度低Mn处理下江南油杉幼苗的脯氨酸含量较中度低锰时略有下降,可溶性糖显著积累,可能是由于短时间重度低锰环境抑制幼苗吸收镁、钙和铁等其他元素,造成元素平衡被打破,抑制了脯氨酸的积累,引发可溶性糖逐渐积累并在渗透调节中发挥主要作用[2,27]。糖类是植物光合作用所转化能量的储存形式,光合作用与植物可溶性糖的积累息息相关[28],随着胁迫时间增加,叶绿素总含量下降导致可溶性糖的积累受到影响,含量显著下降,此时脯氨酸含量虽有上升,但变化并不显著。
SOD和POD是植物体内清除活性氧自由基并保护植物的重要酶,可清除植物体内的活性氧,保护细胞膜结构,对缓解逆境对植物造成的损伤具有重要作用,其活性变化能有效反映植物在逆境下的适应能力[29]。SOD每分子含1个Mn原子[30],本研究中,SOD活性峰值在T1处理中出现,随后活性下降,可能与重度低Mn环境下Mn元素的缺乏有关。POD与光合作用和呼吸作用等生理过程密切相关,可以清除逆境胁迫下植物体内产生的H2O2,缓解或抵御植物逆境胁迫引起的损害[31]。本研究中,Mn浓度降低造成POD活性逐渐下降,可能与叶绿素含量下降有关,这与张郑伟等[31]对水稻(Oryza sativa)在Mn素胁迫下的研究结果相似。
综上所述,江南油杉幼苗在低Mn环境下的响应策略主要为降低植株生长、降低叶绿素合成、提升脯氨酸含量进行植物体内的渗透调节和提升SOD活性消除植物体内的活性氧,使其能一定程度适应低Mn环境。
本研究的试验场所位于科研苗圃,其气候条件与生产所处条件基本一致,研究所得的结论可作为江南油杉苗期抗逆理论的补充,为研究、生产和应用提供参考。植物抗逆生理是一个复杂的过程,本研究未对江南油杉幼苗在低Mn环境下的各生理指标变化是否与其他元素变化存在相应关系开展相关试验,可在下一步开展深入研究,并运用生物技术挖掘相应的调控基因,优化江南油杉幼苗在低Mn环境下的保存率,提高在Mn含量较低区域造林的成活率。
