转录因子Dlx1在HT22细胞中调控CRMP2转录活性的研究
2020-05-13束慧
束慧
摘 要 目的:观察转录因子Dlx1对小鼠海马神经元细胞HT22细胞CRMP2( Collapsin response mediator protein 2)基因的调控作用。方法: 构建pcDNA3.1-HA-Dlx1质粒及pGL3.0-Basic-CRMP2 promoter质粒,采用双荧光素酶报告基因检测系统检测Dlx1对CRMP2基因启动子转录的影响; 检测过表达Dlx1对内源CRMP2基因表达的影响。结果:Dlx1直接结合在CRMP2启动子上,促进CRMP2基因表达。结论: Dlx1促进CRMP2基因表达。
关键词 Dlx1 脑衰反应调节蛋白-2 启动子 双荧光素酶基因检测
中图分类号:R780.2文献标识码:A
脑衰反应调节蛋白2 (Collapsin response mediator protein 2, CRMP2)是CRMPs家族成员之一,均由564-572个氨基酸残基组成。人源CRMP2基因定位于8p21.2,转录本Ⅱ与小鼠CRMP2基因编码的蛋白氨基酸残基长度均为572aa,只有两个氨基酸不同。CRMP2表达量的下降和活性的降低均会引起神经系统疾病,如帕金森疾病、精神分裂症和阿尔茨海默症等。
Dlx1属于Dlx基因家族成员之一,有研究表明Dlx家族基因在神经元发育中有很重要的作用。本实验通过观察Dlx1对CRMP2基因启动子转录活性的影响,以及转录活性之间的关系,为进一步研究CRMP2基因表达的调控奠定了一定基础。
1材料与方法
1.1主要试剂与仪器
HT22细胞株(实验室保留);CRMP2质粒构建引物(苏州金唯智生物科技有限公司);二抗山羊抗兔(美国Abcam,ab6721);CRMP2 siRNA(吉玛基因股份有限公司); CRMP2抗体(美国Abcam,ab129082);Lipofectamine 2000转染试剂(美国Invitrogen, 11668019);蛋白浓度测定试剂盒(碧云天,p0012);胎牛血清(美国Hyclone,Sh30370.03);RPMI-1640培养基(美国Hyclone,Sh30809.01);Ripa裂解液(康为世纪, CW2334);DNA质粒小提试剂盒(天根生化科技有限公司);双荧光素酶报告基因检测系统(美国 Promega 公司)。
1.2质粒构建
采用PCR方法扩增得到鼠源Dlx1 cDNA片段,使用EcoR1/BamH1限制性内切酶处理后插入pcDNA3.1-HA载体,构建成pcDNA3.1-HA-Dlx1质粒,PCR引物序列:上游引物序列- CCG GAATTC ATGACCATGACCACCATGCCAG,下游引物序列- GCG GGATCC TCACATCAGTTGAGGCTGCTGC。采用PCR方法擴增得到鼠源CRMP2启动子片段,使用Kpn1/Mlu1限制性内切酶处理后插入pGL3.0-Basic载体,构建成pGL3.0-Basic-CRMP2 promoter质粒,PCR引物序列:游引物序列-CGG GGTACCAAATATAAATATATATATATTTTAA,下游引物序列-GCACGCGT TCTCTCCGGGGGGCGGGAGGAAG。
1.3 Dlx1对CRMP2启动子(-102- +1)103bp转录活性的影响
1.3.1不同浓度Dlx1对CRMP2启动子转录活性的影响
HT22细胞株培养于RPMI-1640培养基(含10%胎牛血清,1%霉素/链霉素双抗),置 5% CO2,37℃细胞培养箱培养。取生长状态稳定HT22细胞铺板,培养过夜,待细胞丰度达到大约70%时,按照Lipofectamine 2000转染试剂说明书进行转染。将pcDNA3.1-HA载体,pcDNA3.1-HA-Dlx1质粒分别按不同的浓度(50ng,100ng,200ng)和pGL3-Basic -CRMP2 promoter质粒(300ng),Renilla质粒(10ng)共转染到12孔板 HT22细胞,各转染3个孔。48 h后收集细胞,分别使用100L 细胞裂解液裂解细胞,充分裂解,离心后取20L上清液用于双荧光素酶报告基因试剂盒检测,具体步骤参考说明书。
1.3.2小鼠CRMP2基因启动子特征性序列的定点突变
将小鼠CRMP2启动子序列进行转录因子结合位点分析(http://jaspar. genereg.net/cgi-bin/jaspar_db.pl),结果显示转录因子Dlx1在预测得到的CRMP2启动子区域具有潜在结合位点(tataaatata)。设计突变引物,将tataaatata序列突变掉构建突变质粒,将得到的突变质粒送至苏州金唯智生物科技有限公司测序,将所得结果使用NCBI。
1.3.3检测Dlx1对CRMP2野生型和突变型基因启动子转录活性的影响
将pcDNA3.1-HA载体,pcDNA3.1-HA-Dlx1质粒分别和pGL3.0-Basic -CRMP2 promoter质粒及突变质粒,Renilla质粒共转染到12孔板HT22细胞,各转染3个孔。按照Lipofectamine 2000转染试剂说明书进行转染。将pcDNA3.1-HA-Dlx1质粒按不同的浓度(50ng,100ng,200ng)分别和pGL3.0-Basic -CRMP2 promoter质粒/突变质粒(300ng),Renilla质粒(10ng)共转染到12孔板 HT22细胞,各转染3个复孔。48 h后收集细胞,分别使用100L 细胞裂解液裂解细胞,充分裂解,离心后取20L上清液用于双荧光素酶报告基因试剂盒检测,具体步骤参考说明书。
1.4 Dlx1促进内源性CRMP2基因表达
将pcDNA3.1-HA载体和pcDNA3.1-HA-Dlx1质粒分别转染到12孔板HT22细胞中,每孔转染500ng,各转染6个复孔;在HT22细胞中分别转染10ul NC siRNA和siRNA CRMP2(浓度均为1nM)。48h后,提取mRNA和蛋白质,分别做Q-PCR和Western Blot检测CRMP2的mRNA和蛋白变化。Q-PCR引物序列:上游引物序列-GGGATCTGATGCTGACTTGGTC,下游引物序列-GGGAATGTAGCGTCCTGAGC。将收集的蛋白质采用BCA试剂盒定量后,浓度调至一致,加入5咨涎撼逡海?5 ℃煮沸15 min。将30ug蛋白样品加到10%聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上样孔中,80V电泳20min,120V电泳120min,使用PVDF膜转膜 (恒定电流:330 mA,70min)。室温下5%的小牛血清封闭1 h,孵育CRMP2及GAPDH抗体(1:5000)室温2h,TBST洗膜4次,每次5 min,孵育山羊抗兔二抗(1:10000)室温下孵育1 h,洗膜4次,每次5 min,ECL发光液曝光收集结果。
1.5统计学处理
实验数据采用单因素方差分析和双因素方差分析来进行显著性分析,p<0.05 表示差异具有统计学意义,用Graph Pad Prism进行统计学分析,数据均以均值北曜嘉蟊硎尽?
2结果
2.1不同浓度Dlx1对CRMP2启动子转录活性的影响
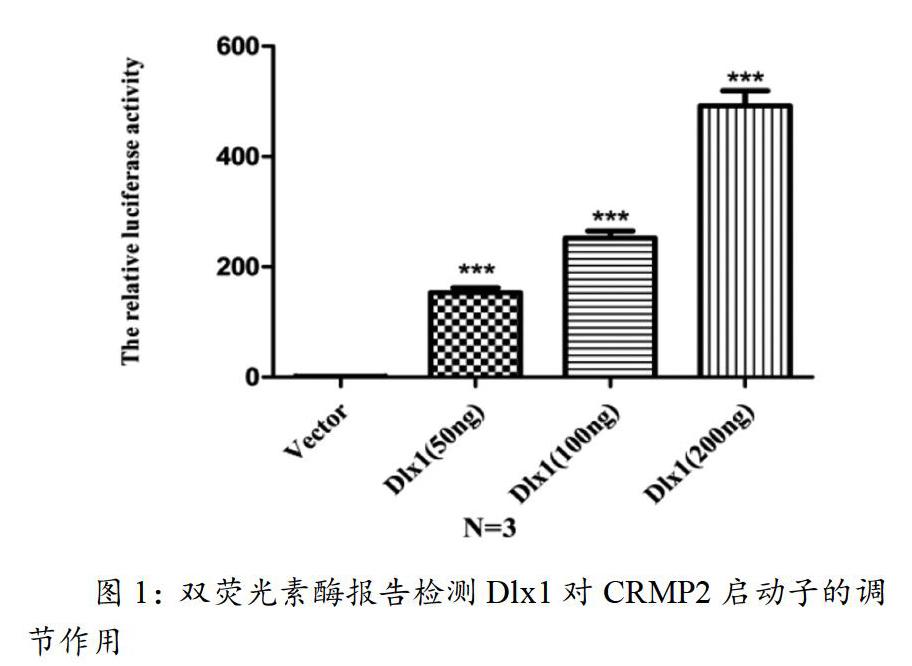
检测不同浓度的转录因子Dlx1质粒与pGL3.0-Basic -CRMP2 promoter質粒共转染HT22细胞时发现,随着Dlx1浓度的增高,pGL3.0-Basic -CRMP2 promoter质粒的荧光素酶活性显著增高,差异有统计学意义( P <0.001) ,结果如图1所示。
图1:pcDNA3.1-HA载体,不同浓度的转录因子Dlx1质粒分别与pGL3.0-Basic -CRMP2 promoter质粒共转染HT22细胞,以Renilla为内参,使用双荧光素酶报告基因试剂盒检测荧光酶的活性,结果显示,随着转录因子Dlx1浓度的增高,荧光素酶的活性也随之增强,p<0.001。
2.2 Dlx1对CRMP2野生型和突变型启动子质粒荧光素活性的影响
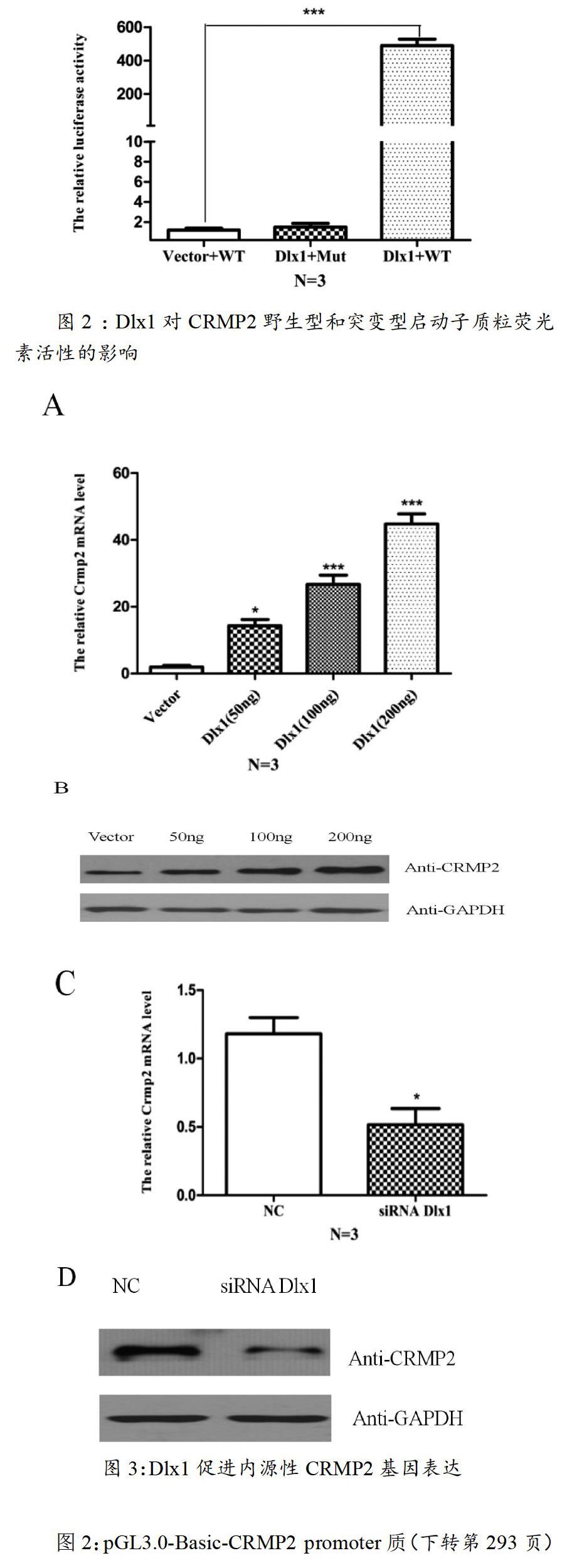
通过生物信息学的分析,我们将Dlx1在预测得到的CRMP2启动子区域具有潜在结合位点,通过PCR定点突变的方法去掉,构建突变质粒。然后将Dlx1分别与CRMP2野生型和突变型启动子质粒转染,检测荧光素酶的活性。Dlx1对野生型CRMP2启动子质粒荧光素活性有激活作用,差异有统计学意义(p<0.001);对CRMP2突变型启动子质粒荧光素活性无明显激活作用,差异无统计学意义(p>0.05),结果如图2所示。
图2:pGL3.0-Basic-CRMP2 promoter质(下转第293页)(上接第288页)粒中的Dlx1结合位点突变后,Dlx1不能促进光素酶的活性增强,差异无统计学意义(p>0.05),说明Dlx1可以直接结合在CRMP2启动子,并促进其转录。
2.3 Dlx1促进内源性CRMP2基因表达
将不同浓度pcDNA3.1-HA-Dlx1质粒瞬时转染到HT22细胞,采用Q-PCR和Western Blot方法检测CRMP2 mRNA和蛋白水平的变化,CRMP2 mRNA和蛋白水平均升高,有统计学意义(p<0.05,p<0.001),结果如图3-A和3-B所示;在HT22细胞中Knock-down Dlx1,CRMP2 mRNA和蛋白水平均下降,有统计学意义(p<0.05)结果如图3-C和3D所示,说明Dlx1可以促进CRMP2基因表达。
图3-A:不同浓度过表达Dlx1组与对照组相比,CRMP2 mRNA水平显著升高,差异有统计学意义(p<0.05,p<0.001);图3-B:不同浓度过表达Dlx1组与对照组相比,CRMP2 蛋白水平显著升高,差异有统计学意义(p<0.05);图3-C:Knock-down Dlx1组与对照组相比,CRMP2 mRNA水平下降,差异有统计学意义(p<0.05);图3-D:Knock-down Dlx1组与对照组相比,CRMP2 蛋白水平下降,差异有统计学意义(p<0.05)。
3讨论
近年来,蛋白质组学已得到广泛应用,为一些疾病发病机制的研究带来了更宽广的思路。诸多实验已证明,CRMP2在神经系统疾病中起到重要作用,其表达贯穿神经元生命始终,发育阶段达到高峰。同时CRMP2的表达量和神经元位置也有相关性,例如,在小脑、海马和嗅球等处CRMP2 表达较多。
本实验通过采用生物信息学的方法,预测出转录因子Dlx1可能调控CRMP2的基因表达,并通过相关实验加以验证,首次发现,转录因子可以直接结合在CRMP2启动子上,并促进CRMP2基因表达。基因转录过程十分复杂,通常情况下,许多转录因子形成复合物共同起调控作用,所以我们不能排除还有其他转录因子也参与这一调控过程,具体还有哪些转录因子参与调控有待我们进一步研究探索。
综上所述,转录因子Dlx1与CRMP2启动子相互结合从而调控其表达水平,为一些疾病发病研究和治疗提供一定的理论支持。
