产地鲜切加工片姜黄HPLC指纹图谱分析及4个成分含量测定
2020-05-13张立红岳显可冯婉红吴秀红2
张立红,岳显可,张 云,冯婉红,,吴秀红2,
(1.杭州市萧山区中医院,浙江 杭州 311201;2.杭州民泰中药饮片有限公司,浙江 杭州 311201;3.浙江中医药大学 药学院,浙江 杭州 310053)
片姜黄为姜科植物温郁金CurcumawenyujinY.H.Chen et C.Ling的干燥根茎,具破血行气、通经止痛之功效[1],主产于浙江温州瑞安等地。片姜黄主要含挥发油[2],化学成分组成有莪术醇、莪术二酮、莪术酮、β-榄香烯,吉马酮、呋喃二烯等[3]。具有抗肿瘤[4]、抗炎[5]、抗血栓[6]、抗病毒[7]、抗菌[8]、保肝[9]、增强免疫系统等药理作用。
对于片姜黄,由于现代有关著作记载的不一和变化,给教学、科研以及临床用药造成诸多困惑。1963年版《中国药典》记载片姜黄为“姜科Zingiberaceae植物郁金CurcumaaromaticaSalish.的干燥地下根状茎”;1985年版《中国药典》称“为莪术的纵切片”;1990-2015年版《中国药典》则载“为姜科植物温郁金C.wenyujinY.H.Chen et C.Ling的干燥根茎”;现行2015版《中国药典》中片姜黄质量标准仅收录了来源、性状、鉴别、总挥发油含量[1],无水分、总灰分、HPLC含量测定等检测项,这不利于片姜黄的质量控制。笔者在研究过程中发现,市场上购买的片姜黄其来源、性状、鉴别和总挥发油含量无显著差别,但是通过HPLC含量测定和指纹图谱分析,发现指标性成分莪术二酮、吉马酮、呋喃二烯和β-榄香烯含量极低,有的甚至未检出;不同批次市售片姜黄指纹图谱的相似度也很低。
因此,本研究从片姜黄道地产区瑞安陶山、马屿等地收集2015年12月份采收加工的片姜黄饮片,对指标性成分莪术二酮、吉马酮、呋喃二烯和β-榄香烯含量进行测定,并建立产地鲜加工片姜黄的指纹图谱,为系统分析片姜黄质量及其质量的变化提供前期试验依据。
1 仪器与试药
1.1 仪器
戴安U3000高效液相色谱仪(美国赛默飞世尔科技有限公司);Agilent Eclipse XDB -C18(4.6 mm×250 mm,5 μm)色谱柱;FA1204B电子分析天平(济南捷岛分析仪器有限公司);BP210S十万分之一电子天平(Sartorius公司);AXTG16G高速台式离心机(盐城市安信实验仪器有限公司)。
1.2 试药
产地加工片姜黄共10批,采集自温州瑞安市陶山、马屿等地,经杭州民泰中药饮片有限公司质检科鉴定为姜科植物温郁金CurcumawenyujinY.H.Chen et C.Ling的干燥根茎;呋喃二烯(批号:111824-201102,纯度:99.4%),莪术二酮(批号:111800-201302,纯度:99.8%),β-榄香烯(批号:100268-200401,纯度:99.2%)均购自中国食品药品检定研究院;吉马酮(批号:160307,纯度:98.57%)购自北京科量技术有限公司;甲醇、无水乙醇(广东光华科技股份有限公司)为分析纯;液相用乙腈为色谱纯;水为娃哈哈纯净水。
2 方法与结果
2.1 色谱条件
以Agilent Eclipse XDB -C18(4.6 mm×250 mm,5 μm)为色谱柱,乙腈为流动相A,水为流动相B,进行梯度洗脱,0~10 min,20% ~32%A;10~15 min,32%~35% A;15~60 min,35%~80% A,60~66 min,80% ~83%A;66~76 min,83%~85% A;76~80 min,85%~90% A,80~90 min,90%~95% A;检测波长为206 nm,流速1.0 mL/min,柱温为25 ℃,进样量10 μL,在此条件下,样品中各待测组分与其相邻色谱峰得到基线分离。见图1。

注:1.片姜黄混合对照品;2.产地鲜加工片姜黄样品;a.莪术二酮;b.吉马酮;c.呋喃二烯;d.β-榄香烯
2.2 对照品溶液的制备
精密称取对照品莪术二酮8.82 mg、吉马酮9.75 mg、呋喃二烯10.21 mg、β-榄香烯10.54 mg置于10 mL量瓶中,加甲醇至刻度,溶解摇匀,为对照品储备液。精密吸取对照品储备液依次稀释成浓度为莪术二酮880.24、440.12、176.05、88.02、44.01、35.21 μg/mL、吉马酮961.06、480.53、192.21、96.11、48.05、38.44 μg/mL、呋喃二烯1 014.87、507.44、202.97、101.49、50.74、40.59 μg/mL、β-榄香烯1 045.57、522.79、209.11、104.56、52.27、41.82 μg/mL的对照品溶液,进行测定分析。
2.3 供试品溶液的制备
称取片姜黄粉末(过三号筛)0.5 g,精密称定,置于具塞锥形瓶中,精密加入25 mL甲醇溶液,称定重量,于频率50 Hz超声提取1 h后,冷却,补重,摇匀静置,取上清液,过0.45 μm微孔滤膜,即得。
2.4 产地鲜加工片姜黄指标性成分含量测定
2.4.1 线性范围考察 取“2.2”项制备的对照品溶液,精密吸取10 μL,注入液相色谱仪,测得峰面积积分值。以峰面积积分值为纵坐标,各对照品进样量(μg)为横坐标,绘制标准曲线,计算回归方程,莪术二酮:Y=9.108 2x+0.126 3(r=0.999 9),吉马酮Y=35.601x+4.815 6(r2=0.999 7),呋喃二烯:Y=25.941x+4.930 7(r=0.999 7),β-榄香烯:Y=15.748x+2.319 8(r=0.999 6)。由结果可知,在线性范围莪术二酮0.352 1~8.802 4 μg、吉马酮0.384 4~9.610 6 μg、呋喃二烯0.405 9~10.148 7 μg、β-榄香烯0.418 2~10.455 7 μg内呈良好的线性关系,符合实验要求。
2.4.2 精密度试验 取浓度为莪术二酮176.05 μg/mL、吉马酮192.21 μg/mL、呋喃二烯202.97 μg/mL、β-榄香烯209.11 μg/mL对照品溶液,在上述色谱条件下进样分析,进样6次,每次10 μL,测定峰面积,并计算RSD分别为莪术二酮0.74%、吉马酮1.02%、呋喃二烯1.37%、β-榄香烯0.93%,表明仪器精密度符合试验要求。
2.4.3 稳定性试验 取片姜黄供试品溶液分别于0、6、12、18、24、30 h进样,测定莪术二酮、吉马酮、呋喃二烯、β-榄香烯峰面积值,计算RSD值分别为1.34%、1.18%、1.63%、0.82%,表明供试品溶液中各生物碱类成分在30 h内稳定。
2.4.4 重复性试验 取片姜黄粉末(过三号筛)按照“2.3”项下进行供试品溶液制备(n=6),测定并计算。结果样品中莪术二酮平均含量15.458 mg/g,RSD为1.21%;吉
马酮平均含量3.08 mg/g,RSD为0.72%;呋喃二烯平均含量11.383 mg/g,RSD为1.42%;β-榄香烯平均含量3.829 mg/g,RSD为1.73%,重复性符合试验要求。
2.4.5 加样回收试验 称取已知含量片姜黄粉末(过三号筛)6份,按“2.3”项下方法制备样品,测得峰面积积分值并计算含量与回收率。结果:莪术二酮平均回收率为98.37%,RSD=1.57%(n=6);吉马酮平均回收率为97.82%,RSD=1.73%(n=6);呋喃二烯平均回收率为101.48%,RSD=1.69%(n=6);β-榄香烯平均回收率为99.03%,RSD=1.46%(n=6),表明准确度良好,符合试验要求。
2.4.6 样品含量测定 按“2.3”项下方法对片姜黄供试品溶液进行制备,精密吸取供试品溶液10 μL,注入液相色谱仪,测定并计算,结果如表1所示。
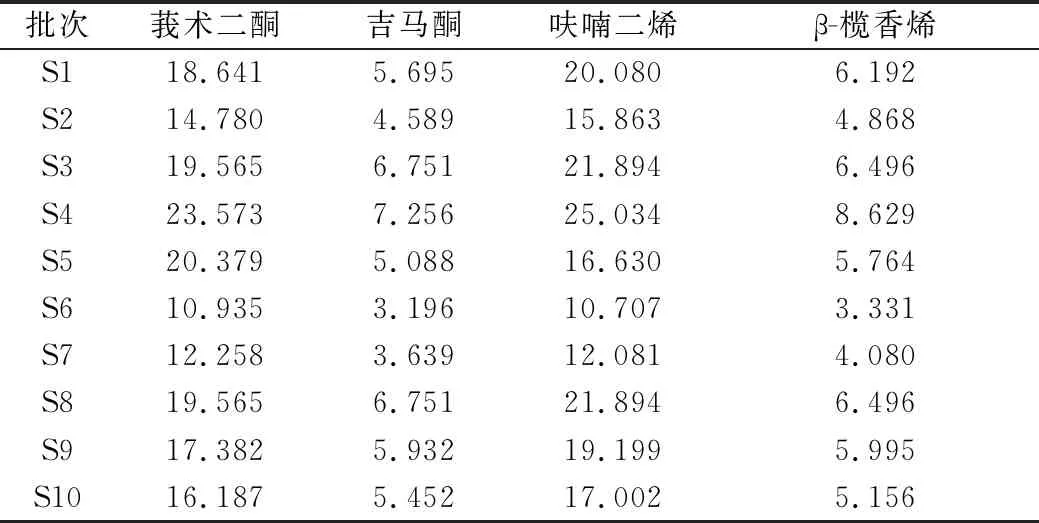
表1 产地鲜加工片姜黄4个指标性成分含量 (mg/g)
2.5 不同批次产地鲜加工片姜黄指纹图谱的建立
将收集的瑞安市陶山镇、马屿镇等地2015年12月份采收加工的10批片姜黄饮片,利用“中药色谱指纹图谱相似度评价系统2004A版”,对10批产地鲜加工片姜黄指纹图谱进行分析。经多点校正和数据匹配,生成片姜黄共有峰指纹图谱(图2),发现10批产地鲜加工片姜黄共有峰26个(图3)。并指认出莪术二酮(13号峰)、吉马酮(19号峰)、呋喃二烯(22号峰)、β-榄香烯(23号峰),22号峰呋喃二烯为参照峰。10批片姜黄样品共有峰相对保留时间RSD值为0.03%~0.18%,相对峰面积RSD值为6.84%~54.87%,说明不同批次片姜黄化学成分含量有一定差异(表2)。
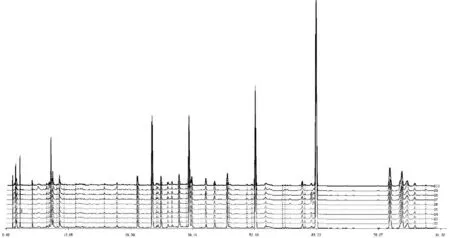
图2 不同批次产地鲜加工片姜黄指纹图谱叠加

注:13(a)莪术二酮;19(b)吉马酮;22(c)呋喃二烯;23(d)β-榄香烯
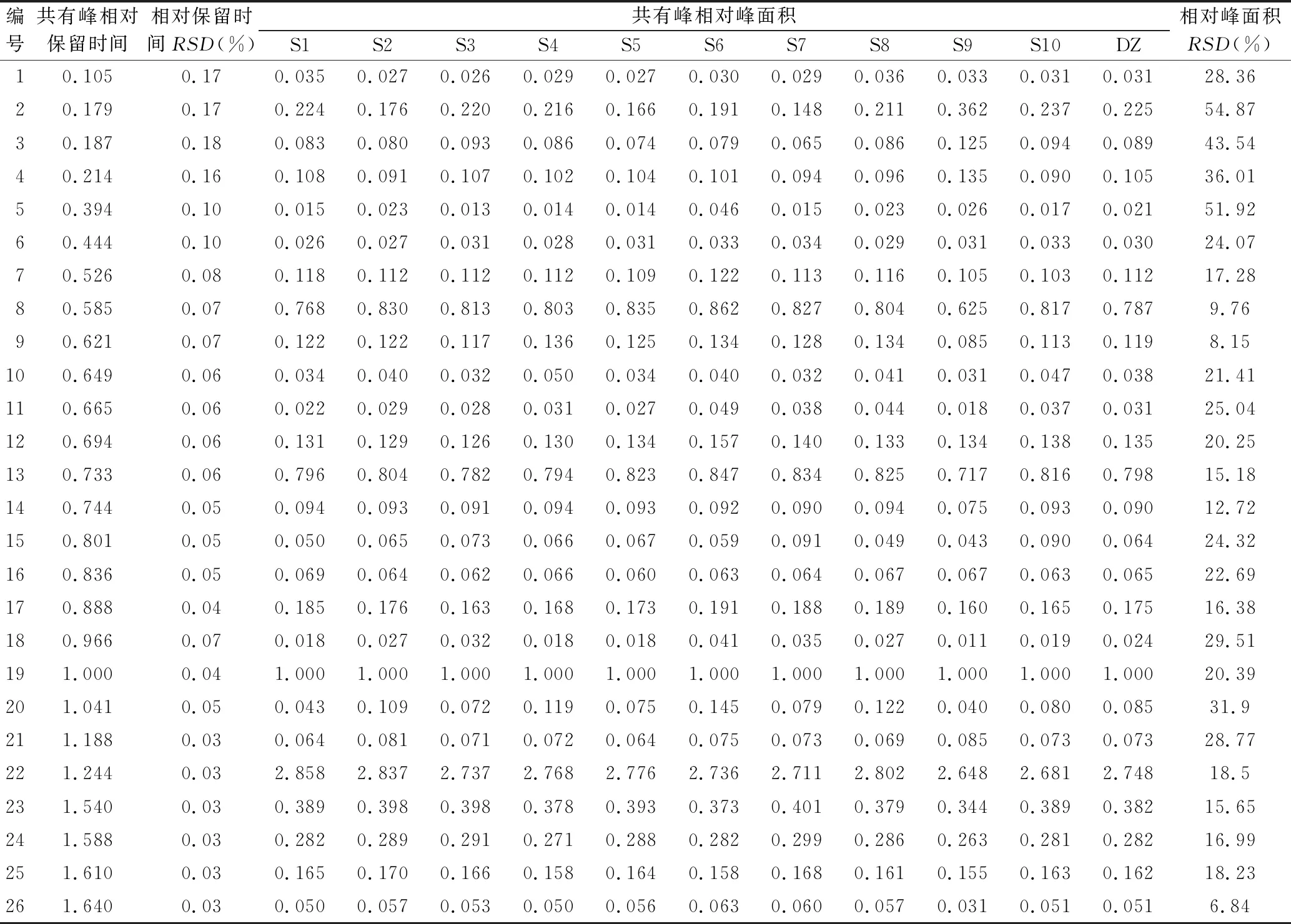
表2 不同批次产地鲜加工片姜黄指纹图谱共有峰信息
2.6 不同批次产地鲜加工片姜黄指纹图谱相似度评价
用“中药色谱指纹图谱相似度评价系统2004A版”对所得片姜黄指纹图谱进行分析,各批产地鲜加工片姜黄HPLC指纹图谱的相似系数为0.991~1.000,说明片姜黄为温郁金干燥根茎,来源单一,且地域局限,各化学成分组成无明显差异。
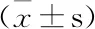

编号S1S2S3S4S5S6S7S8S9S10DZS110.9990.9990.9990.9990.9960.9970.9990.9970.9980.999S20.99910.9990.9990.9990.9980.9980.9990.9950.9990.999S30.9990.999110.9980.9980.9990.9990.9960.9990.999S40.9990.999110.9980.9980.9980.9990.9960.9991S50.9990.9990.9980.99810.9970.9980.9990.9950.9990.999S60.9960.9980.9980.9980.99710.9990.9980.9910.9970.998S70.9970.9980.9990.9980.9980.99910.9980.9920.9980.999S80.9990.9990.9990.9990.9990.9980.99810.9960.9991S90.9970.9950.9960.9960.9950.9910.9920.99610.9960.997S100.9980.9990.9990.9990.9990.9970.9980.9990.99610.999DZ0.9990.9990.99910.9990.9980.99910.9970.9991
3 讨论
产地鲜加工片姜黄其化学成分含量也存在较大的差异。不同的种植地、不同的田间管理方式、不同的采收时间和不同的加工方式也会导致片姜黄品质间的差异。
历版《中国药典》和各省市的炮制规范对片姜黄质量标准的记载都非常有限,本研究中得到的片姜黄指标性成分是否能成为标准,进而对片姜黄质量进行评价,还需进一步对片姜黄饮片的稳定性进行考察,分析不同储存条件、不同储存时间对片姜黄品质的影响。
基于上述情况,笔者初步分析市场上流通的片姜黄:①来源不一,除温郁金外,可能把其他产地如广西莪术、蓬莪术也加工作为片姜黄用;②来源都为温郁金,但是在储存过程中,由于储存条件不同,片姜黄化学成分发生了不定性变化。
