复方薏荷茶对肥胖小鼠改善胰岛素抵抗的调节机制研究
2020-05-12郭聪颖杨松林廖玮涛莫凌峰周丹水倪维鞠
郭聪颖,杨松林,王 军,廖玮涛,莫凌峰,周丹水,倪维鞠,曾 宇,4*
(1广东药科大学中药学院,广州510006;2广州安诺科技股份有限公司,广州510530;3长沙毕基卡莫医学科技有限公司,长沙410007;4广东高校中药质量工程技术研究中心,广州510080)
随着人们生活水平的提高,肥胖问题已经成为严重的公共健康问题。肥胖患者患高血脂、高血糖等疾病的风险大大增加,并且肥胖患者伴有的胰岛素抵抗症状会使机体葡萄糖代谢紊乱,是引发糖尿病的重要原因之一[1]。研究发现,肥胖可能使肝脏和脂肪组织中胰岛素受体对胰岛素的敏感性降低,进而影响脂肪组织中的胰岛素代谢下游通路PI3K-Akt-GLUT4中GLUT4对葡萄糖的转运作用,造成葡萄糖代谢失衡引起血糖升高[2]。胰岛素抵抗还会加重肝细胞中脂质的沉积,造成肝损伤[3]。复方薏荷茶主要由薏苡仁、荷叶、山楂、陈皮和决明子5种中药材组成,与单味药不同,复方药物可以通过药物之间协同或拮抗的作用达到增效减毒的功效。在复方薏荷茶中,薏苡仁为君药,可利水渗湿、行气健脾;荷叶和山楂作为臣药,升发清阳;佐以陈皮和决明子,燥湿祛痰、理气健脾。该复方主旨药食同源,诸药协同达到渗湿浊、补中气的作用。本实验通过高脂饮食诱导小鼠出现胰岛素抵抗症状,观察复方薏荷茶对肥胖小鼠导致的胰岛素抵抗的调节作用。
1 材 料
1.1 药材与试剂
复方薏荷茶,主要配方为:薏苡仁、荷叶、山楂、陈皮和决明子,由湖南土家族医莫氏研发,经长沙毕基卡莫医学科技有限公司生产。HE染色试剂盒(南京建成生物工程研究所);油红O染色试剂盒(北京索莱宝科技有限公司);PI3K,p-Akt,Akt抗体(美国 CST公司);GLUT4抗体(英国Abcam公司)。
1.2 仪 器
ASP200S石蜡脱水机、Historore ArcadiaH石蜡包埋机、RM2235石蜡切片机、DMI3000B显微镜(德国Leica公司);血糖仪、血糖试纸(江苏省鱼跃医疗设备有限公司);ZY-1200M自动生化仪(上海市科华生物工程股份有限公司)。
1.3 动 物
SPF级4周龄雄性C57BL/6J小鼠32只,体质量为15~17 g,购自广东省医学实验动物中心,合格证号SCXK(粤)2013-0002。实验获得广东药科大学实验动物伦理委员会的批准。
1.4 动物饲料
空白组给予正常标准饲料(脂肪含量10%),其余组给予高脂饲料(脂肪含量37%;52.2%基础饲料,20%蔗糖,15%猪油,1.2%胆固醇,0.2%胆酸钠,10%酪蛋白,0.6%磷酸氢钙,0.4%石粉,0.4%预混饲料)饲养。饲料由广东省医学实验动物中心提供。
2 方 法
2.1 药品的配制
精密称取复方薏荷茶100 g,置入2 000 mL烧杯,加自来水1 000 mL,煎煮30 min,用纱布过滤得滤液。取滤渣,再置入烧杯,加自来水1 000 mL,煎煮30 min,用纱布过滤,合并两次滤液,浓缩至500 mL,得高浓度复方薏荷茶0.2 g/mL的原液备用。低浓度复方薏荷茶配制成0.1 g/mL供低浓度组使用。
2.2 动物分组造模与给药
将小鼠用标准饲料适应性喂养1周后随机分为正常组(NFD,n=8)、高脂饲料造模组(n=24)。喂养到第6周,将3笼高脂饲料造模组的小鼠体质量和血糖分别与空白组进行单因素方差分析,若P<0.05,证明肥胖模型造模成功,剔除不成模的小鼠。将造模成功的小鼠随机分成模型组(HFD)、复方薏荷茶低浓度组[20 mg/(kg·d)](YH-L)和复方薏荷茶高浓度组[40 mg/(kg·d)](YH-H),每组8只。空白组和模型组给予相同体积的生理盐水,空白组给予普通;饲料模型组,复方薏荷茶低浓度组和复方薏荷茶高浓度组给予高脂饲料。
2.3 实验指标及测定
2.3.1 摄食量,体质量及Lee′s指数 每天记录小鼠的体质量和摄食量。饲养12周后,小鼠禁食12 h,自由饮水,称重,记录体长(鼻尖至肛门的长度),计算 Lee′s指数。Lee′s指数 =[体质量(g)×1 000/体长(cm)]1/3。
2.3.2 空腹血糖 分别在喂养到第6周,第9周和第11周的时候将小鼠禁食8 h后将小鼠尾部剪去2 mm,去掉尾静脉流出的第1滴血,用医用血糖试纸吸取第2滴测定小鼠的空腹血糖。
2.3.3 口服糖耐量 饲养到11周时,将小鼠禁食8 h,将小鼠尾剪去约2 mm后,去掉尾部静脉流出的第1滴血,用医用血糖试纸吸取第2滴测量尾静脉血糖。取数值0 min的基础血糖值,随后各组小鼠分别灌胃葡萄糖溶液(2 g/kg),测定间隔时长为15、30、60、120 min的血糖含量,最后计算曲线下面积。
2.3.4 生物样品的取材及生化指标 给药结束后,小鼠禁食12 h,自由饮水。进行摘除眼球取血,将全血于1.5 mL离心管中常温静置30 min后,4℃,3 000 r/min离心 15 min,获得血清,-80℃冰箱中保存备用。取血后,颈椎脱臼处死小鼠,于冰上快速取肾周脂肪、肠系膜脂肪及附睾周围脂肪以及肝脏,用生理盐水清洗组织后称取湿重,将所有脂肪组织及部分肝脏组织放到冻存管中液氮快速冷冻后转移到-80℃冰箱中保存备用。将另一部分小鼠肝组织置于4%多聚甲醛中4℃浸泡。全自动生化仪测定血清样品中总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密脂蛋白胆固醇(LDL-C)的含量。
2.3.5 肝脏组织病理观察 肝脏组织在4%多聚甲醛中浸泡48 h后取出,经二甲苯和乙醇梯度脱水处理后用石蜡包埋切片,将切片于梯度乙醇和二甲苯中脱腊,然后肝脏组织切片用HE染料染色和油红O染料染色,切片脱水处理后用中性树胶封片,在正置显微镜下进行病理组织学观察。
2.3.6 Western blot法检测 PI3K、Akt、GLUT4的表达量 取附睾脂肪组织0.1 g,称重后放入匀浆器中制成组织匀浆 12 000 r/min,4℃下离心15 min取上清液,BSA法测定蛋白浓度后调整每组蛋白浓度约为12μg/μL,-20℃保存蛋白提取液。每个电泳槽加入相同蛋白质量的组织样品用SDS-PAGE电泳后进行转膜。用5%的脱脂奶粉室温下封闭PVPE膜,90 min后,在4℃条件下分别进行抗体 GLUT4、PI3K、p-Akt、Akt和 GADPH的孵育过夜,第2天用PBST清洗PVEP膜后37℃孵育兔源二抗60 min,用ECL发光液进行显影。
2.3.7 免疫组化法检测肝脏中GLUT4的表达量
将肝组织的石蜡切片后进行脱腊及抗原修复处理,然后用3%双氧水37℃避光孵育25 min,用1%的BSA封闭60 min后,在4℃下孵育GLUT4一抗过夜,后滴加兔源二抗37℃孵育60 min,用DAB显色液进行显色,苏木精复染3 min水洗后脱水,封片,在显微镜下镜检。
2.4 统计学分析
用IBM SPSSStatistics 19.0统计软件对数据进行统计学分析,计量资料表示方法为±s,采用单因素方差分析的方法进行组间的显著性比较。Image J软件对Western blot和免疫组化结果进行灰度半定量分析。将P<0.05作为差异并且有统计学意义。
3 结 果
3.1 对高脂血症小鼠体质量和摄食量的影响
图1-A显示,经过6周的高脂饲料饲养后,高脂饲料造模组的小鼠体质量显著高于正常组(P<0.01),证明小鼠肥胖造模成功。6周后将高脂饲料造模组随机分成模型组、复方薏荷茶高、低浓度组,进行6周的灌胃给药,复方薏荷茶低浓度小鼠体质量与模型组相比无统计学意义,复方薏荷茶高浓度小鼠体质量与模型组相比有显著性差异(P<0.01)。每日平均食物摄取量(图1-C)结果显示复方薏荷茶高浓度小鼠的饲料摄入量显著低于模型组(P<0.01)。而从(图1-B)来看,各组之间Lee′s指数没有显著性差异。
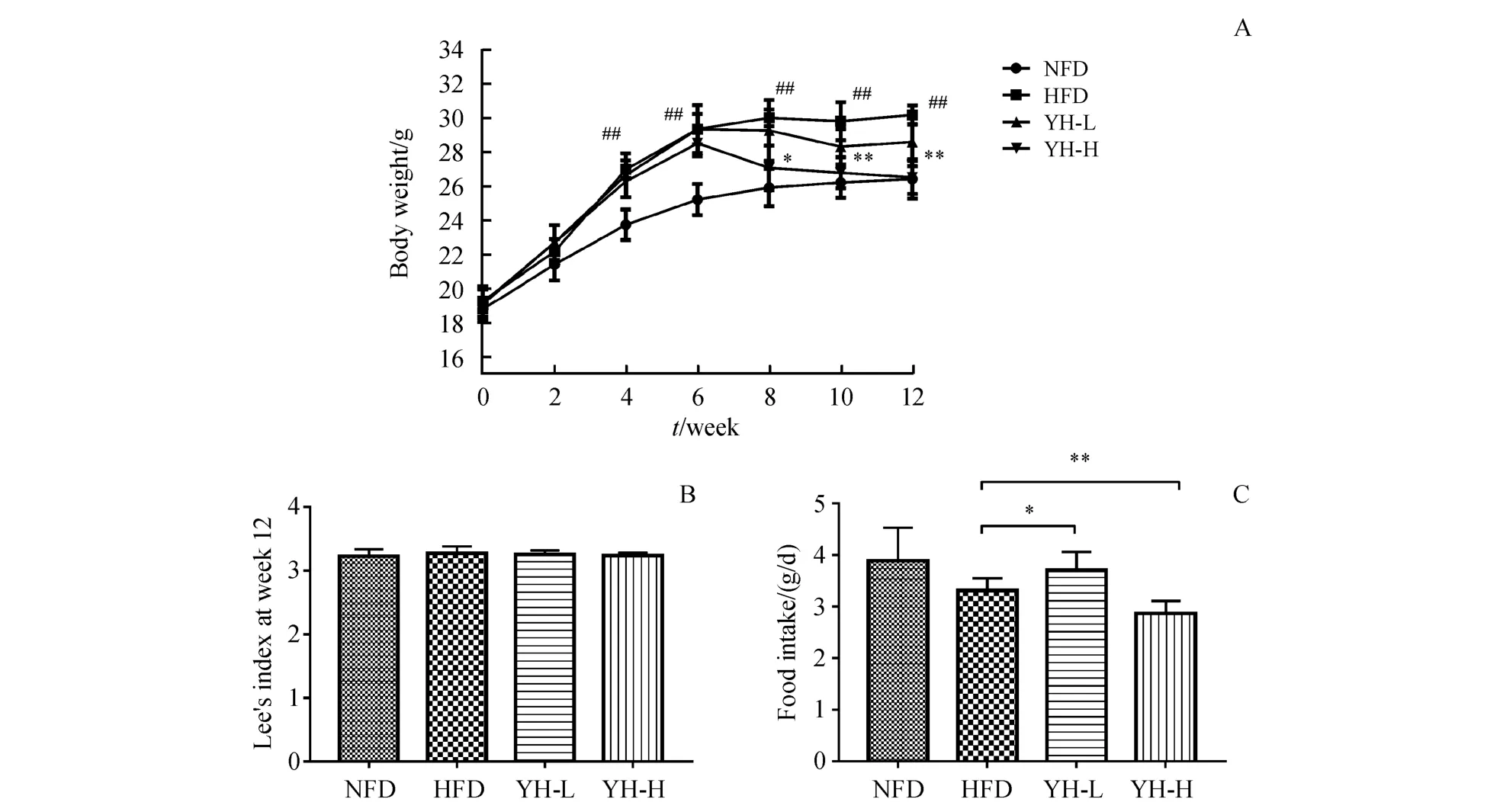
Figure 1 Effect of Compound Yihe Tea on body weight(A),Lee′s index(B)and food intake(C)in obese C57BL/6Jmice(±s,n=8)NFD:Normal fat diet group;HFD:High fat diet group;YH-L:Compound Yihe Tea low dosage group[20 mg/(kg·d)];YH-H:Compound Yihe Tea high dosage group[40 mg/(kg·d)]#P<0.05,##P<0.01 vs NFD group;*P<0.05,**P<0.01 vs HFD group
3.2 对高脂血症小鼠脂肪和肝脏湿重的影响
图2-A结果显示,C57BL/6J小鼠各部位脂肪组织(附睾脂肪、肾周脂肪、肠系脂肪、总脂肪)重量及总脂肪系数分析可得。模型组附睾脂肪重量显著高于复方薏荷茶高、低浓度组(P<0.001)。总脂肪的重量,在模型组与空白组以及复方薏荷茶高、低浓度组之间分别存在十分显著的差异(P<0.001)。总脂肪系数统计(图2-B)显示,模型组总脂肪系数远大于其他3组,且模型组和复方薏荷茶高、低浓度组相比具有显著性的差异(P<0.01)。在图2-C和图2-D中,复方薏荷茶高浓度组小鼠肝脏湿重和肝脏指数显著低于模型组(P<0.01),复方薏荷茶高浓度组小鼠肝脏指数显著低于模型组(P<0.01)。
3.3 对高脂血症小鼠口服葡萄糖耐量和血糖的影响
对C57BL/6J小鼠第6周,第9周和第11周的血糖进行测定分析,图3-A结果显示,在第6周高脂饲料造模组小鼠血糖水平显著高于正常组小鼠的血糖水平(P<0.05),表示造模成功。图3-B表明在第12周时,复方薏荷茶低浓度组血糖水平低于模型组(P<0.05),复方薏荷茶高浓度组血糖水平显著低于模型组(P<0.01)。从图3-C结果中可知,在灌服葡萄糖15 min后复方薏荷茶高、低浓度组的血糖均比模型组显著降低(P<0.01,P<0.05)。30 min后复方薏荷茶高、低浓度组血糖均显著降低(P<0.01,P<0.001),在60 min和120 min时复方薏荷茶高浓度组与模型组相比血糖显著降低(P<0.01)。图3-D通过计算葡萄糖耐量的曲线下面积,复方薏荷茶高浓度组的曲线下面积显著低于模型组(P<0.05)。
3.4 对高脂血症小鼠血脂水平的影响
与模型组相比,图4-A显示低浓度和高浓度复方薏荷茶可显著降低血清三酰甘油水平(P<0.01,P<0.001)。图4-B显示在复方薏荷茶低浓度和高浓度两组中总胆固醇水平有下降的趋势。图4-C结果显示,复方薏荷茶高浓度与模型组相比可显著降低密度脂蛋白胆固醇水平(P<0.01)。
3.5 对高脂血症小鼠肝脏组织病理学的影响
图5-A中HE染色结果显示,正常组小鼠的肝组织在400倍视野下,很难以清晰地观察到脂肪滴和脂肪滴聚集的存在。模型组肝细胞排列比较混乱,脂肪滴的数量过多及受聚集的脂肪滴挤压的情况下。在400倍视野下,可以十分明显地观察到模型组的细胞数目比空白组少,除了聚集的脂肪滴外,更能清晰观察到肝细胞内部存在非常多细小的脂肪滴。与模型组相比较,复方薏荷茶高、低浓度组均具有显著性地降低脂肪滴数目的作用和抑制肝脏脂化的作用,且高浓度的作用比低浓度明显。图5-B的油红O染色结果显示,模型组中脂肪着色明显,在400倍的视野下,能清晰观察到大量的脂肪滴脂肪颗粒。复方薏荷茶低浓度,高浓度组与模型组相比,切片内的脂肪颗粒数量明显减少,排布明显更稀疏,能清晰观察到细胞内脂肪滴和脂肪颗粒的密度明显比模型组低。
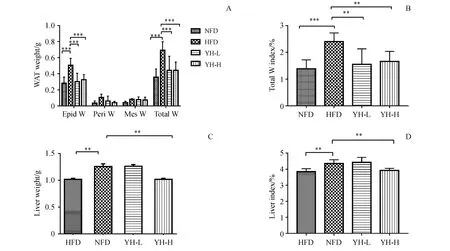
Figure 2 Effect of Compound Yihe Tea on organ weights in obese C57BL/6Jmice(x¯±s,n=8)A:White adipose tissue(WAT)weight;B:Total W index;C:Liver weights;D:Liver indexEpid W:Epididymis WAT;Peri W:Perirenal WAT;Mes W:Mesenteric WAT;Total W:Total weight of Epid W,Peri W and Mes W**P<0.01,***P<0.001 vs HFD group
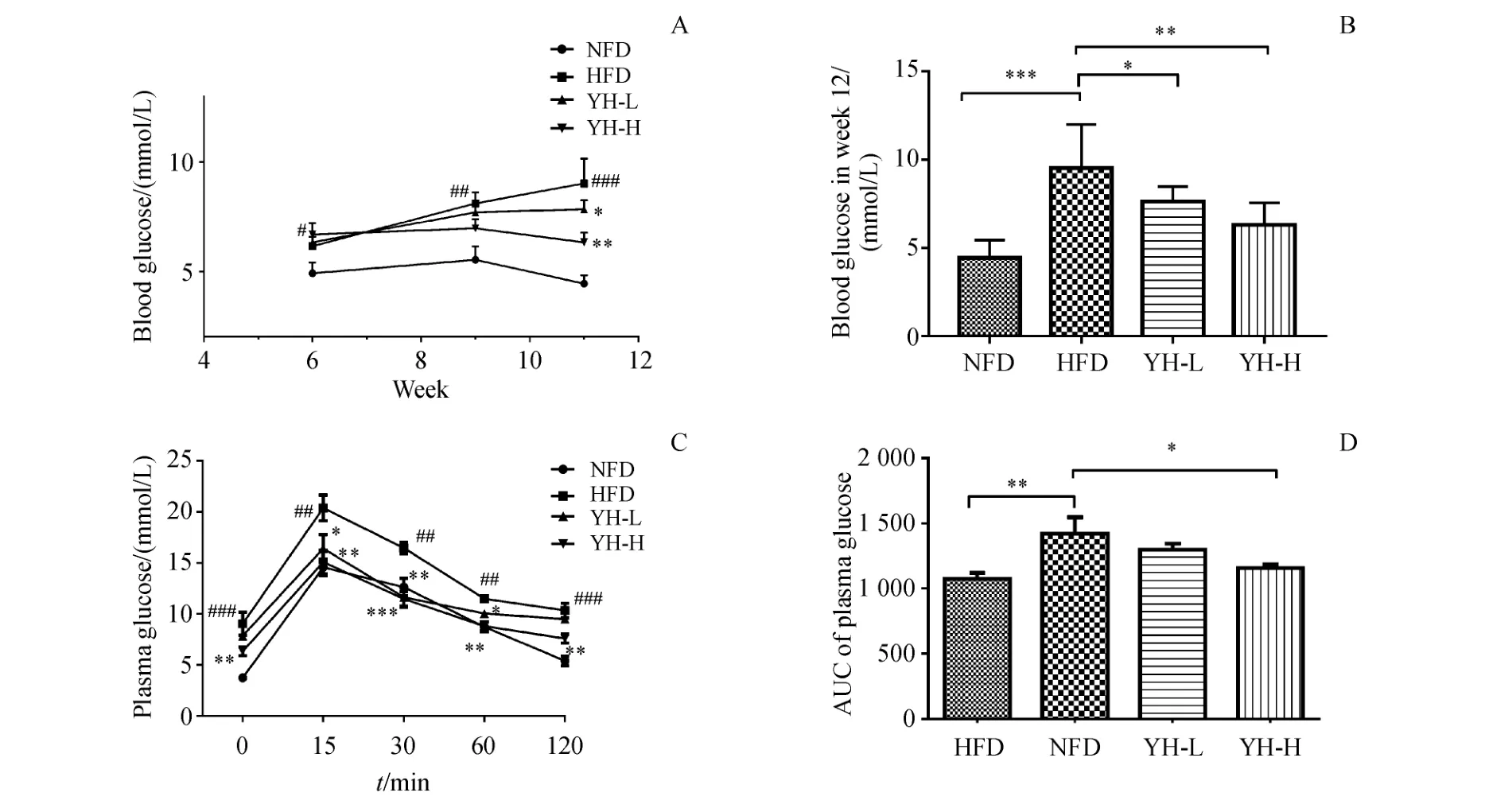
Figure 3 Effect of Compound Yihe Tea on bloody glucose and glucose tolerance in obese C57BL/6J mice(x¯±s,n=8)A:Blood glucose levels at week 6,9 and 11;B:Blood glucose levels at week 12;C:Glucose tolerance test(OGTT)at week 11;D:Area under the cover(AUC)of OGTT at week 11*P<0.05,**P<0.01,***P<0.001 vs HFD group;#P<0.05,##P<0.01 vs NFD group
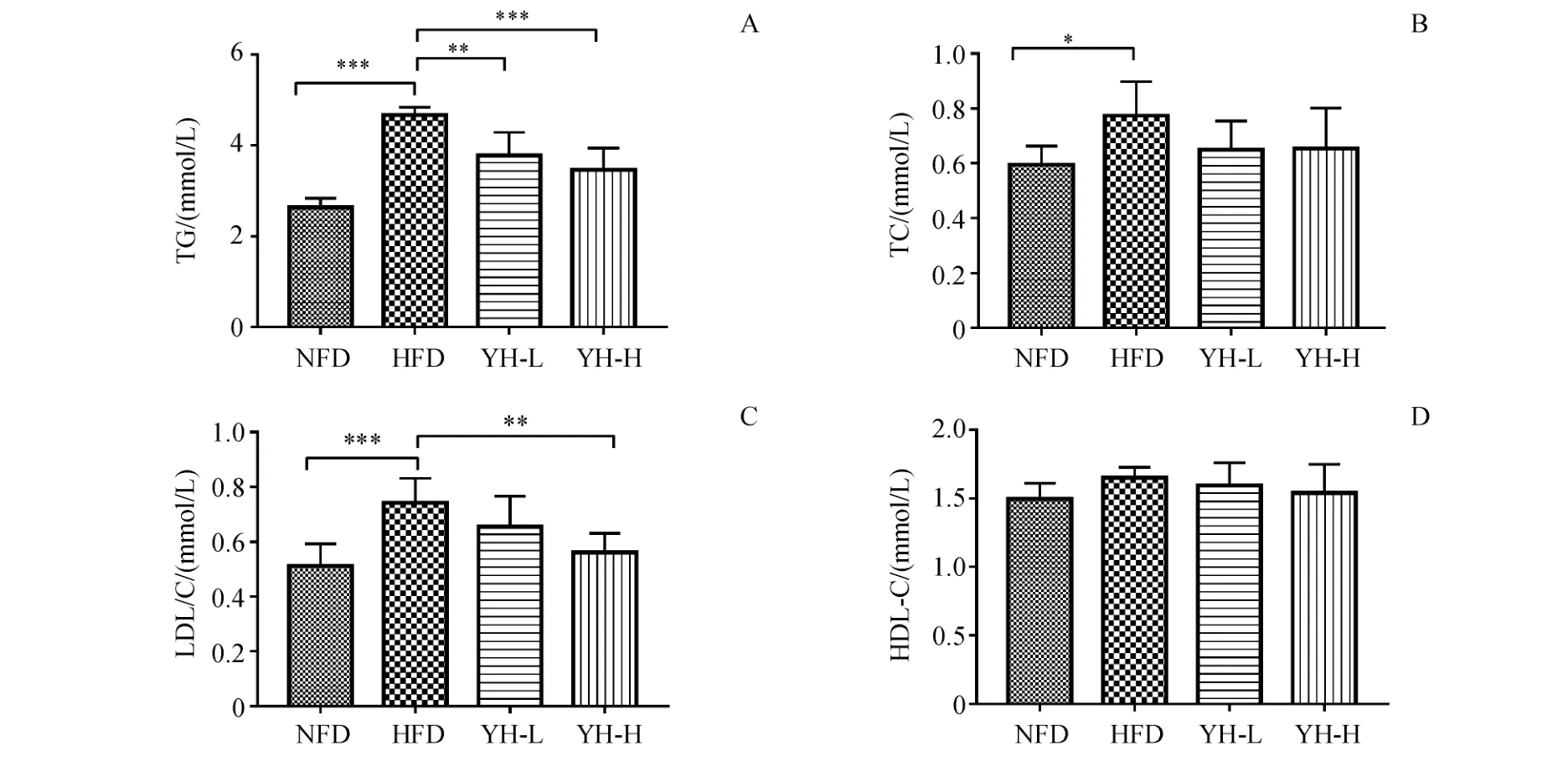
Figure 4 Effect of Compound Yihe Tea on lipid metabolic parameters in obese C57BL/6J mice(x¯±s,n=8)A:Triglycerides(TG);B:Total cholesterol(TC);C:Low-density lipoprotein cholesterol(LDL-C);D:High-density lipoprotein cholesterol(HDL-C)*P<0.05,**P<0.01,***P<0.001 vs HFD group
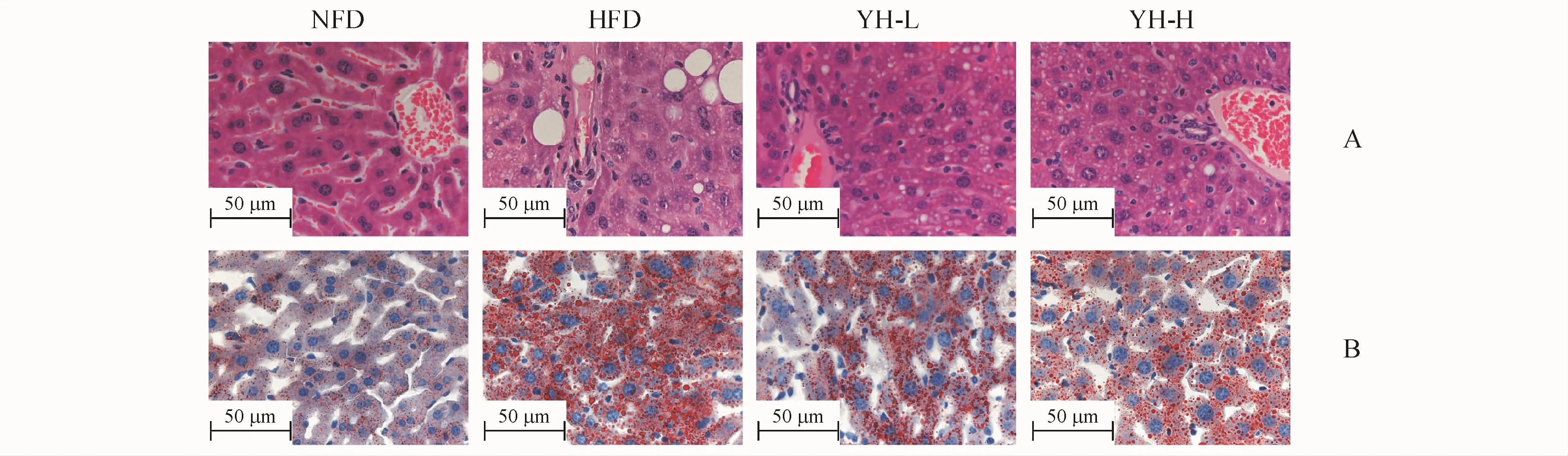
Figure5 Effect of Compound Yihe Tea on pathological liver changes HE staining(A)and oil red Ostaining(B)in obese C57BL/6Jmice(×400)
3.6 对高脂血症小鼠附睾脂肪组织中PI3K,p-Akt,GLUT4蛋白表达的影响
与模型组相比,复方薏荷茶高浓度组PI3K蛋白的表达显著性增加(P<0.01);复方薏荷茶高、低浓度组均可显著性增强 p-Akt的表达(P<0.001);对GLUT4的表达量进行测定,结果可知复方薏荷茶低浓度组高于模型组(P<0.05),复方薏荷茶高浓度组显著高于模型组(P<0.01),见图6。
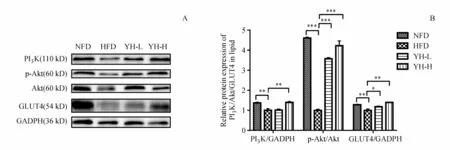
Figure 6 Effect of Compound Yihe Tea on relative protein expression of PI3K/GADPH,p-Akt/Akt,GLUT4/GADPH in epididymis WAT A:Western blot bands of PI3K,p-Akt,Akt,GLUT4 and GADPH;B:Analysis of relative protein expression by software Image J(±s,n=8)*P<0.05,**P<0.01,***P<0.001 vs HFD group
3.7 复方薏荷茶对高脂血症小鼠肝脏组织中GLUT4蛋白表达的影响
用免疫组化法对肝脏组织GLUT4蛋白表达量进行测定,结果显示,模型组中GLUT4蛋白的表达量小于正常组(P<0.05),复方薏荷茶高、低浓度组中 GLUT4蛋白表达量均高于模型组(P<0.05),见图 7。
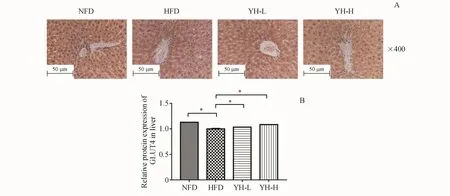
Figure 7 Effect of Compound Yihe Tea on immunohischemistry stain of the GLUT4 in liver tissueA:IHC staining of livers with GLUT4(×400);B:Analysis of protein expression on GLUT4 by software Image J(±s,n=8)*P<0.05 vs HFD group
4 讨 论
本研究表明,复方薏荷茶可以有效提高肥胖模型小鼠的葡萄糖耐受能力,降低高脂饲料诱导肥胖小鼠的血糖水平。对小鼠血脂相关指标(TC、TG、HDL-C和LDL-C)的测定结果显示,复方薏荷茶各组可以显著降低实验性肥胖C57BL/6J小鼠血清中TC水平,TG和LDL-C水平且效果与浓度呈正相关。实验发现复方薏荷茶对HDL-C水平的影响并不显著,并且在针对HDL-C的研究中发现HDLC无论是过高还是过低都会增加高脂血症的患病风险[4]。因为TC水平过高已被认为是心血管疾病的主要危险因素,LDL-C是降脂治疗的主要目标,而TG则成为另一个主要危险因素[5]。所以,复方薏荷茶能显著性降低实验性肥胖C57BL/6J小鼠血清中TC水平的同时,也一定程度地降低其LDL-C水平,能一定程度缓解脂代谢紊乱引起的动脉粥样硬化病变,且上述作用效果与复方薏荷茶的某些有效成分浓度呈正相关关系。
从脂肪组织的结果分析,给药复方薏荷茶高浓度后能极显著地减少实验性肥胖C57BL/6J小鼠的附睾脂肪的重量和脂肪系数,并对肝组织湿重有一定的影响。复方薏荷茶可能具有促进脂肪组织分解代谢和(或)抑制脂肪组织合成的有效成分。但从结果可知,该有效成分的作用效果可能与浓度无关,可能是因为该有效成分是通过激活与脂肪组织合成、分解代谢有关的受体和(或)酶,所以该有效成分的作用与受体和(或)酶的数目关系更为相关。对肝组织湿重的结果分析并结合肝组织的HE染色和油红O染色的切片结果,复方薏荷茶可以显著地缓解在高脂饮食诱导下C57BL/6J小鼠肝中油脂的蓄积现象,且复方薏荷茶高浓度组的作用比复方薏荷茶低浓度组明显。所以复方薏荷茶通过减少脏组织中脂肪细胞的堆积从而减轻肝组织重量。
胰岛素抵抗与脂肪和肝代谢有密切关系[6-7]。脂肪组织作为能量调节器可以通过调节白色脂肪的合成与释放进而调节能量的摄入和消耗[8]。PI3K-Akt-GLUT4通路是胰岛素调节血糖的下游主要通路[9],在肝和脂肪组织中胰岛素可以通过激活胰岛素受体(IRS)激活 PI3K[10],研究中发现肥胖可以导致脂肪组织中PI3K与IRS相结合的蛋白表达量减少,进而导致PI3K活性下降[11]。GLUT4是一种细胞膜蛋白,它可以通过由膜内到膜外的转运增加葡萄糖的消耗[12],胰岛素入血后胰岛素受体底物(IRS)被激活,进而激活PI3K-Akt通路使得GLUT4的表达增加,并且会使含有GLUT4的胞内囊泡移动到细胞膜上面,提高了胰岛素对葡萄糖的利用[13-14]。本研究发现,复方薏荷茶可以增加小鼠附睾脂肪组织中PI3K-Akt-GLUT4蛋白的表达,从肝脏的免疫组化研究结果可知,复方薏荷茶同样可以增加肝脏组织中GLUT4蛋白含量的表达,可以通过增加外周组织对葡萄糖的利用进而达到降低血糖的目的。
