非洲猪瘟病毒与宿主细胞相互作用研究进展
2020-05-11陈南华钱莺娟陈鸿军郭晓宇朱建中
敖 大,陈南华,钱莺娟,陈鸿军,郭晓宇,张 泉,朱建中
(1.扬州大学兽医学院,扬州225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;3.农业与农产品安全国际联合研究实验室,扬州225009;4.南京农业大学动物医学院,南京 210095;5.中国农业科学院上海兽医研究所,上海200241;6.中国农业科学院北京畜牧兽医研究所,北京100193)
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的家养猪高热、急性和高死亡率的出血症和淋巴组织坏死症,对养猪业造成严重危害。ASFV除感染家猪和野猪外,也感染自然储存宿主包括非洲疣猪和丛林猪,还有无脊椎节肢动物软蜱虫;除家猪和野猪外,病毒在自然宿主体内形成持续性感染,不表现明显的疾病症状[1]。
ASFV是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员,也是唯一已知的虫媒DNA病毒。ASFV是胞浆内双链DNA大病毒,隶属核浆大DNA病毒(Nucleo-cytoplasmic large DNA viruses,NCLDV)超家族。外形为正六边形,直径约200 nm。病毒粒子由内而外分别由病毒拟核基因组(nucleoid)、核心壳(core shell)、内膜(inner envelope)、衣壳(capsid)和外膜(external envelope)五部分组成[2](图1)。基因组为170~190 kb线性双链DNA,编码超过151~167种蛋白质,其中54种结构蛋白和100多种非结构蛋白。只有少量蛋白为病毒复制所必需,而许多蛋白质参与病毒和宿主的相互作用。根据该病毒主要衣壳蛋白p72编码的基因序列,可将该病毒分为24个不同的基因型[3]。
2018年之前,该病已经在临近中国的俄罗斯、乌克兰等地区流行,2018年8月初,国内猪群出现非洲猪瘟,病毒为基因Ⅱ型,对中国养猪业构成巨大威胁[4]。
1 ASFV与宿主细胞受体和内体系统的相互作用
1.1 病毒蛋白与细胞受体 ASFV自然感染单核-巨噬细胞系统主要包括巨噬细胞和单核细胞,ASFV吸附和结合细胞的受体和相应的病毒蛋白还不明确。细胞清道夫受体CD163曾经被认为可能是病毒结合的细胞受体,CD163表达量和病毒感染具有正相关,但后来CD163过表达实验和CD163基因敲除细胞和动物实验不支持这一设想[5]。有报道病毒膜蛋白p12介导ASFV结合靶细胞,因为p12重组蛋白和抗体均能抑制ASFV感染靶细胞[6]。ASFV通过细胞内化作用进入自然感染细胞,ASFV衣壳蛋白p72和内膜蛋白p54可能参与了病毒结合细胞,而ASFV膜相关抗原蛋白p30可能参与了病毒内化,但其它更多病毒蛋白可能参与了病毒的细胞入侵[7]。
1.2 ASFV与细胞内化系统 ASFV通过网格蛋白依赖的内吞(clathrin-mediated endocytosis,CME)或者巨胞饮(macropinocytosis)内化进入自然感染细胞。CME内化过程中,ASFV和细胞受体一道被网格蛋白形成的细胞膜凹陷所包裹,凹陷小体被GTP酶(GTPase)发动蛋白(dynamin)切割从细胞膜分离,从而形成早期内体[5]。巨胞饮过程中,ASFV结合细胞受体后,激活细胞PI3K、EGFR、Rac-1、Pak-1信号,这些信号活化肌动蛋白(actin)重排在细胞膜表面形成皱褶从而内化病毒;内化形成的胞饮小体相当于细胞早期内体[5,8]。两种病毒内化途径并不排斥,而是相互协作,如肌动蛋白重排也参与CME过程[5]。
1.3 ASFV与细胞内体迁移系统 ASFV进入细胞最初在早期内吞小体(early endosome,EE)或胞饮小体中,和其它通过内化途径感染细胞的病毒一样,ASFV劫持了细胞的内体/溶酶体系统。伴随着早期内吞小体(内体)在细胞内迁移和成熟转变成偏酸性的多泡体(multiple vesicular body,MVB)、晚期内体(late endosome,LE)或与溶酶体融合的内体溶酶体,AFSV脱去衣壳并穿透进入细胞浆[5]:感染后5~30 min,ASFV衣壳蛋白和内膜蛋白在早期内体或胞饮小体中能够检测到,并和早期内体标识蛋白EEA1和Rab5共定位[9];感染后30~90 min,ASFV内膜蛋白p17和内核壳蛋白p150可以检测到与多泡体(MVB)标识蛋白CD63,晚期内体标识蛋白Rab7或溶酶体标识蛋白Lamp1共定位[10]。感染后60 min左右,ASFV在酸性多泡内体内开始脱外壳,包括外膜蛋白和衣壳蛋白。在晚期内体,ASFV完成了脱外壳,但解离破碎的外膜蛋白仍然存在。然后ASFV内膜蛋白pE248R和内体膜胆固醇一起介导病毒内膜和细胞内体膜的融合[8],同时ASFV核心壳前体蛋白pp220发生酶解,导致病毒内核与病毒内膜分开,并从晚期内体释放到胞浆中[11]。
2 ASFV与宿主细胞蛋白合成系统的相互作用
2.1 ASFV病毒工厂 ASFV劫持并改变细胞反式高尔基网络-内体系统以利于病毒感染[12]。宿主接头蛋白AP-1与网格蛋白(clathrin)结合并参与选择网格蛋白包裹小体所要运输的货物蛋白种类;ASFV外膜蛋白CD2v与AP-1结合可能影响网格蛋白包裹小体/内体在细胞内迁移,诱导新型膜结构形成。这些膜结构与病毒基因组,病毒复制酶和宿主蛋白一起构成病毒复制和形态发生的中心,即位于核周微管组织中心(microtubule organizing center,MTOC)的病毒工厂(viral factory,VF)[13]。从内体释放的ASFV核心壳通过病毒内膜蛋白p54结合微管动力蛋白激发微管系统迁移到核周MTOC区域进行病毒蛋白合成、DNA复制和病毒组装等复制步骤,形成聚集颗粒样的病毒富集工厂(VF),深刻改变宿主的基因转录、蛋白翻译、细胞存活/凋亡和细胞自噬等细胞生物学行为[9,12]。
2.2 ASFV与宿主基因转录 ASFV蛋白A238L是细胞IκB同源蛋白,在病毒感染不同时期都有表达。A238L能通过不同的作用机制抑制转录因子NF-κB和NF-AT,以及转录辅助因子CBP/p300的活性,从而抑制炎症因子和免疫调节因子如TNF-α、COX-2等基因的转录表达[14]。其它ASFV病毒蛋白包括A224L增强转录因子NF-κB活性,ASFV j4R干扰c-Jun活性[15],UBCv影响细胞核蛋白SMCy的活性[16]。
2.3 ASFV与宿主蛋白合成 AFSV能劫持细胞的翻译起始因子(eukaryotic initiation factor,eIFs)包括eIF2和eIF4F系统为己所用,如病毒蛋白DP71L和宿主磷酸酶1(phosphatase 1,PP1)结合,能去磷酸化eIF2α,增强病毒蛋白的合成[17];ASFV IAP同源蛋白A224L,能抑制Caspase-3对eIF4F复合物(eIF4A、eIF4E和eIF4G)中eIF4G的降解,促进病毒蛋白的合成[18]。ASFV能促进mTOR介导eIF4G上108位丝氨酸磷酸化,促进Mnk-1介导eIF4E上209位丝氨酸磷酸化,增强病毒蛋白合成。ASFV在感染早期,促进4E-BP磷酸化和病毒蛋白翻译,在感染晚期则促进4E-BP去磷酸化以抑制翻译。AFSV还能动员翻译组分eIFs进入颗粒样病毒聚集点(VF),从而促进病毒蛋白合成,同时抑制宿主蛋白合成[14]。
3 ASFV与宿主细胞凋亡和内质网应激系统的相互作用
ASFV在细胞酸性内体中脱衣壳,以及内膜蛋白和细胞内体膜的融合可能激发细胞早期的凋亡[19]。病毒内膜蛋白p54结合微管动力蛋白轻链(light chain of dynein,DLC8),与Bcl-2家族凋亡蛋白Bim-3竞争结合DLC8,将Bim-3从DLC8上解离,从而激发线粒体介导的细胞凋亡[20]。此外内质网 (endoplasmic reticulum,ER)应激介导ASFV晚期的细胞凋亡,以Caspase-12活化为特征[21],病毒感染晚期的细胞凋亡有助于病毒颗粒的释放和病毒感染的扩散。
3.1 ASFV与细胞凋亡抑制 病毒感染早期引起的细胞凋亡是宿主细胞的防卫措施,对病毒感染不利。ASFV编码了多个蛋白抑制感染早期的细胞凋亡[22]。A179L: Bcl-2蛋白家族含4个Bcl-2同源区(BH1~4),这些同源区决定Bcl-2蛋白是促进或抑制细胞凋亡,单个BH3蛋白亚家族感受细胞损伤启动细胞凋亡,这些蛋白包括Bim、Bid、Puma、Noxa、Bmf、Bik、Bad和Hrk,通过直接结合下游Bak和Bax发挥作用。ASFV编码18 kDa的A179L,感染早期和晚期均有表达,在多种不同的细胞系统中表现出抑制细胞凋亡效应,A179L和促凋亡的单个BH3蛋白亚家族成员Bid、Bim、Puma及下游Bak、Bax基于同源性都有高亲和力结合,从而达到抑制凋亡的目的。A179L也和Beclin-1结合抑制细胞自噬,自噬抑制有利于病毒感染[23]。A224L:是抑制凋亡蛋白(inhibitor of apoptosis,IAP)家族的类似物,在ASFV感染不同时期均有表达。一方面与酶解的Caspase-3片段结合抑制其活性,从而抑制细胞凋亡;另一方面增强转录因子NF-κB活性驱动cFLIP表达,后者是Caspase-8类似物并抑制其活性从而抑制细胞凋亡。DP71R:在ASFV复制晚期表达,是单疱病毒HSV-1蛋白ICP34.5和细胞蛋白GADD34、CreP的同源蛋白。所有这些蛋白都能招募磷酸酶PP1,去磷酸化蛋白翻译因子eIF-2α,促进蛋白合成抑制细胞凋亡;DP71L也抑制应激诱导的凋亡蛋白CHOP产生及其活性。EP153R:是和ASFV外膜蛋白CD2v相连的膜蛋白,参与了CD2v的血吸附,EP153R和CD2v具有保护抗原性。EP153R抑制宿主细胞p53的反式活性,降低p53下游凋亡因子的产生,从而抑制细胞凋亡。
3.2 ASFV与内质网应激 ASFV感染在细胞内质网合成大量蛋白质,激发Caspase-12活化为特征的内质网应激和未折叠蛋白应答(UPR)[21]。ER应激信号包括PERK、ATF6和IRE1三种受体通路:PERK激活eIF2α磷酸化,抑制蛋白合成和引起细胞周期停滞;ATF6和IRE1联合诱导分子伴侣表达和蛋白降解等UPR相关蛋白的表达,一方面促进合成蛋白的正确折叠,另一方面促进不正确折叠蛋白的降解(ERAD)。过度的UPR导致细胞凋亡模式:PERK下游的ATF4-CHOP和IRE1下游JNK-Caspase4引起细胞凋亡[24]。ASFV感染选择性活化ATF6受体,从而激活分子伴侣钙联接蛋白和钙网织蛋白表达。同时病毒蛋白DP71L结合PP1,去磷酸化eIF-2α,并且能下调凋亡因子ATF4-CHOP,抑制UPR引发的细胞凋亡。总之,ASFV感染保留了ER应激中有利于病毒的因素,同时避免了有害于病毒复制的因素。
4 ASFV与宿主细胞I型干扰素应答系统的相互作用
ASFV在自然宿主尤其是节肢动物软蜱虫中持续感染不发病说明天然免疫的重要性。天然免疫系统的重要组成部分I型干扰素(type I interferon,IFN)不仅在早期抗病毒感染中起至关重要作用,并且在树突细胞成熟、交叉递呈CD8+T细胞活化和NK活化中起重要作用[25]。不同ASFV毒株缺失多基因家族(multiple gene family,MGF)MGF360和MGF505/530相似基因片段导致在感染细胞中IFN的升高,表明这些MGF基因片段有抑制IFN应答的功能[26]。MGF360和MGF505基因缺失ASFV重组毒在家猪体内致病性降低并能提供免疫保护[27];MGF360缺失毒在软蜱虫体内复制也减弱[28]。这些说明MGF360和MGF505基因在ASFV致病中发挥了作用。
实验筛选发现3个ASFV蛋白能抑制干扰素信号:ASFV特异蛋白A276R(MGF360 15R)和A528R(MGF505 6/7R),以及TLR3同源病毒蛋白I329L[29]。A276R抑制TLR3和RIG-I下游的转录因子IRF3,从而抑制IFNβ产生。与A276R相对照,A528R抑制TLR3和RIG-I下游的转录因子IRF3和NF-κB,从而抑制IFNβ;不仅如此,A528R还能进一步抑制IFN包括Ⅰ型和Ⅱ型IFN下游细胞信号。I329L是TLR3的同源蛋白,为I型跨膜蛋白,胞外区具有LRR基序,胞浆区有TIR结构域,能通过接头蛋白TRIF抑制TLR3下游转录因子IRF3和NF-κB。推断I329L可能和TLR3形成复合物,阻断TLR3胞浆区TIR结构域上BB基序与下游接头TRIF的结合而发挥作用[29]。
以上筛选检查细胞内RNA受体TLR3和RIG-I介导的IFN信号。ASFV作为DNA病毒,细胞DNA受体介导的IFN信号对ASFV感染更具相关性。最近我们研究发现ASFV DP96R(UK)通过靶向TBK1和IKKβ抑制DNA受体cGAS介导的IFN信号[30],这是首次报道ASFV逃逸细胞DNA免疫识别受体信号,并第一次阐明了免疫逃逸基因DP96R的作用机制。其它ASFV基因如K205R和DP148R能抑制IFNβ产生[31-32],但机制有待阐明。随着高通量筛选的推进,会发现更多ASFV免疫逃逸基因,作用机制也会更加清晰。
5 ASFV与抗原递呈细胞相互作用及其影响
ASFV感染靶细胞主要是单核细胞、巨噬细胞,也是重要的抗原递呈细胞(antigen presenting cells,APCs)。巨噬细胞有呼吸爆发的氧化环境,引起病原DNA损伤和突变,有抗ASFV感染作用。与此对应,ASFV编码碱基切除DNA修复系统(base excision repair,BER),包括DNA聚合酶X,I型DNA连接酶和无嘌呤/脱嘧啶(AP)核酸内切酶(apurinic/apyrimidinic (AP) endonuclease);BER能拮抗巨噬细胞的抗病毒作用[33]。此外ASFV蛋白A238L抑制宿主抗病毒氧化基因转录,其中包括一氧化氮合成酶(inducible nitric oxide synthase,iNOS)基因的转录[34]。细胞对ASFV的易感性和髓系细胞分子标记CD163、CD203表达上调相关[35]。ASFV感染巨噬细胞引起细胞表面功能分子CD14和CD16下调,提示感染细胞功能的损害,影响后续的免疫反应。和强毒ASFV相比,弱毒ASFV感染巨噬细胞显著上调细胞因子包括炎性因子和干扰素的表达,这可能和强毒ASFV编码MGF基因的免疫逃逸功能有关。同时弱毒ASFV却显著下调细胞表面MHC I类分子的表达,可能有利于NK细胞的激活[36]。
树突细胞是最重要的APCs,也能被ASFV感染。感染引起树突细胞功能损害和数量下降,影响后续的免疫反应。和感染巨噬细胞不同的是,ASFV包括弱毒感染树突细胞都没有明显细胞因子表达,可能有利于病毒在细胞内的隐藏[37]。其它细胞如γδT细胞、NK细胞、纤维细胞(fibrocytes)都可以作为APCs发挥作用,这些细胞与ASFV感染保护有一定的相关性,但能否被ASFV直接感染不得而知[36]。
有报道ASFV感染巨噬细胞后释放上调表达半乳糖凝集素-3(galectin-3),在细胞核、细胞浆、细胞表面和胞外均有表达,胞核和胞浆分子能促进细胞生长和生存,而细胞表面和胞外分子引起细胞凋亡。Galectin-3的这种特性可能和淋巴细胞旁观凋亡有关[38]。类似分子和ASFV致病机制高度相关,值得深入研究。
6 ASFV保护性免疫与免疫逃逸
深入理解ASFV和宿主相互作用机制是理解保护性免疫和免疫逃逸的前提,也是疫苗设计关键所在。ASFV结构相关蛋白p72(B646L)、p54(E183L)和p30(CP204L)与病毒结合细胞和内化入侵细胞有关,同时p54也与病毒内核壳在胞浆内迁移有关,因而都是保护性抗原。ASFV膜蛋白p12(O61R)和CD2v(EP402R)分别介导病毒结合细胞和胞浆内病毒膜运输,也是保护性抗原。基于这些ASFV保护抗原的亚单位和DNA疫苗有部分成功的报道:如共免疫杆状病毒表达的p30和p54蛋白能提供家猪对强毒E75感染的部分保护[39];免疫杆状病毒表达的CD2v蛋白能部分保护免疫猪对强毒的攻击,并和产生的血吸附抑制抗体有关[40];融合CD2v-p30-p54和泛素基因的DNA免疫能诱导家猪部分保护,并与家猪体内诱导的CD2v特异CD8+T细胞相关联[41]。最近研究表明在p30、p72、CD2v、EP153R(C型凝集素)等结构蛋白上都存在T细胞表位[42]。
同时ASFV感染存在着广泛的免疫逃逸现象,如A238L抑制宿主基因转录,A224L和DP71L增强病毒蛋白合成,A179L、A224L、DP71L和EP153R逃逸宿主细胞凋亡,MGF360/MGF505成员和I329L逃逸宿主I型干扰素应答。除此之外,结构蛋白CD2v能吸附红细胞有利于病毒扩散,同时抑制淋巴细胞的增殖[43];C型凝集素EP153R能抑制MHCⅠ类分子的表达,达到免疫逃逸的目的[44]。ASFV感染APCs巨噬细胞和树突细胞,损害了这些细胞的抗原递呈功能,因此逃逸后续的免疫应答。确定病毒免疫逃逸基因是构建ASFV基因缺失疫苗的第一步。天然致弱毒株OURT88/3和NH/P68(缺失CD2v基因,非血吸附基因Ⅰ型弱毒)免疫动物能提供同源保护和部分异源保护,保护率在66%~100%[45],但这些弱毒毒性限制了应用。在上述ASFV弱毒株或者不同ASFV强毒株基础上的基因缺失毒株表现出差异化的同源和异源免疫保护;未来成功的ASFV基因缺失疫苗将在有效复制激发保护性免疫应答和毒性最小化之间取得平衡,多个不同基因组合的缺失毒株可能是最优选择[32]。
针对ASFV的保护性免疫非常复杂,体液免疫和细胞免疫都可能参与其中。虽然有各种探索和尝试,但到目前为止还没有能诱导良好保护性的商业化疫苗。随着对ASFV与宿主相互作用机制的深入认识和了解,目前疫苗研发的低效试错模式将向高效科学设计模式转变。
7 ASFV与宿主相互作用方面存在问题、思考与展望
目前已知ASFV病毒蛋白与宿主的互作小结见表1。但对ASFV与宿主互作的认识有大量空白等待填补,许多问题需要回答。病毒方面:ASFV有151~167种蛋白质,其中54种结构蛋白和100多种非结构蛋白,除目前已知(图1和表1)之外,大部分病毒蛋白在感染细胞中的功能、与宿主细胞的互作、免疫逃逸作用都不清楚;另外不同毒力、不同来源ASFV毒株与细胞互作的差异有哪些?宿主细胞方面:ASFV感染巨噬细胞的病毒结合受体?树突细胞中的病毒结合受体是否与巨噬细胞中受体一样?ASFV引起感染细胞凋亡外,是否激发细胞坏死和焦亡?淋巴细胞不是ASFV感染靶细胞,如何发生旁观死亡导致数量大幅减少?感染动物方面:与弱毒相比,ASFV强毒感染导致体内I型干扰素水平明显增高,与体外强毒感染巨噬细胞不产生IFN情况正好相反[46],那么IFN在ASFV致病机理中究竟发挥了什么作用?另外国内非洲猪瘟病例普遍有脾脏极度肿大和坏死病变,其分子病理机制是什么?以上问题的解答将极大加深对ASFV的认识,有效推动对ASF的防控。
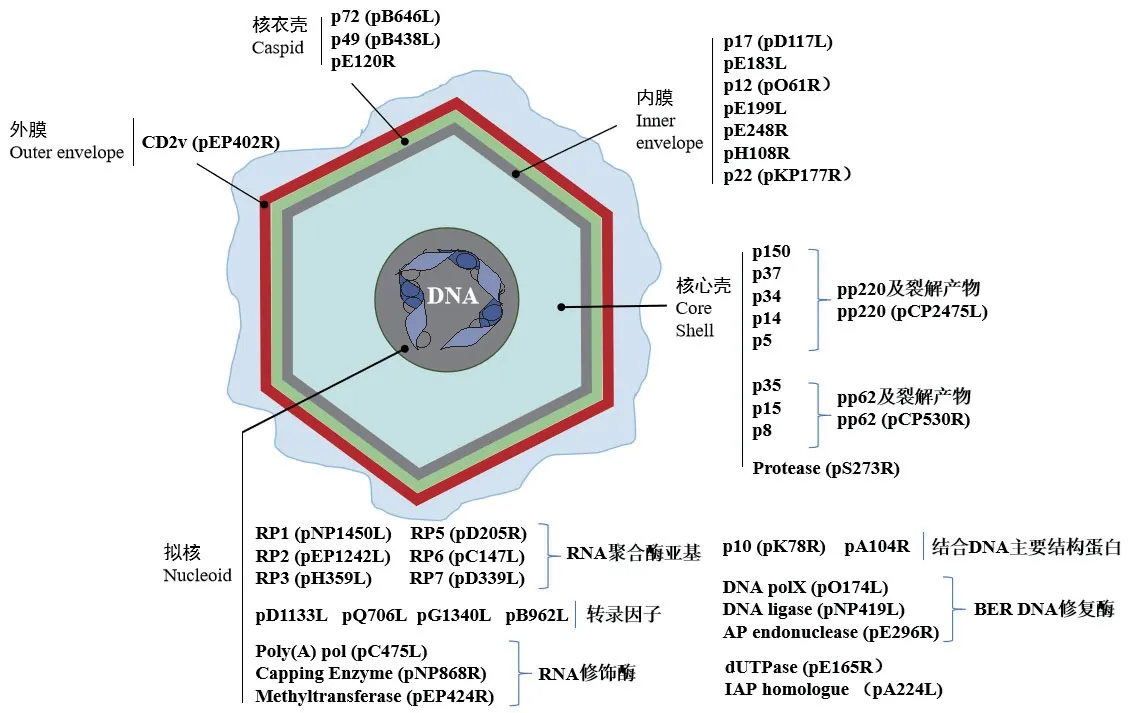
图1 非洲猪瘟病毒(ASFV)的结构示意图(引自文献[2])Fig.1 Schematic diagram of ASFV structure ( according to reference 2)

表1 已知ASFV蛋白与宿主的相互作用Table 1 Interactions of ASFV proteins with host cells
