PRRX1 在胃癌细胞增殖与转移中的作用及其与 TGF-β/Smad2 介导的上皮间质转化的关系
2020-05-11杨忠黄婉霞王尚邓维博姚继彬达明绪
杨忠 ,黄婉霞 ,王尚, ,邓维博 ,姚继彬,达明绪
(1. 宁夏医科大学临床医学院,宁夏 银川 750004;2. 甘肃省人民医院 肿瘤外科,甘肃 兰州 730000;3. 甘肃中医药大学 临床医学院,甘肃 兰州 730000)
胃癌是消化道常见的恶性肿瘤之一,最新统计2017年全世界胃癌新增发病约122万例,造成了 86.5万人死亡,而我国胃癌新发病例和死亡病例约占全球近5 0%,发病率和病死率居恶性肿瘤 第2位[1-3]。虽然医疗诊治水平和模式明显改善,但胃癌患者的5年生存率却仍低于30%[4]。胃癌的预后与复发和转移密切相关,但具体机制尚未明确。研究[5-8]证实上皮间质转化(epithelial mesenchymal transition,EMT)是诱导恶性肿瘤发生增殖与远处转移的重要机制,EMT的发生过程不仅涉及TGF-β/Smad、Wnt/β-catenin、PI3K/Akt、Notch等主要信号通路,也受Snail、Twist1、Slug、NFκB、Zeb等重要转录因子诱导调控,其表现为上皮细胞表型标志物E-cadherin、Laminin1、ZO-1等下调和间质细胞表型标志物N-cadherin、vimentin、β-catenin等表达上调,最终使肿瘤细胞获得间质表型特性,容易脱离原发病灶向远处迀移。
近年来研究[9-16]报道配对相关同源框1(paired related homeobox 1,PRRX1)是表达于细胞核内可诱导肿瘤发EMT的重要转录因子,在胃癌、胰腺癌、乳腺癌、神经母细胞瘤、胶质母细胞瘤、甲状腺癌、头颈部鳞癌和口腔鳞癌等肿瘤中PRRX1表达明显增加,并且促进肿瘤的EMT过程,与患者的预后不良密切相关。但有研究[17-19]表明在大肠癌、肝癌、肺癌中PRRX1低表达可诱导肿瘤的增殖与转移,并与肿瘤的转移灶的定植密切相关。Guo等[7]研究表明过表达的PRRX1可诱导Wnt/β-catenin通路促进胃癌的EMT过程,使得胃癌细胞的增殖、侵袭和转移能力明显增强。研 究[11,13-15,20-21]表明PRRX1可与TGF-β/Smad协同作用促进肿瘤的E M T 过程。笔者前期研究[22]表明,在人胃癌组织中PRRX1表达水平明显高于癌旁正常胃黏膜组织和转移淋巴结与患者的预后不良正相关。而PRRX1与TGF-β/Smad通路在胃癌中的作用机制研究尚未见报道,本研究旨在探究PRRX1表达上调与TGF-β/Smad2通路在胃癌细胞增殖与转移中的作用机制,为早期干预胃癌的复发转移提供理论依据。
1 材料与方法
1.1 实验材料
人正常胃黏膜细胞G E S - 1 和胃癌细胞S G C 7 9 0 1、M N K 4 5 由甘肃省人民医院消化道肿瘤重点实验室提供。P R R X 1 过表达慢病毒及空载慢病毒(携绿色荧光)由中国汉恒生物科技(上海)有限公司构建。胎牛血清、RPMI-1640培养基、0.2 5%胰酶、青-链霉素双抗、P B S 购于以色列Biological Industries(BI)公司。兔抗人P R R X 1 一抗购自美国A b c a m 公司,兔抗人一抗TGF-β1、Smad2、E-cadherin、vimentin、GAPDH购自美国SAB公司,兔抗人辣根过氧物酶HRP标记亲和纯化山羊抗兔IgG(H+L)二抗购自美国Proteintech公司;TGF-β/Smad2通路阻断剂SB-431542购自美国MCE公司。RIPA裂解液、SDS-PAGE凝胶配制试剂盒、BCA蛋白定量试剂盒购自北京索莱宝公司,Transwell小室购自美国康宁公司,25 mL培养瓶购自中国香港耐思生物科技有限公司,Western blot转膜仪、电泳仪、电源购自北京六一生物科技公司,酶标仪购自美国Bio Rad公司,Tanon-2500R全自动数据凝胶图像分析系统购自上海天能科技有限公司。
1.2 细胞培养
GES-1、SGC7901和MNK45细胞均采用10%胎牛血清和1%青-链霉素双抗的RPMI-1640培养液置于37 ℃、5%CO2培养箱中培养,每1~2 d换液1次,2~3 d传代1次,选取对数生长期细胞进行实验。待细胞长至25 mL培养瓶80%弃去培养基用PBS清洗,1 mL 0.25%胰酶消化待细胞相互分离后并轻吸去,加入1 mL的冻存液(900 μL血清+100 μL DMSO)轻轻吹打混匀转移至冻存管,4 ℃ 10 min,-20 ℃ 2 h,-80 ℃过夜后液氮长期保存。
1.3 细胞转染
取对数生长期胃癌细胞MNK45胰酶消化收集细胞,PBS清洗2次后计数,接种于6孔板中,37 ℃、5%CO2培养箱中培养24 h,待细胞于6孔板中长至50%时,加入转染慢病毒30 μL+聚凝胺5 μL(转染效果最佳),每孔慢病毒+聚凝胺+完全培养基共 1 mL,4 h后补加共1 mL的完全培养基,24 h后更换新鲜完全培养液,72 h镜下观察转染效果较好。转染慢病毒后的细胞待长满六孔板后收集于25 mL培养瓶中继续培养传代,于正常培养的25 mL培养瓶中加入嘌呤霉素的体积8 μL(效果最佳),作用24 h后更换新鲜的完全培养基继续培养。将MNK45细胞分别转染PRRX1过表达慢病毒(PRRX1过表达组)与空载慢病毒(阴性对照组),将无处理的MNK45细胞作为空白对照组。
1.4 Transwell 迁移实验
取对数生长期的胃癌细胞,分别胰酶消化离心(做好标记),PBS清洗3次后计数,RPMI-1640培养基分别配成等浓度细胞混匀液(5×105/mL),分别取200 μL细胞悬浮液接种于Transwell上室, 下室加入含10%胎牛血清的培养基500 μL,37 ℃、5%CO2培养箱中培养48 h,取出小室,棉签轻轻擦去上室培养基及细胞,4%多聚甲醛固定下室膜上细胞15 min,PBS清洗3次,1%结晶紫染色30 min,PBS再次冲洗小室3次,干燥后倒置显微镜下观察计数并采图。
1.5 Western blot 实验
取对数期生长细胞,冰P B S 清洗2 ~3 次,吸干残余液体,根据细胞裂解液说明书操作收集总蛋白,BCA法进行蛋白定量,加入蛋白上样缓冲液,水浴锅 100 ℃ 10 min。迅速置于冰上,冰浴5 min,置于-20 ℃备用。每孔20 μg蛋白样品上样,10%SDS-PAGE进行蛋白分离,80 V电泳约 3 0 m i n,目标蛋白跑至分离胶时,电压调至 120 V,直至目标蛋白所在位置上下两条Marker条带分开,停止电泳。半干湿式转膜(恒流200 mA 2 h),冰浴条件下转模,转模完成后,5%脱脂牛奶室温摇床封闭2 h,加入一抗P R R X 1 (1:1 0 0 0)、T G F-β 1(1:5 0 0)、S m a d 2 (1:1 000)、E-cadherin(1:1 000)、vimentin (1:1 000)、GAPDH(1:2 000),4 ℃慢摇孵育过夜,TBST清洗3次,每次10 min,加入二抗 (1:2 000),室温摇床孵育2 h,TBST清洗3次,每次 10 min,化学发光试剂蛋白显影,GAPDH作为内参蛋白。
1.6 SB-431542 抑制实验
取对数期长满25 mL培养瓶50%的转染PRRX1过表达慢病毒的M N K 4 5 细胞分为两组:加有TGF-β/Smad2通路阻断剂SB-431542组(最佳浓度为10 μmol/L)的培养液作为实验组,加有溶剂DMSO的培养液为对照组,作用24 h后提取蛋白,Western blot法检测PRRX1、TGF-β、Smad2和EMT标志物表达差异(步骤同前)。
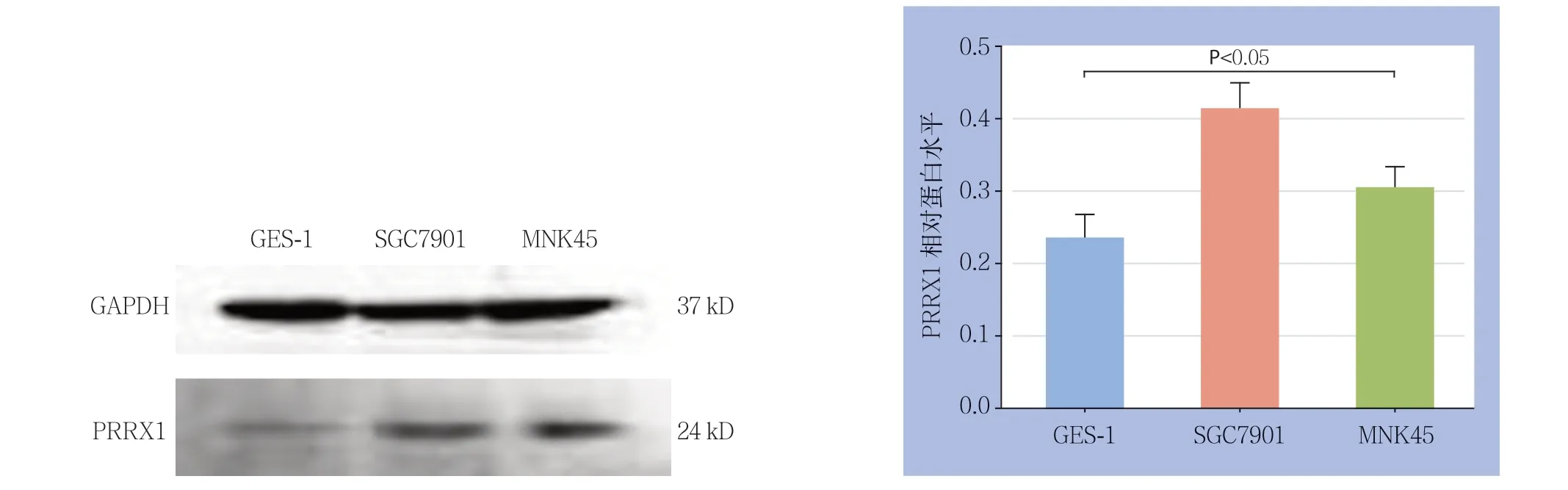
图1 Western blot 检测GES-1、SGC7901 和MNK45 细胞中PRRX1 蛋白表达Figure 1 The PRRXI protein expressions in GES-1, SGC7901 and MNK45 cells determined by Western blot analysis
1.7 动物实验
8 只5 周 龄B A L B/c 雌 性 裸 鼠,平 均 质 量(18.3±0.64)g,购自北京维通利华公司,饲养于甘肃中医药大学SPF级动物中心。将裸鼠随机分2组,每组4只,分别皮下注射转染PRRX1过表达慢病毒的MNK45细胞(PRRX1过表达组)与转染空载慢病毒MNK45细胞(阴性对照组)。注射方法:取对数期生长期的细胞,0.9%生理盐水重悬细胞并计数,调整细胞浓度为1.0×107/mL,选裸鼠左侧后背部皮下为注射部位,75%酒精消毒皮肤,1 mL注射器吸取细胞悬液,按0.1 mL/只注入皮下,棉签轻轻按压15 s以防细胞悬液溢出。每周测量瘤体的长径和短径,并计算瘤体的体积。计算瘤体体积公式为(V=长×宽2/2 cm3),以瘤体积为纵轴,生长时间为横轴,绘制皮下瘤的生长曲线。8周后脱臼法处死裸鼠并取下瘤体,称重并采图后,瘤体于-80 ℃冰箱保存,动物尸体按照实验室规定处理。
1.8 统计学处理
所有数据采用SPSS 22.0统计软件进行处理,其中计数资料显著性比较采用χ2检验,组间两两比较采用t 检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 GES-1、SGC7901 和MNK45 细胞中PRRX1表达情况
PRRX1在胃癌细胞SGC7901和MNK45中表达明显高于人正常胃黏膜细胞GES-1,并且SGC7901表达高于MNK45细胞,差异均有统计学意义(均P<0.05)(图1)。
2.2 细胞转染及形态观察
荧光倒置显微镜下观察慢病毒转染的两组M N K 4 5 细胞生长良好,均可见明显的绿色荧光(图2A);在普通倒置显微镜下观察到空白对照组与阴性对照组细胞形态近圆形,PRRX1过表达组细胞形态变为不规则或梭形(图2B)。
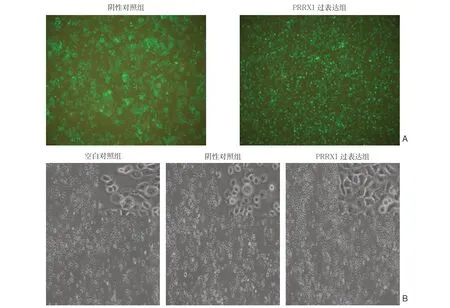
图2 细胞转染情况及形态观察 A:荧光显微镜观察慢病毒转染后的MNK45 细胞(×4);B:普通倒置显微镜下的各组细胞(×20)Figure 2 Observation of the transfection efficiency and cell shapes A: The MNK45 cells after lentiviral transfection under fluorescence microscope (×4); B: Cells of each group under ordinary inverted microscope (×20)
2.3 Transwell 实验检测细胞迁移能力
Transwell实验结果显示,PRRX1过表达组MNK45细胞迁移的细胞数较空白对照组与阴性对照组明显增多(均P<0.05),但后两组间无统计学差异(P>0.05)(图3) 。
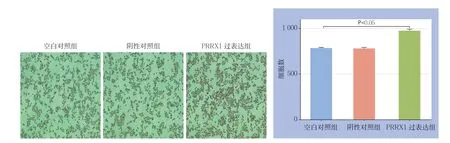
图3 Transwell 迁移实验检测各组细胞迁移能力Figure 3 The migration abilities of each group of cells detected by Transwell migration assay
2.4 Western blot 检测各组细胞中相关蛋白表达
与空白对照组与阴性对照组比较,P R R X 1过表达组中间质表型标志物v i m e n t i n 蛋白表达、T G F-β 1 和S m a d 2 蛋白表达明显增加(均P<0.05),而上皮表型标志物E-cadherin蛋白表达明显减低(均P <0.0 5);空白对照组与阴性对照组上述蛋白表达水平均无统计学差异(均P>0.05)(图4)。
2.5 TGF-β/Smad2 通路阻断剂SB-431542 对相关蛋白表达的影响
与给予溶剂DMSO处理比较,给予阻断剂SB-431542处理的PRRX1过表达组MNK45细胞上皮表型标志物E-cadherin蛋白表达明显增加,而间质表型标志物vimentin和Smad2明显减低降低(均P <0.0 5),但P R R X 1 和T G F-β 1 无 统 计学差异(均P>0.05)(图5)。
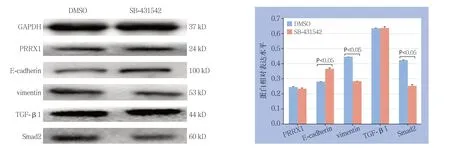
图5 Western blot 法检测SB-431542 对PRRX1、TGF-β1、Smad2 和EMT 相关蛋白表达的影响Figure 5 The influence of SB-431542 on protein expressions of PRRX1, TGF-β1, Smad2, and EMT markers determined by Western blot
2.6 裸鼠皮下移植瘤生长情况
两组裸鼠的皮下移植瘤均构建成功。从第4周后各时间点,PRRX1过表达组皮下移植瘤体积增长明显大于阴性对照组(均P<0.05);第8周时P R R X 1 过表达组皮下移植瘤体积、质量分别为(0.82±0.14)cm3、(2.33±0.23)g,阴性对照组皮下移植瘤体积、质量分别为(0.21±0.06)cm3、(1.54±0.05)g,PRRX1过表达组皮下移植瘤体积和瘤重明显大于阴性对照(均P<0.05)(图6)。
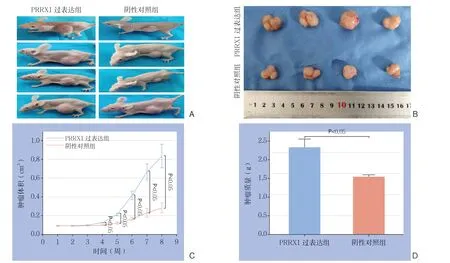
图6 裸鼠皮下移植瘤的生长实验结果 A-B:两组移植瘤情况;C:两组移植瘤生长曲线;D:两组移植瘤瘤重比较Figure 6 Results of the subcutaneously implanted tumor model in nude mice A-B: The xenografts in the two groups of mice; C: Growth curves of the implanted tumors in the two groups of mice; D: Comparison of the weight of the implanted tumors between the two groups of mice
3 讨 论
近年来胃癌的发病率在我国虽有下降的趋势,但早期因缺乏特异性表现,绝大多数患者确诊时已属于进展期,肿瘤病灶已经发生局部侵犯、淋巴转移或是远处转移[2-4]。胃癌的增殖与转移是一个涉及多因素、多阶段、多通路的复杂过程,具体机理不清。EMT过程在恶性肿瘤的增殖与转移过程中起着关键性的作用[5-8]。E-cadherin是一种有效的肿瘤抑制蛋白质,典型上皮型标志物,在上皮源性的表达丧失时,其介导的细胞间的黏附性减弱或者逐渐消失,使得恶性肿瘤细胞获得侵袭性和迁移能力,E-cadherin表达减低与胃癌患者的临床分期晚和预后差密切相关[7,22-24]。vimentin是典型的间质型标志物,是表达于间质细胞和间叶源性肿瘤的一种中间丝蛋白,在维持细胞骨架形态和黏附性,参与细胞凋亡的调控,在肿瘤的侵袭、迁移、新生血管生成和淋巴管形成中发挥着重要的作用[25-26]。
P R R X 1 家 族 包 括P R R X 1 a、P R R X 1 b 和P R RX2,其中PRRX1编码的蛋白主要表达于细胞核,是促进肿瘤发生EMT的重要转录因子[7,9]。PRRX1在多种肿瘤中异常表达,可诱导TGF-β/Smad、Wnt/β-catenin、p53等信号通路调节上皮型标志物E-c a d h e r i n 表达减低,v i m e n t i n、β-catenin等间质标志物表达增加,从而促进肿瘤的侵袭和迁移,并通过调节免疫抑制和血管生成来调控恶性肿瘤的EMT过程[7,9,11,13-16,18-19,26-28]。
TGF-β/Smad信号通路是细胞内信号转导的重要通路,在肿瘤的发生发展过程中起着双重作用,肿瘤发生早期起抑制作用,但在肿瘤进展时可通过Wnt等信号通路直接抑制E-cadherin表达,同时可激活β-catenin/TCF/LEF复合物,间接导致vimentin等间质标志物的表达来激活VEGF-C的产生促进胃癌的淋巴转移调节其EMT过程[29-34]。Smad2是TGF-β/Smad信号通路的关键,它可以直接把TGF-β信号透过细胞膜传导入细胞核内,激活核内基因表达[35]。胃癌中Smad2表达增高与其分化差、分期晚和患者的不良结局相关[32-34]。相关研究表明PRRX1可与TGF-β/Smad协同作用促进肿瘤的EMT过程[11,13-15,20-21]。
本研究表明,P R R X 1 在胃癌细胞S G C 7 9 0 1和MNK45中表达明显高于正常胃黏膜细胞GES-1,且SGC7901表达高于MNK45,PRRX1在胃癌组织中表达明显高于癌旁正常组织,因此PRRX1在胃癌中表达明显增高,并调节胃癌的EMT过程[7,22]。为了明确观察PRRX1过表达对胃癌细胞的侵袭与转移的影响,所以选择了P R R X 1 相对表达低的MNK45胃癌细胞进行慢病毒转染。转染PRRX1过表达慢病毒的MNK45细胞,形态由近圆形变为不规则或梭形,而阴性对照组与空白对照组细胞形态未见明显差异,这可能是上皮表型细胞向间质表型细胞转化时的形态学改变[32]。Transwell迁移实验结果显示,PRRX1过表达组细胞的迁移能力明显增加;移植瘤实验结果表明,PRRX1过表达组移植瘤增长速度明显增快,这与PRRX1过表达可以促进胃癌细胞的增殖与转移的相关报道[7]一致。Western blot显示,PRRX1过表达组细胞中PRRX1、间质型标志物vimentin、TGF-β1和Smad2表明显增加,而上皮型标志物E-cadherin表达降低,有研究[14]表明甲状腺癌乳头状中TGF-β1可与PRRX1协同作用增强其癌细胞的增殖与转移能力。而本实验中给予TGF-β1受体激酶抑制剂SB-431542作用PRRX1过表达组胃癌细胞后,PRRX1和TGF-β1表达水平无明显变化,但vimentin和Smad2表达减低,而E-cadherin表达增加,提示给予TGF-β/Smad2通路抑制剂可以逆转PRRX1过表达诱导的EMT过程。有研究表明在头颈部鳞状细胞癌中上调PRRX1过表达时,TGF-β1、p-Smad2和p-Smad3表达增加,而给予TGF-β受体激酶抑制剂后,p-Smad2、p-Smad3和vimentin表达减低,但E-cadherin表达增加,细胞的侵袭和迁移能力明显减弱[15]。有报道过表达的PRRX1可以促进脂肪组织中的TGF-β活性,从而导致肥胖期间脂肪细胞功能异常[36]。
总之,过表达的P R R X 1 可以促进胃癌细胞向着梭形或不规则形的间质细胞形态转化,从而有利于胃癌细胞的增殖和迁移,上调TGF-β1、Smad2和间质型标志物vimentin表达,下调上皮型标志物E-cadherin表达,而TGF-β/Smad信号通路抑制剂可以逆转过表达的PRRX1所诱导的EMT过程,提示过表达的PRRX1可以诱导TGF-β/Smad2通路促进胃癌细胞的增殖与转移,这可能是早期干预治疗胃癌复发转移的潜在靶点。
