镉胁迫下海藻酸钠与氯化钙混合添加对黄瓜幼苗镉吸收的影响
2020-05-11赵戴军陈碧华郭卫丽潘飞飞孟凡茹王广印
赵戴军,陈碧华,2,郭卫丽,2,潘飞飞,2,孟凡茹,王广印,2
(1.河南科技学院 园艺园林学院,河南新乡 453003;2.河南省园艺植物资源利用与种质创新工程研究中心,河南新乡 453003)
近年来,随着工业废弃物的排放、化肥农药的过量使用,导致土壤的镉(Cd)污染[1-2]。Cd是一种重金属元素,具有很强的毒性,不仅会危害农作物的生长,而且会危害人体的健康[3],因此土壤Cd污染的治理迫在眉睫。常见的土壤修复方式有农业修复、物理修复、化学修复和生物修复[4],海藻酸钠(NaAlg)是从褐藻类的海带或马尾藻中提取碘和甘露醇之后的副产物[5],具有性质稳定、无毒、无刺激性以及符合要求的粘度、渗透性、亲水性、溶解性等特性[6],所以NaAlg被广泛应用于食品、医药、纺织、农业等领域[7-10]。NaAlg中的Na+可以与二价阳离子发生交换,使得NaAlg溶液向凝胶转变[11]。Lee等[12]研究表明,与其他二价阳离子相比Ca2+为最常用的交联剂。邓靖等[13]研究表明,与其他钙剂相比CaCl2是一种理想的交联剂。NaAlg被应用于治理重金属水污染的报道较多,且效果显著[14],但NaAlg被用于土壤Cd污染治理的研究鲜有报道。本试验以蔬菜种植面积较大的黄瓜(CucumissativusL.)为试验材料,研究基质中NaAlg与CaCl2混合添加对镉胁迫下黄瓜幼苗镉吸收的影响。旨在通过NaAlg与CaCl2协同作用减少黄瓜幼苗对重金属Cd的吸收利用,从而减少Cd2+通过食物链对人体的危害,为Cd污染的治理提供依据。
1 材料与方法
1.1 试验材料
供试黄瓜种子为‘新津春4号’,由宁阳县鲁明种子有限公司提供。
试剂:海藻酸钠(NaAlg)(山东西亚化学股份有限公司);无水氯化钙(CaCl2)(天津市凯通化学试剂有限公司);氯化镉(CdCl2·2.5H2O)(国药集团化学试剂有限公司)。
1.2 试验设计
试验于2018年11月在河南科技学院园艺园林学院进行,盆栽试验采用基质栽培,基质按草 炭∶蛭石∶珍珠岩=3∶1∶1的体积比配制,基质中采用CdCl2·2.5H2O进行镉胁迫,胁迫含量为20 mg·kg-1,按NaAlg和CaCl2添加量共设置对照(CK)、T50、T100、T200、T400、T8006个处理,每个处理6盆,重复3次,共108盆。如表1所示,将基质搅拌均匀使含水量达到70%,将基质装入规格为6 cm×6 cm×7.5 cm的营养钵中。将黄瓜种子进行温汤浸种,55 ℃水温下搅拌15 min,放置在常温水中浸种4 h,然后将种子播种到营养钵中进行培养(每个营养钵中种1株黄瓜)。

表1 各处理CdCl2·2.5H2O、NaAlg和CaCl2添加量Table 1 Addition amount of CdCl2·2.5H2O, NaAlg and CaCl2
注: Wt为溶液的质量百分数(溶质质量/溶液质量)。
Note:Wt in the table is mass percentage of solution (solute mass/solution mass).
1.3 测定项目及方法
1.3.1 生长指标的测定 待黄瓜幼苗长至2片真叶时,用卷尺、游标卡尺、手持叶绿素仪(SPAD-502)分别测定每棵黄瓜幼苗的株高、茎粗、叶片数以及叶绿素含量。
每个处理的每个重复中分别取1株黄瓜幼苗,将黄瓜幼苗的地上部和根分别放入烘箱中,先105 ℃杀青30 min,然后于70 ℃烘至恒量,用电子分析天平分别称取烘干前后的鲜质量及干 质量。
每个处理的每个重复中分别取1株黄瓜幼苗,将完整的黄瓜幼苗根从基质中取出、洗净,用根系扫描仪(Epson Perfection V800)进行扫描,然后用WinRHIZO根系形态分析系统进行分析,获取总根长、根表面积、根系平均直径、根体积和根尖数等根系形态参数。
1.3.2 黄瓜幼苗镉含量的测定 每个处理的每个重复中分别取1株黄瓜幼苗,将其根、茎、叶分别烘干、磨碎,各称取0.2 g(精确至0.001 g),在消解罐中加8 mL浓硝酸、2 mL高氯酸和2 mL双氧水,置于消解仪中[165 ℃ 5 W(机器运行功率)],消解至澄清、无杂质,后将消解完成的溶液转移至50 mL的聚四氯乙烯烧杯中,在电热板上(170 ℃)赶酸至近干,然后用含量为 0.5%的硝酸定容至25 mL,定容结束后将溶液装入50 mL离心管中待测,Optima 2100 DV电感耦合等离子体发射光谱仪测定样品中的镉含量[15]。
1.3.3 黄瓜幼苗中亚细胞组分分离与分析 参照宋阿琳等[16]方法,略有改进。从每个处理的每个重复中分别取1株黄瓜幼苗,分别取其地上部分与地下部分,各称取0.5 g在研钵中,加入5 mL的匀浆液[成分:蔗糖250 mmol·L-1,Tris-HCl(pH 7.5)50 mmol·L-1和DTT 1 mmol·L-1],4 ℃下研磨,转移至离心管中,3 000 r·min-1离心1 min,沉淀为细胞壁成分。取上清液继续进行离心,14 500 r·min-1离心45 min,沉淀为细胞器,上清液为细胞质。将离心后的细胞壁和细胞器组分再进行消解,并用质量比为0.5%的稀硝酸定容至25 mL,细胞质组分直接定容到容量瓶中待测。
1.3.4 膜保护酶活性测定 从每个处理的每个重复中取黄瓜幼苗的全部真叶,剪碎(去叶脉),取0.5 g放入研钵中加入5 mL 62.5 mmol·L-1pH 7.8 PBS(含量为0.3%的PVP)和少量的石英沙,于冰浴研磨成匀浆,15 000 g,4 ℃低温离心10 min,上清液于4 ℃低温保存,备用。超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑蓝(NBT))方法测定[17],过氧化物酶(POD)活性采用愈创木酚方法测定[18],过氧化氢酶(CAT)活性采用H2O2方法测定[19]。
1.3.5 丙二醛(MDA)含量测定 酶液的提取见“1.3.4”。MDA含量采用硫代巴比妥酸的方法测定[20]。
1.4 数据分析
采用Microsoft Office Excel 2010和SPSS 21.0对数据进行分析。
2 结果与分析
2.1 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗生长变化
2.1.1 黄瓜幼苗茎粗、株高、叶片数及叶绿素含量的变化 由表2可知,T50处理下黄瓜幼苗的茎粗达到最大值,T50、T100、T200、T400、T800处理下黄瓜幼苗的茎粗较CK分别增加25.30%、 23.69%、17.67%、18.09%和12.45%,均达到显著水平(P<0.05);T100处理下黄瓜幼苗的株高达到最大值,T50、T100、T200处理下黄瓜幼苗的株高较CK分别增加10.95%、13.26%和10.66%,均达到显著水平(P<0.05);随着NaAlg与CaCl2添加量的增加黄瓜幼苗的叶片数呈下降趋势,T50和T100处理下黄瓜幼苗的叶片数较CK差异不显著(P>0.05),T200、T400、T800处理下黄瓜幼苗的叶片数较CK分别降低21.60%、 30.52%和38.97%,均达到显著水平(P<0.05);T800处理下黄瓜幼苗的叶绿素含量达到最大值,T800处理下黄瓜幼苗的叶绿素含量较CK增加 12.14%,达到显著水平(P<0.05),T50、T200和T400处理下黄瓜幼苗的叶绿素含量较CK差异不显著(P>0.05)。

表2 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗茎粗、株高、叶片数及叶绿素含量Table 2 Stem thickness, plant height, number of blades and chlorophyll content of cucumber seedlings with use of mixed addition of NaAlg and CaCl2 under Cd stress
注:表中数据为“平均值±标准差”;同一列不同小写字母分别表示不同处理之间在0.05水平存在显著性差异。下同。
Note:The data in the table is the “average ± standard error”;and different lowercase letters in the same column indicate significant differences at 0.05 levels among different treatments.The same below.
2.1.2 黄瓜幼苗干质量和鲜质量的变化 由表3可知,T200处理下黄瓜幼苗的地上部鲜质量达到最大值,T50、T100、T200、T400、T800处理下黄瓜幼苗的地上部鲜质量较CK分别增加32.05%、 43.25%、50.04%、27.64%和29.35%,均达到显著水平(P<0.05);T200处理下黄瓜幼苗的地下部鲜质量达到最大值,T200处理下黄瓜幼苗地下部鲜质量较CK增加24.40%,达到显著水平 (P<0.05),而T800处理下黄瓜幼苗的地下部鲜质量较CK则减少37.80%,达到显著水平(P< 0.05);T200处理下黄瓜幼苗的地上部干质量达到最大值,T50、T100、T200、T400处理下黄瓜幼苗的地上部干质量较CK分别增加27.69%、23.85%、 29.23%和15.38%,达到显著水平(P<0.05);T100、T200处理下黄瓜幼苗的地下部干质量均达到最大值,T100、T200处理下黄瓜幼苗的地下部干质量较CK分别增加9.52%,T800处理下黄瓜幼苗的地下部干质量较CK减少33.3%,达到显著水平(P<0.05)。
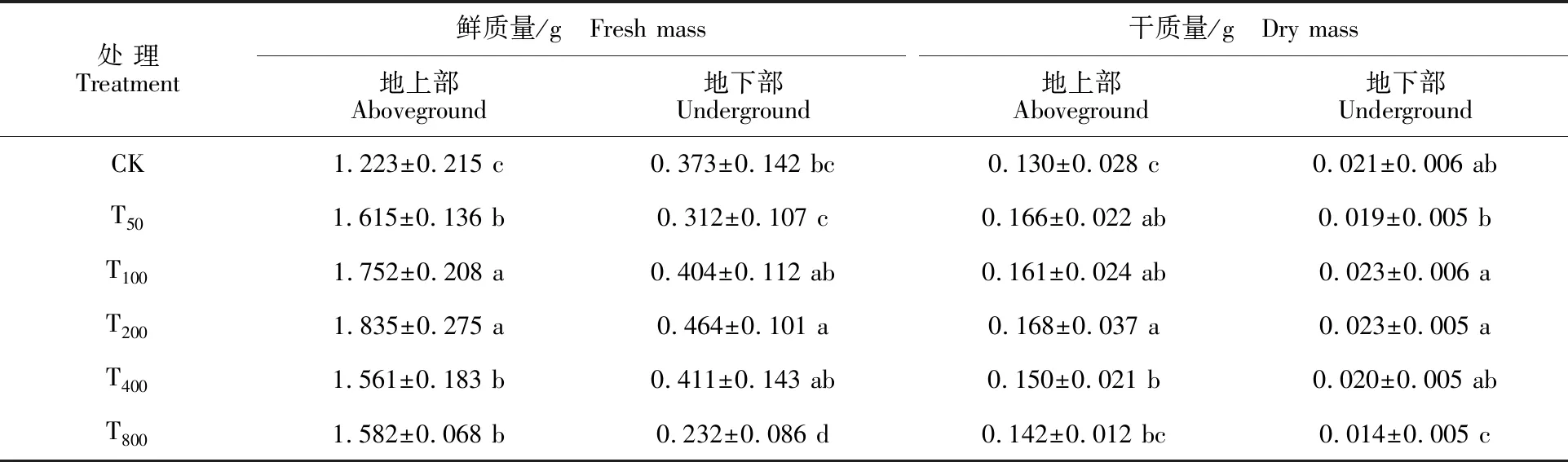
表3 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗单株干质量和鲜质量Table 3 Dry mass and fresh mass of cucumber seedlings with use of mixed addition of NaAlg and CaCl2 under Cd stress
2.1.3 黄瓜幼苗根系形态的变化 由表4可知,T50处理下黄瓜幼苗的根总长达到最大值,较CK增加32.97%,达到显著水平(P<0.05),T400、T800处理下黄瓜幼苗的根总长较CK分别降低33.26%、 78.31%,均达到显著水平(P<0.05);T50处理下黄瓜幼苗的根表面积达到最大值,较CK增加32.97%,达到显著水平(P<0.05),T400、T800处理下黄瓜幼苗的根表面积较CK分别降低20.92%、72.42%,均达到显著水平(P<0.05);T800处理下黄瓜幼苗的根平均直径达到最大值,T200、T400、T800处理下黄瓜幼苗的根平均直径较CK分别增加11.54%、 15.38%、23.08%,均达到显著水平(P<0.05);T50处理下黄瓜幼苗的根体积达到最大值,T50、T200处理下黄瓜幼苗的根体积较CK分别增加 39.39%、33.33%,均达到显著水平(P<0.05),T800处理下黄瓜幼苗的根体积较CK降低 63.64%,达到显著水平(P<0.05);CK处理下黄瓜幼苗的根尖数达到最大值,T200、T400、T800处理下黄瓜幼苗的根尖数较CK降低43.61%、 65.26%、69.51%,均达到显著水平(P<0.05)。

表4 镉胁迫下NaAlg与CaCl2混合添加对黄瓜幼苗根系形态Table 4 Root morphology of cucumber seedlings with use of mixed addition of NaAlg and CaCl2 under Cd stress
2.2 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗Cd2+积累的变化
黄瓜幼苗中的Cd2+主要集中在根系中,而茎、叶中的镉含量未检出。由表5可知,T200处理下黄瓜幼苗根Cd2+含量达到最小值,较CK减少 9.375%,达到显著水平(P<0.05),T100、T400、T800处理下黄瓜幼苗根Cd2+含量较CK分别增加21.79%、27.49%、104.02%,达到显著水平 (P<0.05)。

表5 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗Cd2+积累Table 5 Cd2+ accumulation of cucumber seedlings under with use of mixed addition of NaAlg and CaCl2 Cd stress
2.3 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗Cd2+亚细胞分布的变化
随着NaAlg与CaCl2添加量的增加,Cd2+胁迫下黄瓜幼苗地上部细胞壁、细胞器、细胞质以及地下部细胞器中的Cd2+含量均无检出;而地下部细胞壁、细胞质的Cd2+含量均呈现先增加后减少再增加的趋势。由表6可知,CK、T50、T100、T200、T400处理下黄瓜幼苗地下部亚细胞组分Cd2+含量均呈现细胞壁>细胞质>细胞器,而T800处理下地下部亚细胞组分Cd2+含量呈现细胞液>细胞壁>细胞器。T200处理下地下部细胞壁的Cd2+含量较CK降低31.82%,差异性不显著 (P>0.05),T400和T800处理下地下部细胞壁的Cd2+含量较CK分别增加277.68%和428.57%,达到显著水平(P< 0.05)。

表6 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗Cd2+亚细胞分布Table 6 Distribution of Cd2+ cells in cucumber seedlings with use of mixed addition of NaAlg and CaCl2 under Cd stress
注:“─”表示Cd2+含量未检出。
Note:“─” indicates the Cd2+content has not been detected.
2.4 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗膜保护酶活性的变化
由图1-A可知,T50、T100、T200、T400、T800处理下黄瓜幼苗SOD活性较CK差异不显著(P>0.05);由图1-B可知,POD活性随着NaAlg与CaCl2添加量的增加呈现先增加后减少的趋势,T400处理下黄瓜幼苗POD活性达到最大值。T100、T200、T400处理下黄瓜幼苗POD活性较CK分别增加41.79%、32.31%、115.61%,达到显著水平(P<0.05);由图1-C可知,CAT活性随着NaAlg与CaCl2添加量的增加呈现先增加后减少的趋势,T200处理下黄瓜幼苗CAT活性达到最大值。T50、T100、T200、T400、T800处理下黄瓜幼苗CAT活性较CK分别增加40%、106.67%、 113.33%、73.33%、86.67%,达到显著水平 (P<0.05)。

图中不同小写字母表示不同处理之间在0.05水平存在显著性差异。下同
Different lowercase letters in the figure indicate significant differences among the different treatments at the 0.05 level. The same below
图1 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗抗氧化酶活性
Fig.1 Activities of antioxidant enzymes in cucumber seedlings with use of mixed NaAlg and CaCl2under Cd stress
2.5 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗MDA含量的变化
如图2所示,MDA含量随着NaAlg与CaCl2添加量的增加呈现先减少后增加的趋势,T400处理下黄瓜幼苗MDA含量达到最小值。T100、T200、T400和 T800处理下黄瓜幼苗MDA含量较CK分别减少26.76%、29.82%、46.42%和 20.74%,达到显著水平(P<0.05)。

图2 镉胁迫下NaAlg与CaCl2混合添加黄瓜幼苗MDA含量Fig.2 MDA content in cucumber seedlings with use of mixed addition of NaAlg and CaCl2 under Cd stress
3 讨 论
3.1 镉胁迫下NaAlg与CaCl2混合添加对黄瓜幼苗生长的影响
黄瓜是中国主栽蔬菜品种之一[21],以黄瓜为试验材料能更好地反应NaAlg对土壤Cd污染修复效应。张振华等[22]研究表明盐胁迫条件下植株相关生理指标的高低可直接反应出植株耐盐胁迫能力的强弱。本试验表明,在T50、T100、T200处理下黄瓜幼苗的株高、茎粗显著增加,表明在这3个处理水平下黄瓜幼苗的耐Cd胁迫能力增强。叶绿素含量能表示植物在胁迫条件下光合作用的强弱[23],本试验表明,随着NaAlg和CaCl2混合添加量的增加,黄瓜幼苗叶片的叶绿素含量呈现先减少再增加的趋势,表明黄瓜幼苗光合作用的能力先减弱再增强,在T800处理下叶绿素含量最高,可能是形成老化苗的原因[24],表明单纯的凭叶绿素含量的高低并不能反映植株生长的好坏。生物量降低是镉胁迫下植物最敏感的生理响应[25],本试验表明,地上部鲜质量、根鲜质量、地上部干质量、根干质量在T200处理下均达到最大值,表明在T200处理下黄瓜幼苗受到Cd2+的毒害作用最小。根系对地上部生长有重要影响[26]。本试验表明,少量NaAlg和CaCl2混合添加会促进黄瓜幼苗根系生长,随着NaAlg和CaCl2混合添加量的增加,黄瓜幼苗根系生长受到抑制,这与张瑛等[27]、李继光等[28]、任艳芳等[29]研究结果基本一致。
3.2 镉胁迫下NaAlg与CaCl2混合添加对黄瓜幼苗Cd2+积累及亚细胞分布的影响
Cd2+在植物组织的亚细胞分布特点,有助于更好地了解植物耐Cd2+机制[30],彭秋等[31]研究表明辣椒细胞壁在Cd2+的区隔和抗性中起重要作用,邹圆等[32]研究表明随着Cd2+含量的增加细胞壁的镉含量显著增加,本试验表明,黄瓜幼苗地上部亚细胞Cd2+含量无检出,黄瓜根系Cd2+的亚细胞分布总趋势为细胞壁>细胞液>细胞器,T200处理水平下根系细胞壁的Cd2+含量达到最小值,T800处理时根系细胞壁的Cd2+含量达到最大值,而此时的根系细胞液的Cd2+含量大于细胞壁的Cd2+含量,Sharma等[33]研究表明高含量的重金属胁迫会造成根系细胞壁透性增大,细胞壁对重金属的截留能力丧失,使得重金属离子向细胞内迁移,这与本试验研究一致。植物体内的重金属含量和积累量是评价植物修复效果好坏的最直接指标[34],本试验研究表明,黄瓜幼苗中的Cd2+主要集中在根系中,茎、叶中的Cd2+含量较少。T200处理水平下根系Cd2+含量达到最小值,随着NaAlg和CaCl2添加量的增加,根系的Cd2+含量也逐渐增加,这与施辰阳等[35]研究结果一致。
3.3 镉胁迫下NaAlg与CaCl2混合添加对黄瓜幼苗膜保护酶活性及MDA含量的影响
抗氧化酶活性可以反映植物膜系统受损伤程度,SOD、POD和CAT均是植物受逆境胁迫时起防御作用的重要保护酶[36],MDA作为植物体细胞膜脂过氧化的主要产物,在植物体受到外界盐碱等逆境时,其含量会升高[37]。本试验研究表明,随着NaAlg和CaCl2添加量的增加,POD和CAT活性显著增加,SOD活性的变化不显著,MDA含量显著减小,表明随着NaAlg和CaCl2添加量的增加,黄瓜幼苗受到Cd2+的伤害程度显著降低,这与杨若鹏等[38]的研究一致。
