酞菁锌光动力治疗诱导大肠癌Lovo细胞产生活性氧
2020-05-11李涛王玉陈伟夏春辉伦志强
李涛,王玉△,陈伟,夏春辉,伦志强
由于酞菁类配合物在红光照射下产生的.O2自由基与.OH具有很高的化学活性,能与肿瘤细胞内的有机物进行强氧化反应,杀死癌细胞,因此酞菁类配合物成为具有潜在前景的新一代抗肿瘤光敏剂[1-2]。线粒体凋亡途径是光敏剂治疗的主要作用途径,与光敏剂的光动力治疗(PDT)原理密切相关,具有中心枢纽和放大作用,因此线粒体的调节作用在肿瘤的治疗中具有重要作用。线粒体作为细胞供能的主要场所,发生损伤时会释放活性氧(Reactive oxygen species,ROS)等有毒化学物质到细胞质中,从而引起细胞凋亡、自噬的发生[3-4]。P38MAPK是细胞内主要的信号系统之一,参与多种刺激引起的信号级联反应,与ROS氧化应激损伤密切相关[5-7]。
本课题组已初步证明四-α-(对羧基苯氧基)酞菁锌(TαPcZn)光敏剂在大肠癌Lovo细胞中具有良好的富集能力,并且能明显抑制Lovo细胞生长,诱导细胞凋亡[7],但TαPcZn-PDT诱导肿瘤细胞线粒体凋亡过程中各级联反应中的具体环节和作用机制尚未清楚。鉴于前期的研究结果显示P38MAPK参与了TαPcZn-PDT诱导Lovo细胞凋亡的作用[8],因此本实验以P38MAPK基因为靶目标,探讨P38MAPK在ROS损伤中的作用,为今后光敏剂的临床应用提供理论基础。
1 材料与方法
1.1 实验材料 DMEM培养基、opti-MEM培养基购自美国ThermoFisher scientific公司,Silencer select Negative siRNA、Silencer select P38MAPK siRNA购自美国ThermoFisher Scientific公司,胰蛋白酶购自德国Sigma公司,JC-1和Hoechst33342购自美国Genmed Scientifics公司,RT-PCR试剂盒购自日本TaKaRa公司,抗P38MAPK抗体购自美国Cell Signaling Technology公司,Lovo细胞购自中科院动物研究所。MuseTM细胞分析仪购自美国默克密理博公司。
1.2 方法
1.2.1 细胞培养 取对数生长期的细胞(5×105个/L)接种于培养瓶中,分成5组:对照组、siRNA-阴性对照组、siRNAP38MAPK 转染组、TαPcZn-PDT组、TαPcZn-PDT/siRNAP38MAPK组。细胞在经不同因素处理后进行红光照射,红光的波长范围为600~700 nm,光动力为53.7 J/cm2。红光照射结束后,细胞孵育3 h,然后进行各项检测。
对照组:红光照射10 min。siRNA-阴性对照组:在Lovo细胞中转染siRNA-阴性对照(12.5 nmol/L)48 h后红光照射10 min。siRNA-P38MAPK(正向5'-GAAGCUCUCCAGACCAUUUtt-3',反向5'-AAAUGGUCUGGAGAGCUUCtt-3')转染组:在Lovo细胞中转染siRNA-P38MAPK(12.5 nmol/L)48 h后红光照射10 min。TαPcZn-PDT组:在Lovo细胞中添加TαPcZn(54µmol/L)2 h后红光照射10 min。TαPcZn-PDT/siRNA-P38MAPK组:在Lovo细胞中转染siRNA-P38MAPK(12.5 nmol/L)48 h后添加TαPcZn(54µmol/L),2 h后红光照射10 min。
1.2.2 RT-PCR检测siRNA沉默后P38MAPK、GAPDH mRNA表达情况 取对数生长期的Lovo细胞,将密度为5×105个/L细胞加入到培养瓶中,于37℃、5%CO2、饱和湿度培养箱中培养。培养24 h后弃去上清,以脂质体包裹的siRNA转染细胞。设对照组、siRNA阴性对照组、siRNA-GAPDH阳性对照组、siRNAP38MAPK组,分别于转染48 h后红光照射10 min,继续培养3 h后收集细胞,进行RT-PCR检测。反应条件:94℃变性30 s,58℃退火30 s,72℃延伸1 min,32个循环;另加72℃延伸10 min。GAPDH引物:上游5'-GAAGGTGAAGGTCGGAGTC-3',下游5'-GAAGATGGTGATGGGATTTC-3'。P38MAPK引物:上游 5'-GACAATCTGGGAGGTGCC-3',下游 5'-GACCCAGTCCAAAATCCA-3'。PCR产物进行15 g/L琼脂糖电泳,凝胶成像图像分析系统采集图像(BIORAD公司)。实验重复3次。
1.2.3 免疫印迹检测siRNA沉默后P38MAPK、GAPDH表达情况 处理结束后收集细胞,提取总蛋白[13],检测P38MAPK及GAPDH。收集细胞后,加入适量的细胞裂解液150µL,超声粉碎,4℃12 000×g离心1 h。用Lowry法测定蛋白浓度,30µg总蛋白/孔上样,经SDS-PAGE分离并转移至PVDF膜上。用含5%脱脂奶粉室温封闭1 h,分别孵育于一抗P38MAPK(1∶1 000)抗体及及GAPDH(1∶400),4 ℃过夜,用TBST漂洗5 min×3次,加1∶5 000的辣根过氧化物酶结合的二抗,室温孵育1 h,用TBS漂洗5 min×2次,TBST漂洗10 min×1次,ECL发光。凝胶成像图像分析系统采集图像(中国,上海天能公司Tanon 5200 Multi)。实验重复3次。
1.2.4 线粒体膜电位(Mitochondrial membrane potential,ΔΨm)的检测 培养于6孔板中的各组Lovo细胞,PBS洗2次,加入 1 mL 培养基,然后加入 1 mL JC-1(5,5’,6,6’-tetrachloro-1,1,3,3’-tetraethyl benzimidazolylcarbocyanine iodide,JC-1)染色工作液和7-氨基放线菌素(7-aminoactinomycin D,7-AAD)染液,充分混匀。于细胞培养箱中37℃孵育20 min结束后,吸除上清,用冰浴的JC-1染色缓冲液洗涤2次,经细胞分析仪检测。实验重复3次。
1.2.5 细胞活性氧ROS检测 细胞接种6孔板,参照1.2.1分组实验。光照前加入无荧光的2',7'-二氯二氢荧光素二乙酸酯(2',7'-Dichlorodihydrofluorescein diacetate,DCFH-DA),终浓度10µmol/L。光照结束后培养30 min,然后加入1 mL Hoechst33342,培养 30 min,PBS洗 2次。镜下观察,Hoechst33342染色,核蓝色显示凋亡(深染,团块状),DCFH被氧化成 2',7'-二氯荧光素(2',7'-Dichlorofluorescein,DCF),在细胞质内黄绿色荧光(表明有ROS,否则无色)。收集细胞,经细胞分析仪检测。实验重复3次。
1.2.6 Annexin V&Dead Cell双标检测细胞凋亡 各组细胞处理结束后收获细胞,PBS洗2次,用100µL结合缓冲液重新悬浮细胞,调节细胞浓度为1×105/mL,加100µL(Annexin-V和7-AAD),室温下闭光染色20 min,经细胞分析仪检测并分析。实验重复3次。
1.3 统计学方法 采用SPSS 22.0统计软件进行分析。符合正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较应用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 siRNA沉默P38MAPK表达 转染siRNAP38MAPK 48 h后,转染效率达到90%以上,见图1A,P38MAPK mRNA和蛋白的表达明显被抑制,提示转染成功。见图1B和1C。
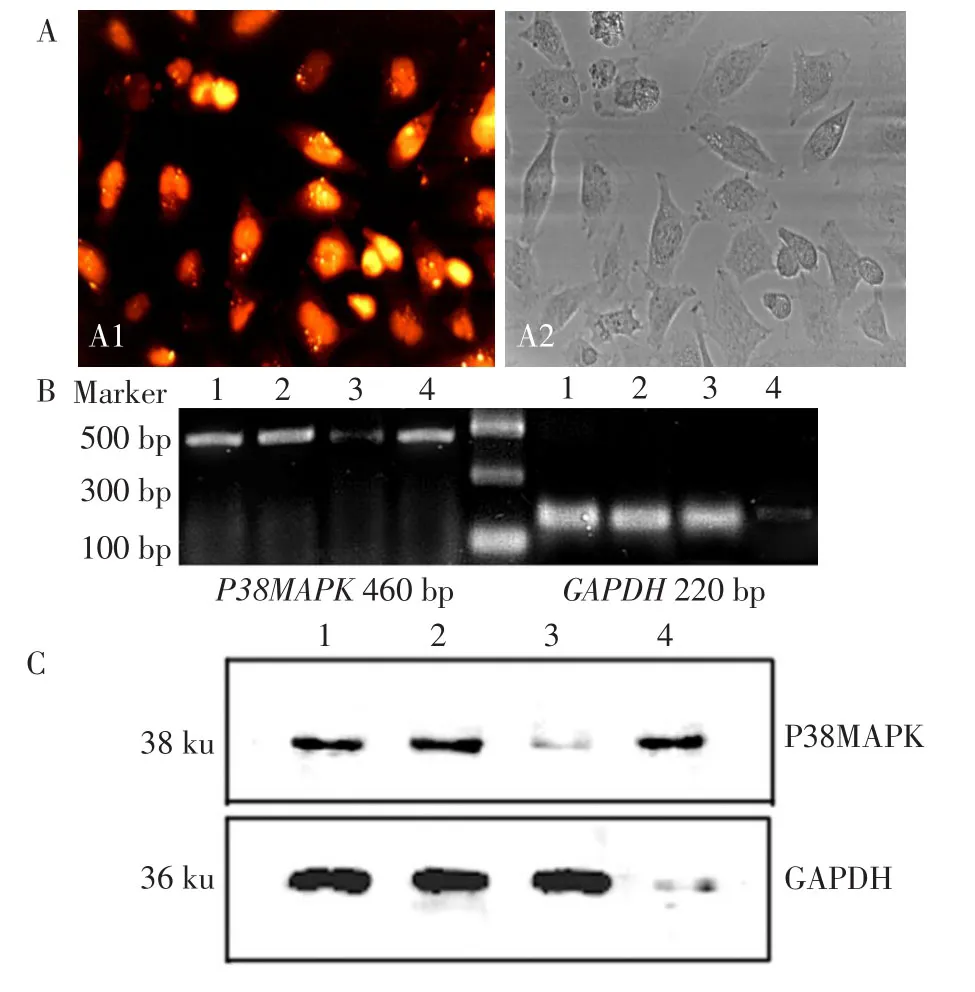
Fig.1 The silencing of P38MAPK in Lovo cells图1 siRNA沉默Lovo细胞P38MAPK表达
2.2 siRNA-P38MAPK介导 TαPcZn-PDT诱导的Lovo细胞线粒体损伤
2.2.1 siRNA-P38MAPK 影响 TαPcZn-PDT激发Lovo细胞产生ROS 倒置显微镜下观察发现,对照组、siRNA-阴性对照组、siRNA-P38MAPK组的Lovo细胞形态较好,为梭形、三角形,TαPcZn-PDT组和TαPcZn-PDT/siRNA-P38MAPK组的Lovo细胞部分收缩变圆。通过荧光显微镜下观察发现,对照组、siRNA-阴性对照组、siRNA-P38MAPK组产生ROS的Lovo细胞很少,TαPcZn-PDT组和TαPcZn-PDT/siRNA-P38MAPK组产生ROS的Lovo细胞较多且处于凋亡状态。见图2A。细胞流式结果分析显示,TαPcZn-PDT能明显诱导Lovo细胞产生ROS(P<0.05),siRNA-P38MAPK能部分阻碍TαPcZn-PDT诱导Lovo产生ROS(P<0.05)。见图2B和表1。
2.2.2 siRNA-P38MAPK影响 TαPcZn-PDT诱导Lovo细胞线粒体膜电位ΔΨm的改变 流式结果分析发现,TαPcZn-PDT 组和 TαPcZn-PDT/siRNAP38MAPK组线粒体膜电位发生去极化的细胞非常多(P<0.05),且 TαPcZn-PDT/siRNA-P38MAPK 组发生去极化的细胞少于TαPcZn-PDT组(P<0.05)。见图3、表1。
2.3 siRNA-P38MAPK影响TαPcZn-PDT诱导Lovo细胞凋亡 流式结果分析发现,TαPcZn-PDT组和TαPcZn-PDT/siRNA-P38MAPK组的凋亡细胞较多(P<0.05),且 TαPcZn-PDT/siRNA-P38MAPK 组的凋亡细胞比TαPcZn-PDT组的凋亡细胞少(P<0.05)。见图4、表1。
3 讨论

Fig.4 Effects of TαPcZn-PDT on the apoptosis of Lovo cells with siRNA-P38MAPK图4 在siRNA-P38MAPK作用下TαPcZn-PDT对Lovo细胞凋亡的影响
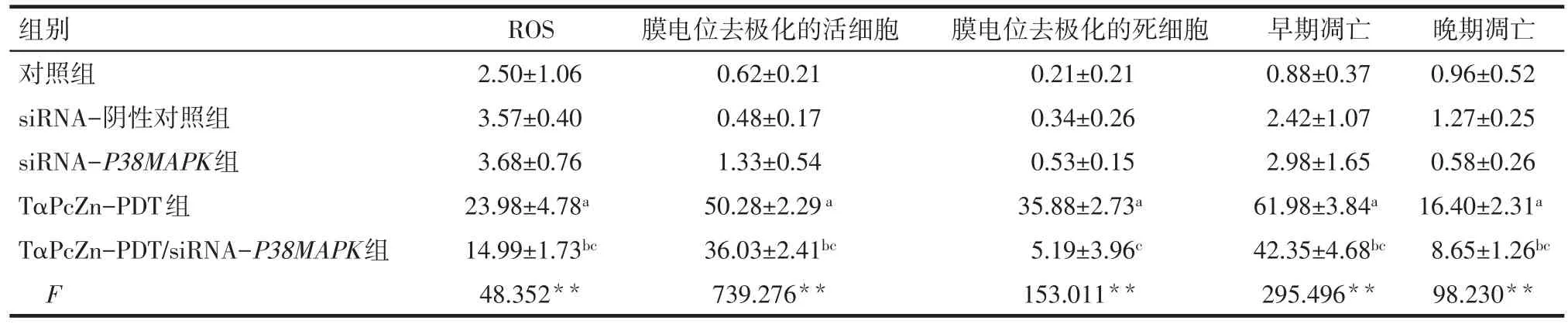
Tab.1 Effects of TαPcZn-PDT on ROS,ΔΨm and apoptosis level of Lovo cells after transfection with siRNA-P38MAPK表1siRNA-P38MAPK转染后TαPcZn-PDT对Lovo细胞ROS、ΔΨm和凋亡的影响 (n=3,%,x±s)
目前已有研究证实TαPcZn-PDT具有诱导肿瘤细胞凋亡的作用,且P38MAPK参与此过程[8-9],但是P38MAPK影响凋亡过程的具体机制尚不清楚。因此,本文以P38MAPK为靶目标,探讨了TαPcZn-PDT诱导Lovo细胞凋亡过程中P38MAPK在线粒体损伤中的作用。实验初期,在对照部分设立siRNA-阴性对照组,鉴于siRNA-阴性对照组与空白对照组无差异,另外考虑到合成的TαPcZn较少,因此未在TαPcZn-PDT作用下设立siRNA-阴性对照组,只分别 设 了 TαPcZn-PDT 组 和 TαPcZn-PDT/siRNAP38MAPK组。
3.1 P38MAPK参与TαPcZn-PDT诱导Lovo细胞线粒体的损伤 线粒体的变化在凋亡过程中最先出现,因而探讨TαPcZn-PDT诱导Lovo细胞线粒体的损伤具有重要意义。线粒体损伤先从线粒体膜通透性孔道(mitochondrial permeability transition pore,MPTP)开放和ROS产生开始,MPTP的开放导致线粒体ΔΨm的降低,产生的ROS释放到细胞质中,从而损伤细胞器、细胞核,导致细胞凋亡的产生。ROS包括超氧自由基、过氧化氢及其下游产物过氧化物和羟化物等,参与细胞生长增殖、发育分化、衰老和凋亡以及许多生理和病理过程[10]。本研究发现,TαPcZn-PDT 能明显诱导 Lovo产生 ROS,且在siRNA-P38MAPK作用下产生的ROS明显减少,说明P38MAPK介导了TαPcZn-PDT诱导Lovo细胞产生ROS,这与前期研究基础TαPcZn-PDT具有诱导肿瘤细胞凋亡的作用,且P38MAPK参与此过程相呼应[8-9]。
由于线粒体ΔΨm的去极化是细胞凋亡早期的一个标志性事件,因此线粒体的损伤最先体现在线粒体ΔΨm的变化[11]。因此,本研究又对线粒体的ΔΨm的变化进行了研究,探讨siRNA-P38MAPK介导TαPcZn-PDT诱导的Lovo细胞线粒体损伤的机制。本研究发现,TαPcZn-PDT导致早期凋亡和晚期凋亡的Lovo细胞ΔΨm发生去极化,而这种去极化现象可被siRNA-P38MAPK抑制,主要是在早期凋亡的发生去极化的细胞大量减少,从而导致晚期凋亡的发生去极化的细胞也大量减少。这与P38MAPK参与TαPcZn-PDT具有诱导肿瘤细胞凋亡的作用相一致。
本研究发现P38MAPK介导TαPcZn-PDT诱导的Lovo细胞的线粒体凋亡途径是通过影响ROS的产生和线粒体膜电位ΔΨm的改变来实现的。沉默P38MAPK基因可明显减弱TαPcZn-PDT诱导的ROS释放,阻碍了线粒体膜电位去极化,从而降低了TαPcZn-PDT诱导的细胞凋亡。
3.2 P38MAPK参与TαPcZn-PDT诱导Lovo细胞凋亡 线粒体的变化在凋亡过程中最先出现,因此在研究线粒体损伤的同时,也检测了细胞凋亡的情况。研究结果再一次证明了TαPcZn-PDT诱导的Lovo细胞凋亡的作用,且主要发生在早期凋亡,这与TαPcZn-PDT诱导的Lovo细胞线粒体ΔΨm去极化相一致,更加证明了TαPcZn-PDT通过诱导Lovo细胞线粒体损伤从而诱导Lovo细胞凋亡,与Panel等[12]的研究结果一致,说明线粒体在细胞凋亡中具有重要作用。本研究结果还显示,siRNA-P38MAPK部分抑制了TαPcZn-PDT诱导Lovo细胞凋亡的作用,这与siRNA-P38MAPK部分抑制ΔΨm发生去极化的作用相一致。因此,认为P38MAPK参与TαPcZn-PDT诱导Lovo细胞凋亡的过程。
本项目组前期研究结果显示,在此凋亡过程中还有线粒体相关的蛋白也参与到此过程,如细胞凋亡诱导因子(apoptosis inducing factor,AIF)、促凋亡蛋白BAX、细胞色素C(Cytochrome C,Cyto-C)等参与[7-8],与Kello等[15]研究结果一致,均促进了细胞凋亡过程。BAX参与MPTP孔道的开放,引起ΔΨm去极化加剧,同时开放的孔道引起AIF、Cyto-C的释放,继而加剧了细胞凋亡的进程[16]。P38MAPK作为应激反应通路起到重要作用,它不仅通过caspase-3通路参与凋亡,还可通过线粒体通路参与到凋亡中[17],因此siRNA-P38MAPK减弱了ROS的释放,降低了凋亡率,但是凋亡细胞中形成的线粒体-caspase-线粒体的正反馈放大回路还在起作用,因此凋亡还存在[18-19]。
ROS、线粒体膜通透性及线粒体凋亡途径三者之间存在着紧密的联系,ROS与线粒体膜MPTP孔道的开放之间的关系一直存在争议[11-12]。当细胞受到ROS刺激时,线粒体MPTP开放,线粒体膜电位丢失,继而引起ROS大量释放,进一步加剧了MPTP的开放,又加剧了ROS的释放和累积,不断往复引起线粒体损伤,最后导致线粒体途径的细胞凋亡[13,19],这与本研究结果一致,即TαPcZn-PDT诱导ROS产生,同时伴有线粒体膜电位ΔΨm去极化,进而导致细胞凋亡。
综上,TαPcZn-PDT通过诱导ROS产生,引起线粒体膜电位去极化,导致Lovo细胞凋亡,P38MAPK通过影响ROS产生和释放从而影响上述凋亡过程。
(图2见插页)
