金属酞菁-血清白蛋白杂化酶的合成及其性质的研究
2020-05-08赵丹丹张恩风莫丹白丽娟张玉贞边贺东
赵丹丹,张恩风,莫丹,白丽娟,张玉贞,边贺东
(广西民族大学 化学化工学院 广西林产化学与工程重点实验室,广西 南宁 530006)
酞菁中心位置的空腔内有四个氮原子,容易和金属元素发生配位作用,形成具有特殊颜色的配合物,俗称金属酞菁[1]。酞菁分子中含有18π电子,因其特殊的结构,具有良好的稳定性[2]。由于金属酞菁在有机溶剂和水中的溶解性较小,研究者发现在酞菁环上引入取代基,如 —COOH、—SO3H等均能有效增强酞菁在水中的溶解度[3]。
血清白蛋白是血浆中含量最多的蛋白质,易和药物分子以分子间力相结合,常作为载体来研究[4]。通过苯酐-尿素法合成了八羧基酞菁锰(MnOCPc)和八羧基酞菁铁(FeOCPc)。在模拟人体生理条件下,使用荧光光谱、紫外-可见吸收光谱、圆二色光谱等方法,研究了MnOCPc、FeOCPc与BSA 的相互作用。研究了金属酞菁及金属酞菁-BSA杂化蛋白SOD活性[5]。
1 实验部分
1.1 试剂与仪器
均苯四甲酸酐、尿素、钼酸铵、牛血清白蛋白(BSA,分子量为66 210)、氯化铁、氯化锰、黄嘌呤氧化酶(XOD)、黄嘌呤(XO)、氯化硝基四氮唑兰(NBT)、超氧化物歧化酶(SOD)、氯化钠、乙醇、磷酸盐等均为分析纯;实验用水均为二次去离子水。
Perkkin Elmer instruments Spectrum One红外分光光度计;RF-5301 型荧光分光光度计;Jasco-810圆二色谱仪;HX-HH420A4超级恒温水浴箱;Cary100紫外-可见分光光度计;DF-101S 集热式恒温加热磁力搅拌器;arium Pro 超纯水系统。
1.2 溶液配制
配制浓度为 0.05 mol/L,pH=7.43的磷酸盐缓冲溶液(PBS),其中含有NaCl的浓度为0.1 mol/L;以PBS缓冲溶液配制牛血清白蛋白储存液(1.0×10-3mol/L),并保存于4 ℃,用前稀释。实验中NaCl的浓度均保持在0.1 mol/L,用以维持离子强度。
1.3 金属酞菁的合成
八羧基酞菁锰(MnOCPc)和八羧基酞菁铁(FeOCPc)的制备参照文献[6],所得产率分别为18%和20%。
1.4 金属酞菁与BSA相互作用
1.4.1 紫外-可见吸收光谱的测定 在3 mL 浓度为1×10-6mol/L的BSA溶液的石英比色皿中,用移液枪向BSA溶液中滴加金属酞菁储备液,使金属酞菁配合物浓度与BSA溶液浓度比为0~3,温度为298 K时,分别扫描纯BSA和金属酞菁配合物与BSA作用的紫外-可见光谱曲线。
1.4.2 稳态荧光光谱的测定 在3 mL 浓度为1×10-6mol/L的BSA溶液加入石英比色皿中,固定激发波长为280 nm,狭缝宽度均为15 nm,用移液枪每次加入3 μL 浓度为1×10-3mol/L的MnOCPc或FeOCPc储备液。使金属配合物浓度与BSA溶液浓度比为0~10,每次加完样品,搅拌均匀,静止3 min。在温度297 K,扫描300~450 nm纯BSA的荧光光谱曲线和金属酞菁与BSA作用的淬灭曲线。
1.4.3 圆二色光谱的测定 将3 mL 浓度为1×10-6mol/L的BSA溶液于石英比色皿中,用移液枪每次加入3 μL浓度为1×10-3mol/L的MnOCPc或FeOCPc储备液,使金属酞菁与BSA溶液浓度比为0~2。扫描190~280 nm范围BSA的圆二色光谱曲线和金属酞菁与BSA作用的圆二色光谱曲线。
2 结果与讨论
2.1 配合物的光谱分析
2.1.1 元素分析 MnOCPc元素分析结果为:理论值(%):C,52.25;H,1.75;N,12.19;计算值(%):C,52.07;H,1.79;N,12.08。
FeOCPc元素分析结果为:理论值(%):C,52.20;H,1.75;N,12.19;计算值(%):C,52.14;H,1.93;N,12.12。
2.1.2 紫外光谱 将MnOCPc、FeOCPc分别溶于二甲基亚砜(DMSO),配制成1×10-6mol/L的溶液,设置波长范围为200~800 nm进行扫描,MnOCPc、FeOCPc有两个强吸收区域,在600~700 nm的Q带的吸收峰为680 nm,在300~400 nm的B带吸收峰为343 nm,与文献报道一致。证明了该产物为金属酞菁配合物[7]。

2.2 金属酞菁配合物与牛血清白蛋白相互作用
2.2.1 金属酞菁配合物与BSA相互作用的紫外-可见吸收光谱 在BSA的分子中,紫外光谱的280 nm波长处有一个由芳香族氨基酸(Trp、Tyr和Phe)造成的吸收峰。该吸收峰用于研究BSA和化合物之间的相互作用。由图1可知,在保持BSA浓度不变的情况下,逐渐滴加MnOCPc和FeOCPc溶液,BSA的紫外-可见光谱显示在203 nm和280 nm处的吸收峰逐渐降低且同时伴随着稍稍的红移[10],说明金属酞菁与BSA进行了结合作用。图中从a到d,配合物的浓度依次为0,1,2,3×10-6mol/L,BSA的浓度为1.0×10-6mol/L。
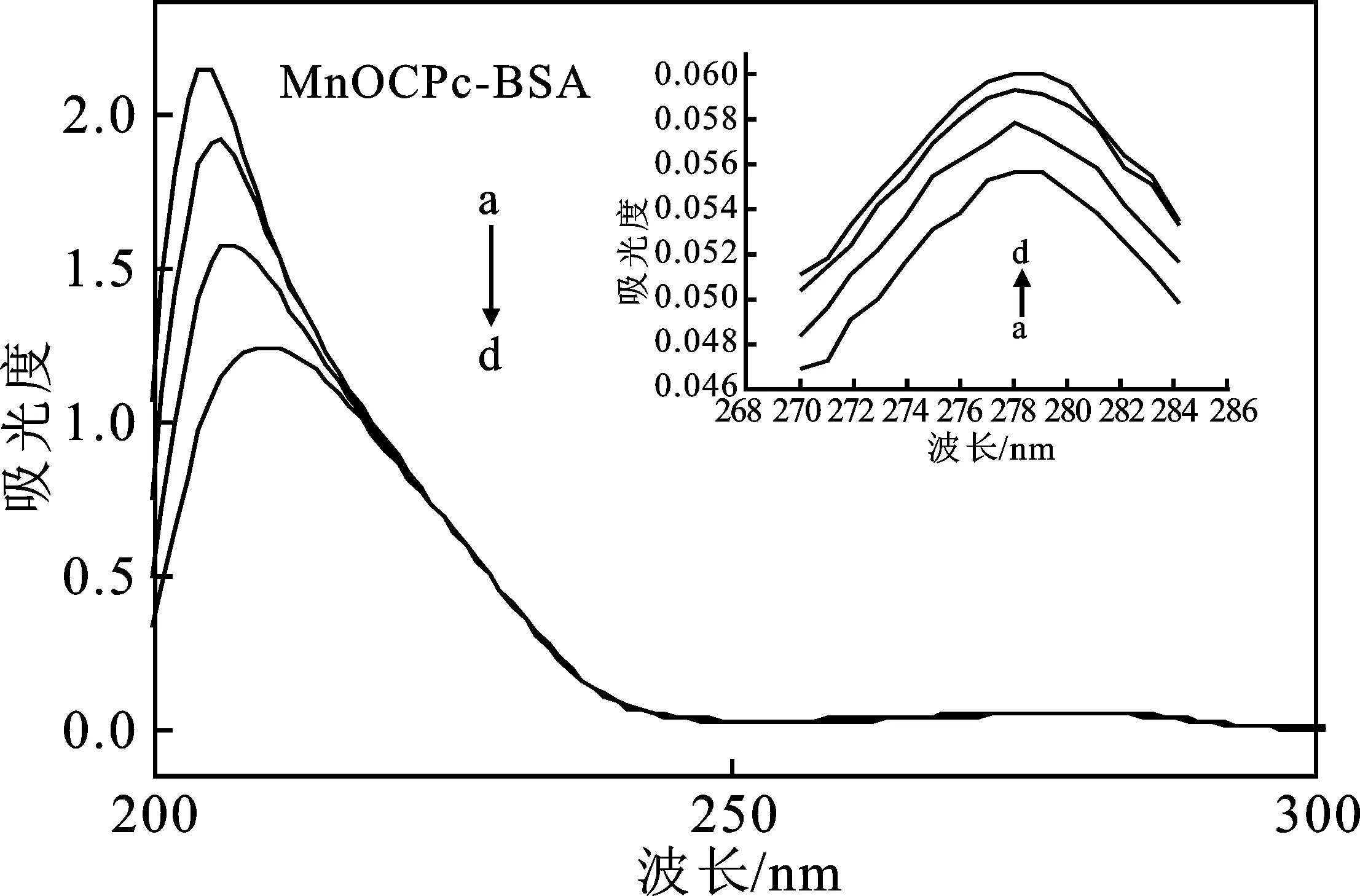

图1 金属酞菁配合物与BSA相互作用的紫外吸收光谱
2.2.2 金属酞菁配合物与BSA相互作用的荧光光谱 BSA分子中含有能产生荧光的残基(色氨酸、酪氨酸、苯丙氨酸),当激发波长为280 nm或者335 nm时,BSA分子中色氨酸残基会产生比较强的荧光发射峰[11]。由图2可知,在298 K温度下,当激发波长为280 nm时,BSA在341 nm左右附近有比较强的荧光发射峰,在保持BSA的浓度不变的条件下,随着所加入的金属酞菁配合物浓度的增大,荧光发射峰的峰形基本保持不变,峰的强度逐渐降低,表明BSA与金属酞菁配合物之间发生了相互作用,从而引起了荧光淬灭[12]。图2的条件为:温度为298 K,λex= 280 nm,λem= 341 nm,pH=7.43,BSA的浓度为1.0×10-6mol/L,从a到k,配合物的浓度为0~2×10-5mol/L,每一浓度差为2×10-6mol/L,其底线是酞菁溶液最大浓度的荧光曲线。


图2 298 K温度下金属酞菁配合物对BSA的荧光猝灭光谱
2.2.3 金属酞菁配合物对BSA荧光淬灭机理 根据荧光猝灭过程的作用机制的不同,通常可以分为静态猝灭和动态猝灭。前者归因于荧光团和猝灭剂形成基态复合物,后者是由荧光团和猝灭剂相互碰撞引起的[13]。
荧光猝灭的过程可以利用Stern-Volmer方程来进行分析:
F0/F=1+kqτ0[Q]=1+KSV[Q]
(1)
其中,F0是没有加金属酞菁配合物时BSA的荧光强度;F则是加入了金属酞菁配合物后的BSA的荧光强度;kq是猝灭速率常数;τ0是无金属酞菁配合物时BSA的平均荧光寿命(约为10-8s);[Q]是金属酞菁配合物的浓度;KSV是Stern-Volmer猝灭常数。
根据式(1),以[Q]为横坐标,F0/F为纵坐标作图,可以分别得到298 K温度下MnOCPc或FeOCPC与BSA作用的Stern-Volmer曲线,结果见图3和表1。
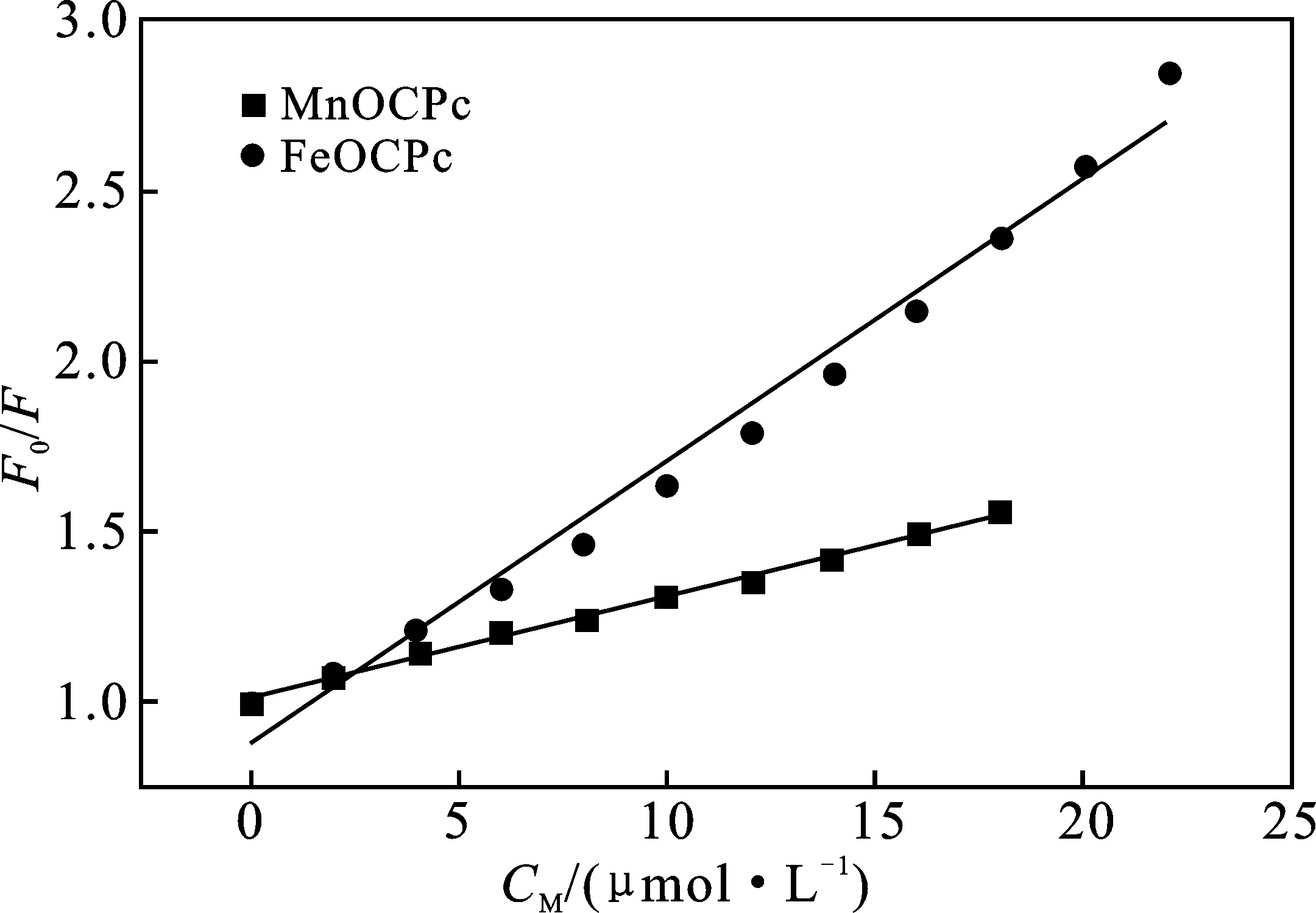
图3 金属酞菁配合物与BSA相互作用的Stern-Volmer曲线图
由表1可知,金属酞菁与蛋白质相互作用的猝灭速率常数kq均大于动态猝灭的最大猝灭速率常数2.0×1010L/(mol·s),说明BSA与金属酞菁相互作用为静态猝灭过程。

表1 金属酞菁配合物与BSA相互作用的猝灭常数、结合常数和位点数
2.2.4 金属酞菁配合物与BSA的结合常数、结合位点数 对静态猝灭过程来说,结合位点数n和结合常数K可以通过式(2)来计算[14]:
lg[(F0-F)/F]=lgK+nlg[Q]
(2)
根据公式(2),以lg[Q]为横坐标, lg[(F0-F)/F]为纵坐标作图(图4)。根据直线的截距和斜率可以计算出结合位点数n和结合常数K。
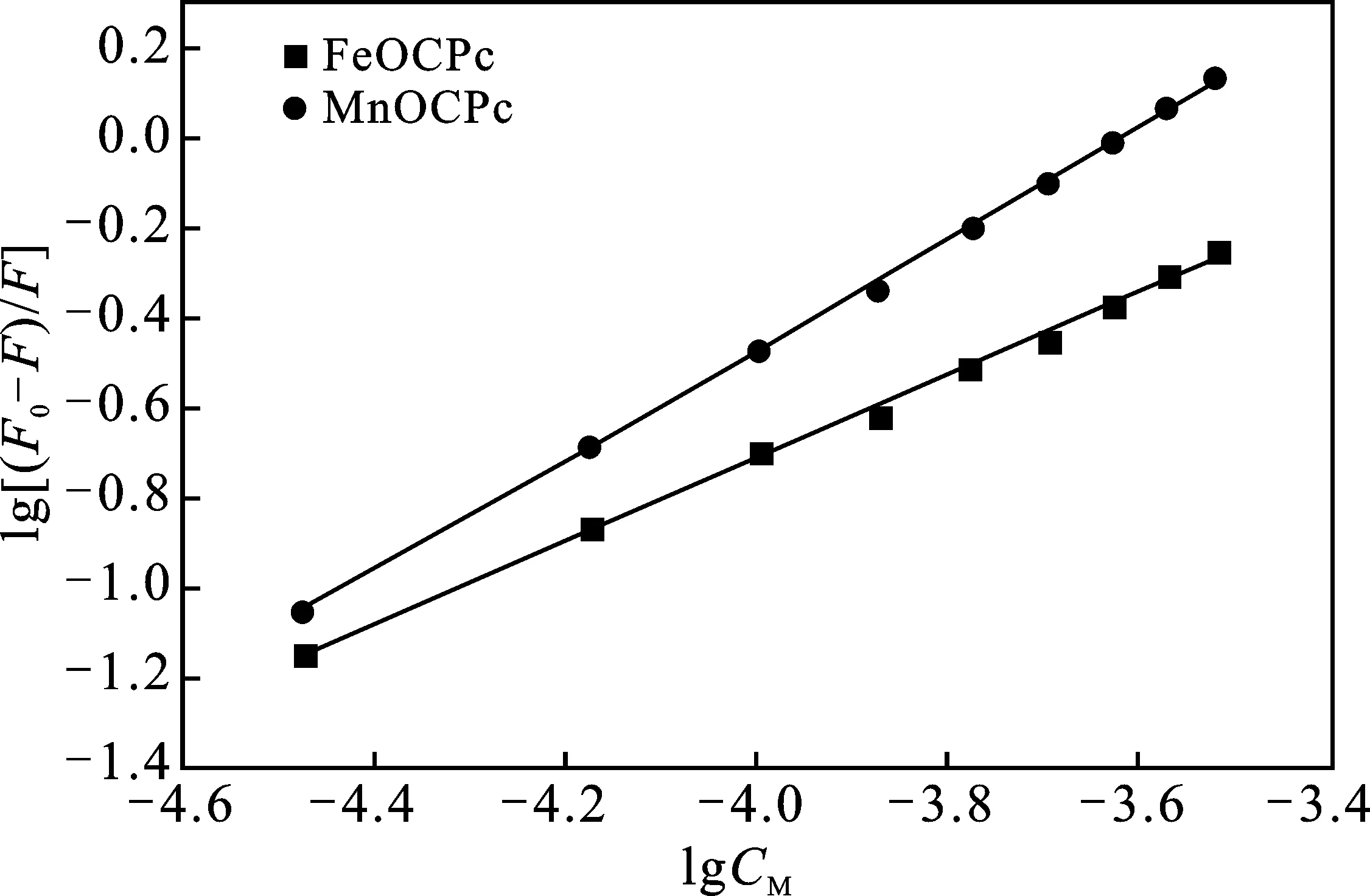
图4 配合物与BSA相互作用的双对数曲线图
由图4可知,金属酞菁与BSA作用的结合常数都大于104L/mol,而且计算所得结合位点数n都近似等于1(表1),说明MnOCPc及FeOCPc与BSA相互作用的结合位点数都为1。
2.2.5 金属酞菁配合物与BSA相互作用的圆二色谱 在298 K时,BSA的浓度为1.0×10-6mol/L,从a到c,[BSA]∶[complex]=1∶0,1∶1和1∶2,见图5。
由图5可知,随着加入的MnOCPc、FeOCPc配合物浓度的增加,牛血清白蛋白的峰形保持不变,吸收峰的位置稍微向上移动,说明加入MnOCPc、FeOCPc与肽键发生了相互作用,表明配合物能够诱导蛋白质的α-螺旋含量降低,导致BSA的二级结构发生了变化。

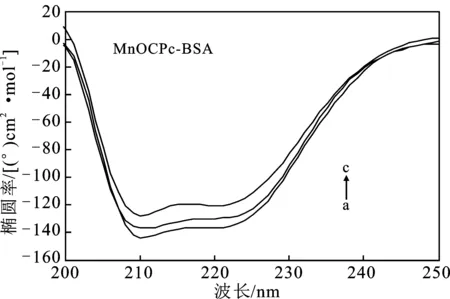
图5 金属酞菁配合物与BSA相互作用的圆二色光谱
可以通过式(3)计算蛋白质分子中摩尔椭圆率(MRE)[15]:
MRE=θobs(m deg)/(10×n×l×Cp)
(3)
其中,θobs为椭圆度(所求MRE对应CD图上的纵坐标),Cp为BSA的摩尔浓度(1.0×10-6mol/L),n为氨基酸残基的数目(BSA为583),l为样品池的厚度(1 cm)。
BSA的α-螺旋含量的定量分析可以使用以下等式获得[16]:
(4)
通过计算可以得出,纯蛋白(BSA)α-helix结构含量为63.99%,当BSA-FeOCPC、BSA-MnOCPc体系均为1∶1时,BSA的α-helix结构分别为58.8%,60.78%,说明BSA的α-helix结构含量降低,当BSA-FeOCPC、BSA-MnOCPc体系为2∶1时,BSA的α-helix结构分别为55.31%,57.61%,BSA α-helix的含量继续降低,但是仍以BSA中α-helix为主,此结果说明BSA分别与MnOCPc、FeOCPc结合引起的BSA二级结构的变化,导致了BSA中的α-helix结构百分含量减少,相对来说,FeOCPc的加入对BSA 的α-helix结构影响相对较大。
2.3 金属酞菁的SOD活性

为了进一步确定MnOCPc、FeOCPc和MnOCPc-BSA、FeOCPc-BSA的SOD活性,通过式(5)作进一步计算来获得其反应速率常数[18]:
(5)

金属酞菁配合物或金属酞菁配合物-BSA加合物的浓度为横坐标,以V0/Vcat-1为纵坐标作图,V0是NBT的还原速率,Vcat是复合物存在时NBT的还原速率,得到图6中的曲线。
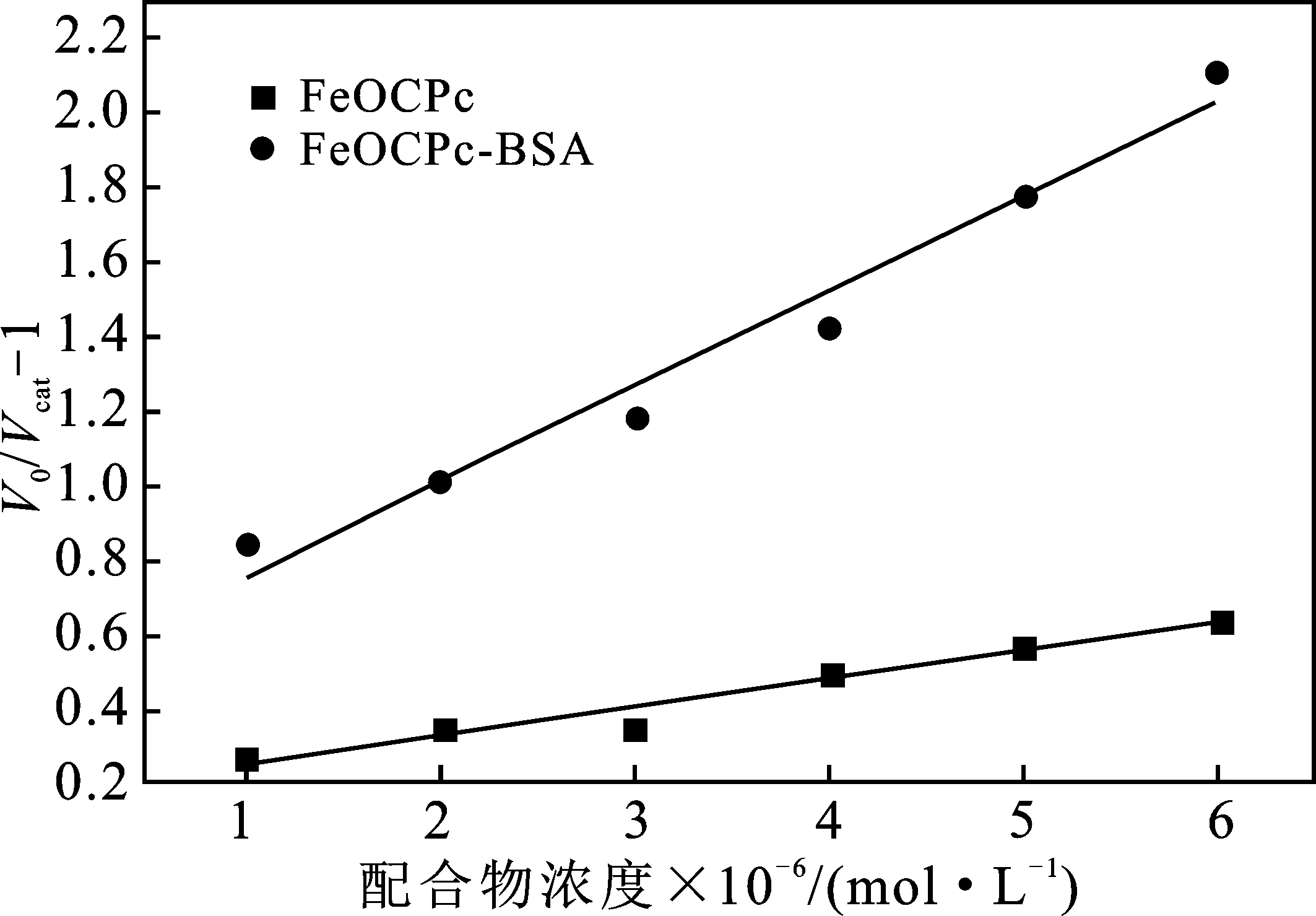
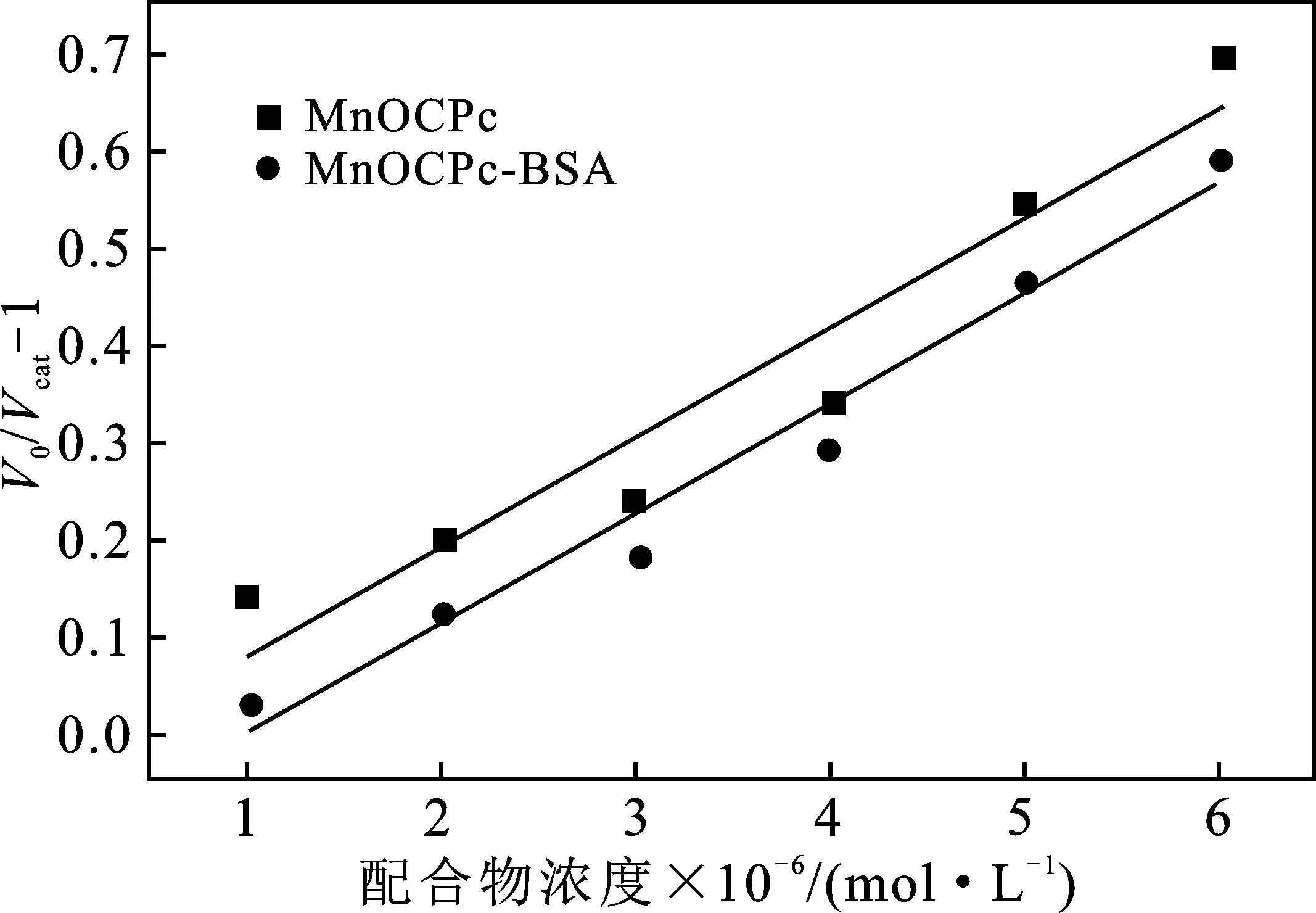
图6 配合物[Complex]的V0/Vcat-1曲线图
由图6可知,MnOCPc与MnOCPc-BSA相比斜率几乎没有变化,说明加了BSA并没有明显提高其SOD活性。相对来说,FeOCPc-BSA与FeOCPc相比斜率明显的降低,说明在锰金属酞菁配合物中加入了BSA 提高了SOD活性。
为了更进一步研究FeOCPc、MnOCPc、FeOCPc-BSA、MnOCPc-BSA的SOD活性,计算了其IC50值[19]。参照式(6)可求IC50值。
ΔA0/ΔAcomplex-1=1
(6)
其中,ΔA0是添加FeOCPc、MnOCPc或其加合物之前在550 nm处吸光度的差值;ΔAcomplex是添加FeOCPc、MnOCPc或其加合物之后在550 nm处吸光度的差值;此时若以ΔA0/ΔAcomplex-1为横坐标,金属酞菁配合物或其BSA加合物的浓度为纵坐标作图,可以得到一条直线。再参考公式(7),即可以求出IC50值,通过IC50可以进一步求出Kcat[20]。
Kcat=Kdetector[detector]/ IC50
(7)
同时测定了天然SOD酶的活性,求得其IC50值为1.56×10-6mol/L,根据式(7),得到表观速率常数值,结果见表2。

表2 金属酞菁配合物及加合物的IC50和Kcat值
由表2可知,在没有加牛血清白蛋白之前,这两种金属酞菁配合物的SOD活性顺序为MnOCPc>FeOCPc,而加入BSA以后,SOD活性顺序为:FeOCPc-BSA>MnOCPc-BSA>MnOCPc>FeOCPc。FeOCPc的 IC50值大于相应的FeOCPc-BSA加合物的值,在加了BSA后,其表观速率常数也由原来的4.47×103M-1·s-1提高到14.95×103M-1·s-1,增加了2倍之多;说明牛血清白蛋白的加入增强了金属酞菁配合物的SOD活性。这可能归因于金属酞菁配合物与BSA结合后,BSA为其提供了疏水性空腔,BSA中某些带电荷的残基基团促进了自由基的活化,使反应更容易发生。相较而言MnOCPc加了BSA后,其IC50和Kcat几乎没有提高。说明BSA对不同金属中心的配合物促进的效果不同,原因可能与金属离子自身的性质有关,也可能与金属酞菁分子的属性有关。
3 结论
通过熔融法使均苯四甲酸酐、尿素与氯化锰反应,得到八羧基金属酞菁锰和金属酞菁铁。通过荧光光谱、紫外光谱、圆二色光谱等分析方法研究了金属酞菁配合物与BSA的相互作用。荧光光谱表明,随着金属酞菁配合物浓度的增加,BSA有规律的发生了荧光猝灭现象,说明金属酞菁锰和金属酞菁铁的加入可以使得BSA内源性荧光猝灭,主要为静态猝灭。通过Stern-Volmer方程得到了淬灭常数KSV分别为5.2×104,6.9×104L/mol,结合位点为1。紫外光谱表明,随着金属酞菁配合物浓度的增加,BSA在203,280 nm的吸光度逐渐降低,并伴有红移。圆二色光谱表明,金属酞菁配合物使BSA 的构象发生变化,α-螺旋结构含量降低。金属酞菁、金属酞菁-BSA加合物的抗氧化活性测试表明均表现出一定的SOD活性,说明牛血清白蛋白的加入增强了金属酞菁配合物的SOD活性。
