典型城市湖泊五里湖底栖动物群落演变特征及其生态修复应用建议*
2020-05-08薛庆举汤祥明龚志军蔡永久
薛庆举,汤祥明,龚志军,高 光,蔡永久
(中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008)
底栖动物作为水生生态系统中的分解者或消费者,对维持水生生态系统的稳定和健康发展具有重要作用[1-2]. 底栖动物中的一些物种不仅能够产生一定的经济效益,还可以被用来指示水体的污染状况[3],其中大型底栖动物的物种多样性水平就常与水体的污染状况关系密切[4]. 此外,大量研究表明,底栖动物中的一些大型滤食性软体动物具有极强的滤食能力,可通过滤食作用明显降低水体中浮游植物、有机碎屑和无机颗粒等物质的含量,从而提高水体透明度,改善水质[5-7]. 滤食性软体动物亦被应用到太湖五里湖的生态修复中,对水体透明度的提升和氮、磷等营养物质含量的降低起到了良好效果[8].
五里湖,又称蠡湖,与太湖北部梅梁湾相连,面积约8.6 km2,东西长约6 km,南北宽为0.3~1.2 km,湖岸线长约21 km[9],是我国城市浅水湖泊生态修复治理的典型代表. 1950s时,该湖基本处于原始状态,湖水清澈见底,湖内水草丰茂. 但自1950s末期以来,受围垦、养殖、建闸等人类活动影响,湖泊生态系统受到严重破坏,至1990s初,湖内大型水生植物及大型底栖动物基本消失[10-12]. 为了恢复五里湖生态系统健康,从1980s末期开始对五里湖进行局部修复,到2000年时开始进行污染源控制,再到2002年开展综合整治工程[13],这一系列的生态修复措施使湖内水质得到明显改善,湖泊生态系统功能也得到一定程度的恢复[14-15]. 自2006年开始,五里湖内开始投放螺、蚌、蚬等大型软体动物用于湖体生态修复. 然而,关于近几十年来五里湖内底栖动物群落演变特征及其对环境治理与恢复过程的响应尚无研究.
本文以2007-2017年五里湖底栖动物季度调查数据为基础,结合文献资料,探讨了五里湖底栖动物群落的演变规律. 同时,搜集了近几十年来水质、沉积物及浮游植物等相关历史资料,综合考虑五里湖内开展的重要生态修复工程,分析了五里湖底栖动物群落演变特征的主要影响因素. 最后,针对底栖动物在水体生态修复中的应用现状,结合五里湖底栖动物生态修复应用情况,提出了底栖动物在生态修复应用中的几点建议,以期为五里湖及类似城市湖泊生态修复中底栖动物应用及相关研究提供参考.
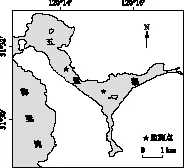
图1 五里湖底栖动物长期监测点位分布Fig.1 The regular sampling sites of zoobenthos in Lake Wuli
1 研究方法
1.1 数据获取
文中所用数据主要包括1950年以来五里湖水体理化参数、浮游植物密度与优势种、沉积物理化参数以及底栖动物密度、生物量与优势种数据. 其中,水体理化数据来自文献[9,11,15-22],浮游植物密度与生物量数据来自文献[11],沉积物理化数据来自文献[11,16,19,22-24],2007年之前的底栖动物数据来自文献[11, 19, 25]. 此外,浮游植物2008-2013年数据以及部分底栖动物数据来自中国科学院太湖湖泊生态系统研究站,2007 -2017年底栖动物数据来自本文作者对五里湖的长期季度监测,在五里湖布设了两个长期监测点(图1). 以上所有年度数据均为该指标当年的年平均值.
本研究中使用1/40 m2改良版彼得森采泥器采集底栖动物样品,每个点位采集3次,样品的采集、前处理及种类鉴定的详细方法参考文献[26],水质类别标准参照我国《地表水环境质量标准》(GB 3838-2002).
1.2 环境因子测定方法
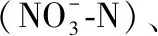
1.3 五里湖生态修复历程简介
近几十年来,五里湖开发及生态修复主要事件如表1所示. 五里湖人类开发活动自1950s末期开始,至2003年,围湖造田、围地养鱼和水产养殖已成为五里湖水体的第二大污染源. 五里湖生态修复过程从1980s末开始,修复措施主要包括局部修复、污染源控制和综合整治. 其中,局部修复主要为小范围水生植物种植,综合整治中生态修复工程主要为对五里湖水生植物系统的重建,在修复过程中开展保水渔业项目,投放软体动物和鱼类,并建立示范区.

表1 五里湖开发及生态修复重点项目简介
1.4 数据分析
1.4.1 Shannon-Wiener多样性指数 Shannon-Wiener生物多样性指数(H′)通过以下公式进行计算[32]:
(1)
式中,ni为第i种底栖动物的密度,N为该点位样本中底栖动物总密度. 关于底栖动物多样性的评价标准可参考文献[33].
1.4.2 物种优势度 底栖动物物种优势度通过以下公式进行计算[34]:
(2)
式中,ni为第i种底栖动物的密度,N为该点位样本中底栖动物总密度,fi为该物种在各点位出现的频率,物种优势度Y>0.02的物种为优势种.
1.4.3 统计分析 文中使用IBM SPSS 24.0对底栖动物和环境因子数据进行Spearman等级相关分析. 此外,文中点位图的绘制由ArcGIS 10.2完成,而其他图的绘制均由软件Origin 2016完成.
2 结果分析
2.1水质变化特征
1950年以来五里湖水体理化特征变化显著(图2),CODMn浓度的变化可分为以下几个阶段:第1阶段,1950s-1980s,浓度均值仅为2.53 mg/L,可达Ⅰ类或Ⅱ类水标准;第2阶段,1990s初期,此时CODMn浓度急剧上升,均值可达24.83 mg/L,峰值为57 mg/L,水质均处于Ⅴ类或劣Ⅴ类标准;第3阶段,1990s末期至今,此阶段CODMn浓度整体呈降低趋势,其平均值为6.45 mg/L,水质基本处于Ⅳ类及以上标准,2012年时可达Ⅱ类水. 相关分析结果显示,CODMn浓度与TN浓度呈显著正相关(P<0.05).

图2 1950年以来五里湖水质指标的变化Fig.2 Variation of different water physico-chemical parameters in Lake Wuli since 1950
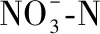

从整体上看,Chl.a浓度自1990年以来呈波动下降趋势,其在2001年出现最大值0.08 mg/L,在1993、2003和2007年时分别出现阶段性谷值,自2007年降至最小值0.008 mg/L后,近几年来呈不断上升趋势. 除在1992年和2017-2018年时出现极低值,DO浓度在其他年份均处于较高值(> 8 mg/L),但从整体上看,水体中DO浓度存在下降趋势. 在1950s时,水体SD>1.4 m,自1980年开始,SD值降至0.5 m以下,特别是在2008-2010年期间,SD值仅为0.28 m,在2017-2018年时恢复至0.51 m.
综上所述,除DO浓度和SD外,五里湖水体各水质指标之间存在相似的变化规律,相关性分析结果也印证了这一点(表2). 各指标均在1980s-1990s期间开始显著升高,大部分在1994年或2002年时达到最大值,在2007年附近降至最低值. 此外,大部分水质指标均在2017-2018年出现一定程度的升高. 在水质较差的时期,CODMn、TN、NH3-N和TP均达到劣Ⅴ类,而在2007年之后水质情况得到一定程度的缓解.
2.2 沉积物理化性质变化特征
五里湖沉积物中N含量在2002和2013年时处于峰值,以2013年时为最高,而在2001和2012年时处于谷值, 以2012年时为最低. 沉积物中P含量先增加后降低,其中以2002年时为最高,1950s时最低,且在2001-2002年时高于沉积物中的N含量. 沉积物中TOC含量的变化趋势与P含量变化趋势基本一致,同样在2002年时达到最大值. 虽然2015年时沉积物中P和TOC含量相对2002年时明显降低,亦低于1990-1991年时的含量,但仍远高于1950s时的水平(表3).

表2 Spearman相关性分析结果
*表示P<0.05, **表示P<0.01.

表3 五里湖沉积物理化性质的变化

图3 近几十年来五里湖浮游植物丰度变化Fig.3 Variation of phytoplankton abundance of Lake Wuli in recent decades
2.3 浮游植物群落变化特征
在1951年时,五里湖水体中浮游植物密度仍处于较低水平,仅为2.67×105cells/L,但在1990-1991年时,浮游植物密度已增加至4.17 × 107cells/L(图3). 在2008-2012年期间,浮游植物密度出现一定程度的下降,平均为1.49 × 107cells/L. 在2014年时,浮游植物密度达到近几年的最大值7.03 × 107cells/L. 自1951年以来,五里湖浮游植物优势种也发生了变化. 在1951年时,五里湖浮游植物以硅藻门和隐藻门种类占优势. 到1990-1991年时,浮游植物以蓝藻门和绿藻门种类为主,其中又以色球藻属(Chroococcus)、微囊藻属(Microcystis)和栅列藻属(Scenedesmus)占优势,已开始出现较为严重的蓝藻水华. 在2008年之后,浮游植物又以隐藻门、绿藻门和蓝藻门种类占优势,但在夏季时,仍以蓝藻门的颤藻属(Oscillatoria)、束丝藻属(Aphanizomenon)和鱼腥藻属(Anabaena)种类为主要优势种.
2.4 底栖动物群落变化特征
近几十年来,五里湖底栖动物密度变化情况可分成4个阶段. 在1987-1992年期间,底栖动物密度较低,平均仅为789 ind./m2,在1995年时达到阶段密度峰值3860 ind./m2. 在2006年时,底栖动物密度降至1008 ind./m2,并在2007年升至阶段峰值2295 ind./m2,2009年时再次降至谷值1059 ind./m2. 2010-2013年期间,底栖动物密度均较高,平均为3151 ind./m2,在2013年时达到最大值3920 ind./m2. 2014-2017年期间,五里湖底栖动物密度一直较低,平均仅为844 ind./m2,期间在2015年时密度略高,在2017年时达到密度最小值460 ind./m2(图4).
2002年时,五里湖底栖动物生物量较高,为26.75 g/m2[19],之后显著下降,并在2008年达到生物量最小值2.32 g/m2. 在2008-2013年期间,底栖动物生物量先升高后降低,平均仅为6.97 g/m2,在2012年时达到峰值14.69 g/m2. 2014年时,底栖动物生物量突然升高,达到最大值258.3 g/m2,之后开始下降,但仍处于较高值(图4). 相关性分析结果显示,五里湖底栖动物生物量与Chl.a浓度和浮游植物丰度均呈显著正相关,相关系数均为0.83.

图4 近几十年来五里湖底栖动物密度及生物量变化Fig.4 Variation of zoobenthos density and biomass of Lake Wuli in recent decades
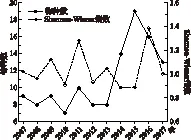
图5 近10年来五里湖底栖动物物种数及Shannon-Wiener多样性指数Fig.5 Changes in species richness and Shannon-Wiener index of macrozoobenthos in Lake Wuli in recent decade
关于20世纪五里湖中底栖动物物种数量的历史资料很少,但可以发现,1950s时,五里湖内底栖动物物种十分丰富,仅水生昆虫就有数百种,底栖动物物种多样性亦极高,但自1960s开始,底栖动物物种数量大量减少[11]. 从图5中可以看出,在2007-2013年时,底栖动物物种数量在大部分年份仅为个位数,且多样性处于较低水平. 2014年开始,底栖动物物种数量有明显的升高,在2015年时达到近几年的最大值19种,但Shannon-Wiener多样性指数在2016年时达到最大值. 从整体上看,近10年来五里湖底栖动物生物多样性在大部分年份处于一般水平(1~2),在少部分年份处于较差水平.
在1950s年时,五里湖内大型底栖动物众多,优势种密度以日本沼虾(Macrobrachiumnipponensis)为最高,其次为大型软体动物. 但从1960s开始,大型底栖动物基本消失,到1990s时,富营养化水体耐污种寡毛类和摇蚊幼虫等已成为五里湖的优势种[11]. 在之后的近20年的时间里,五里湖底栖动物在大部分年份均以霍甫水丝蚓(Limnodrilushoffmeisteri)优势度为最高,少数年份以中国长足摇蚊(Tanypuschinensis)优势度最高. 在2007-2013年和2017年期间,五里湖内底栖动物优势种均为霍甫水丝蚓和摇蚊幼虫,但在2014-2016年期间,几种大型腹足类软体动物和扁舌蛭(Glossiphoniacomplanata)亦成为优势种,特别是铜锈环棱螺(Bellamyaaeruginosa)开始出现,并在3年中均为优势种(表4).

表4 五里湖底栖动物优势种变化
3 讨论
3.1 五里湖底栖动物群落演变特征
作为典型的城市浅水湖泊,五里湖底栖动物群落在近70年来的变化与城市发展进程密切相关. 随着人类活动的加剧以及城市化进程的加快,五里湖底栖动物物种数在1960s时便开始出现下降,到1990s时大型底栖动物已基本消失[11],在21世纪初期物种数已降至个位数. 同时,底栖动物群落的优势种也发生了极大的变化,由日本沼虾和大型软体动物[12]变为耐污性强的寡毛类和摇蚊幼虫等物种. 在经过近20年的生态修复之后,五里湖底栖动物物种数量在2014年开始小幅升高,铜锈环棱螺等近10种软体动物和日本沼虾亦开始出现,但生物量和密度仍处于较低水平.
通过对五里湖1950年以来底栖动物群落结构数据的分析,并结合五里湖开发与生态修复重要时间节点,可以将五里湖底栖动物群落演变过程分为数个阶段. 第1个阶段为1960s初期以前,此阶段为人为干扰相对较少的自然演变阶段. 虽然关于1950年以前五里湖底栖动物群落结构的调查资料很少,但从文献[11-12]中对五里湖1960s初期以前底栖动物群落结构的记录可以看出,1960s初期以前,五里湖基本处于自然状态,底栖动物群落物种多样性程度极高,大型底栖动物物种丰富,优势种以日本沼虾和软体动物为主. 第2阶段为1960s末期到1980s末期,此阶段为剧烈负面人为干扰参与底栖动物群落快速退化阶段. 在此期间,围湖造田活动活跃,加之1960s末期开始全湖放养草鱼,并进行围地养殖,水质条件恶化,底栖动物生境遭到严重破坏,大型软体动物基本消失,耐污种开始成为优势种[11,22]. 第3阶段为1990s初期到21世纪初期,此阶段已开始对五里湖生态系统进行生态修复,但仍以寡毛类和摇蚊幼虫等耐污种为优势种. 在此期间,五里湖生态修复经历了局部修复、污染源控制、综合整治等数个阶段[13, 20],但其中生态清淤等措施对底栖动物群落破坏性较大,且短期内不利于大型底栖动物物种的生存,而生态修复中投放的软体动物成活率亦较低[22],所以,此阶段五里湖底栖动物群落生物多样性仍处于较低水平,优势种仍为耐污种. 第4阶段为2014年之后的底栖动物群落缓慢恢复期. 在此阶段,五里湖生态修复工程初见成效,水质和其他生境条件得到一定程度的改善[15,22,35],底栖动物生物多样性存在一定的转好趋势,几种大型软体动物物种已成为常见种,并在某些年份中占优势.
3.2 群落演变影响因素分析
通过以上对五里湖底栖动物群落演变过程的分析可以发现,在不同演变阶段,底栖动物群落结构特征形成的主要影响因素存在明显不同. 在自然演变过程中,影响底栖动物群落演变的主要因素均与生境条件密切相关,主要包括水深、溶解氧、底质类型等[36-38]. 在本研究中,虽然大部分水质与沉积物指标(除Chl.a之外)与底栖动物密度和生物量均不存在显著的相关关系,但各指标的恶化与加重亦伴随着底栖动物耐污种优势的形成.
当人为产生的负面干扰增多之后,人类活动成为影响五里湖底栖动物群落结构的主要因素,人类活动主要包括围湖造田、围地养殖、污水排入等. 人类活动的加剧,导致五里湖内底栖动物赖以生存的适宜生境被破坏,水体富营养化,蓝藻水华频发,使五里湖一度成为太湖水体富营养化最严重的水域[10]. 而水体富营养化则会导致大型底栖动物物种多样性降低,使寡毛类和摇蚊幼虫等耐污种成为绝对优势种[4]. 在本研究中,我们亦发现底栖动物生物量与Chl.a浓度和浮游植物丰度呈显著正相关关系,这也说明藻类的大量繁殖会导致五里湖内底栖动物耐污种优势度的明显增加. 同时,五里湖水体富营养过程亦伴随着沉积物中营养物质和有机碳含量的增加,这也从另一方面导致底栖动物耐污种优势的形成.
自1990s初期开始,五里湖进入生态修复阶段,生态修复措施成为影响底栖动物群落演变的主要因素. 五里湖生态修复措施主要包括污水截流、退渔还湖、生态清淤、动力换水、水生植被恢复等[13],各项措施均有利于底栖动物生境条件如水质、底质以及沉水植物覆盖度等的改善[22,39-40]. 然而,其中的部分措施亦会对底栖动物群落结构产生较为严重的破坏,如在生态清淤之后底栖动物物种密度和生物量均会明显下降[19]. 另外,在21世纪初开始向五里湖内投放螺、蚌等大型软体动物用于湖体的生态修复[8, 22],这也对五里湖内的底栖动物群落产生了较大影响. 在投放初期,湖内底栖动物生物量和密度显著升高,但在之后的调查中发现,前期投放的大量底栖动物几乎全部死亡[22]. 本研究分析结果亦发现,投放之后五里湖内底栖动物群落物种数和生物量短期内均显著升高,物种数的上升同时伴随着生物多样性指数的升高,而数年之后(2014年)物种数、生物多样性指数和生物量均出现一定程度的升高,密度则下降,说明生物投放及其他生态修复手段对五里湖底栖动物群落产生了有益的影响.
3.3 底栖动物群落修复及其应用研究展望
由于底栖动物群落结构组成与其生境状况密切相关,生境的变化会显著影响其群落组成. 另外,大量研究表明,一些大型软体动物物种可通过其摄食控制水体中着生藻类(螺类)和悬浮颗粒物(蚌类)浓度,结合水生植被修复可强化对特定水体水质的修复效果[5-6],所以,底栖动物投放已普遍应用于国内外水生态修复. 基于本论文和相关研究,提出以下建议:1)进一步加强底栖动物群落原始数据的累积,并增加数据的广度(覆盖不同生境,并增加数据采集频率);2)加强对数据的分析,筛选影响底栖动物群落组成的关键因子,并结合室内模拟实验,探索底栖动物群落演变机制;3)底栖动物在生态修复中的应用应更多地关注投放过程和投放后的长效管理,比如投放前,应充分调查投放区生境现状,对不良生境应进行适度改善,如沉水植物种植、底质改良等,待投放区生境稳定后再行投放;投放过程中,应根据投放目的和投放生物的生活史特点,选取适宜的投放物种、个体大小[6]、投放时间、投放区域以及投放方式等[41].
