局部复发性直肠癌的治疗进展
2020-05-08
有数据表明,2018年,全球结直肠癌确诊人数超过180 万例,死亡人数超过80 万例。发病率在全部肿瘤中居第3位,死亡率居第2位[1]。
局部复发性直肠癌(locally recurrent rectal cancer,LRRC)定义为直肠癌术后原发肿瘤部位或手术野范围局部再出现的和原发癌病理性质相同的肿瘤。未经治疗的LRRC 中位生存期仅10个月,直肠癌初次根治后复发几率为2.4%~10%[2]。Park 等[3]报道高达95%的复发转移在术后3年内出现,患者有局部压迫症状,会阴区、下肢疼痛,排尿困难,严重影响其生存质量。Yamada 等[4]根据手术预后分型,将复发部位分为3 种:局限型:肿瘤局限于临近盆腔器官和结缔组织;骶前型:肿瘤侵犯低位骶骨(S3、S4、S5),尾骨或骨膜;侧壁型:肿瘤侵犯坐骨神经、坐骨大孔、盆侧壁或上位骶骨(S1、S2)。另有研究报道根据症状分型:S0 为无症状,S1 为有症状但无疼痛,S2为有症状伴疼痛[5]。
目前LRRC的治疗仍以手术和外放疗为主,但许多患者因既往外放疗史或复发部位等因素难以行手术或外放疗。目前,大量新兴技术涌现,均证实对LRRC有较好的疗效。本文除总结手术和外放疗的最新进展外,对其他治疗技术也进行概述。化疗作为直肠癌综合治疗方式的一种,较少单独评估其疗效,故在此不做总结。
1 手术
大量研究证实,肿瘤完全切除(R0 切除)是影响预后的独立因素。Dresen 等[6]报道,R0 切除、不完全切除(R1切除)和残留切除(R2切除)术后3年生存率分别为58.7%、26.5%和24.1%,3年局部控制率分别为74.9%、29.2%和28.5%,组间比较存在显著性差异,而术前新辅助放化疗可提高R0 切除的几率。但有研究表明仅20%~30%的患者可行R0 手术,手术禁忌包括伴有盆腔外难以切除的转移灶,主动脉旁淋巴结累及,两侧坐骨神经累及,L5/S1以上腰椎累及等[7]。Iversen 等[8]报道侧盆壁复发的患者预后更差,原因是R0切除的几率更低。50%LRRC在诊断时已经伴有远处转移,不适宜手术切除。因此诊断LRRC时应完善全身检查,避免过度治疗[9]。有研究发现术前接受过新辅助放疗的患者相较于未接受过者更倾向于出现远处转移[10],原因可能是术前新辅助放疗加手术切除后仍复发的患者本身肿瘤恶性度相对较高,易出现复发转移;也可能是因为术前新辅助放疗限制了术后治疗方式的多种选择,从而导致远处转移。故此类患者的手术治疗应更谨慎。虽然再次手术治疗有一定效果,但由于既往手术和放疗对盆腔正常结构造成了破坏,产生纤维黏连,且肿瘤往往侵及盆腔器官,与正常组织难以区分,两次手术的难度增加。有研究报道再次手术后并发症的发生率高达51%[11],主要有伤口感染、盆腔积液、尿路感染、泌尿系损伤、肠梗阻、瘘、疝等[12]。
2 外放疗
外放疗(external beam radiotherapy,EBRT)分为姑息放疗和新辅助放疗,主要的分类依据是放疗后患者是否行R0切除。对于无远处转移或有可切除的寡转移病灶的患者可行新辅助放疗。姑息放疗的患者生存期较短,但是疼痛、直肠出血等症状可以得到缓解。Guren等[13]的报道表明,既往接受过中位剂量50.4 Gy的外放疗患者,再次接受中位总剂量为30~40 Gy的超分割放疗(1.2~1.5 Gy bid)或1.8 Gy qd的同步放化疗,结果显示新辅助放疗组(切除组)的中位生存期为39~60个月,姑息治疗组为12~16个月,两组存在显著性差异。82%~100%患者的疼痛等症状可缓解,急性不良反应主要为腹泻,报道率约9%~20%。但远期不良反应报道不足。Lee等[14]纳入17项研究的744例患者Meta分析提示,LRRC患者接受再程放疗1、2、3年生存率分别为76.1%、49.1%、38.3%。急性不良反应发生率为11.7%,远期不良反应发生率为25.5%。放疗后接受手术的患者生存率显著高于未接受手术的患者,但两组的照射野内控制率无显著差异。手术组>3级的近期和远期不良反应显著高于未接受手术组。再程外放疗治疗LRRC的回顾性研究见表1。
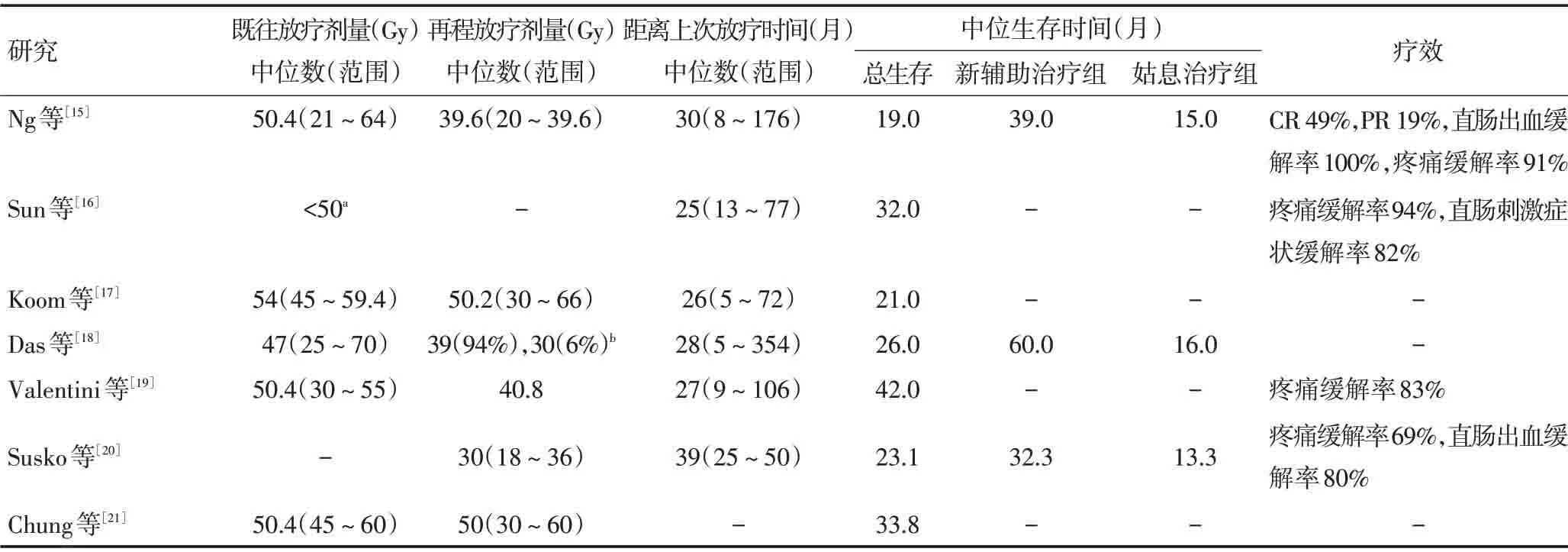
表1 再程外放疗治疗LRRC的回顾性研究
外放疗治疗中会造成小肠、直肠、膀胱的剂量累积,导致再程放疗不良反应较重,但随着外放疗技术的进步,调强放疗(intensity modulated radiation therapy,IMRT)和立体定向放疗(stereotactic body radiotherapy,SBRT)的出现,危及器官受到的照射越来越少。一些研究证实再程放疗能提高生存率和局部控制率,但伴随近期和远期不良反应,且有部分患者因不能耐受不良反应而中断或中止放疗[15-19]。Susko等[20]报道33例患者接受再程放疗,2例(6%)出现3度急性不良反应,7例(21%)出现晚期3度不良反应,手术组生存期显著长于非手术组。Chung 等[21]的研究表明,再程放疗远期不良反应发生率高,发生远期不良反应的中位时间是10.5个月,41例患者中17例发生严重的远期不良反应。目前关于远期不良反应的报道较少且均为回顾性研究,随访时间较短,鲜见报道远期不良反应的前瞻性研究,原因可能是LRRC患者的生存期较短,无法进行长期随访研究。故关于再程放疗危及器官的剂量限制不明确,放疗科医生对于再程放疗的态度较保守。快速增殖的肿瘤细胞和缓慢增殖甚至不增殖的正常组织细胞之间存在放射生物学差异。有研究报道肠发生≥2度远期不良反应的α/β值为3~5 Gy[22],使用超分割小剂量放疗能保护肠组织,降低远期不良反应。且每日2次的放疗能防止肿瘤细胞再分布,放疗间隔的6 h能确保正常组织的修复。有研究建议再程放疗处方剂量为30~40 Gy,至少与上次放疗时间间隔6个月[23]。
3 术中放疗
术中放疗(intraoperative radiotherapy,IORT)是在手术中对肿瘤直接的照射,单次剂量通常为10~20 Gy,其能提高对肿瘤的照射剂量而减少周围正常组织的照射。IORT分为3种:术中电子线放疗、术中高剂量率近距离放疗和术中I125粒子植入。I125粒子现多是经皮植入,较少术中植入,故目前的IORT主要采用前两种。
既往接受过EBRT 的患者由于危及器官的剂量限制无法耐受再程放疗,一些研究者对此类患者行单纯IORT,但疗效不佳。有研究比较单纯IORT 与IORT 联合EBRT 患者的疗效,结果显示单纯IORT组和联合组的3年局部控制率分别为0 和30%,3年生存率分别为12%和38%[24]。Bussieres 等[25]报道单纯IORT组的3年生存率和局部控制率分别为25%和0,而联合组分别为68%和61%。多项研究证实IORT联合EBRT 的生存率和局部控制率均高于单纯IORT,且不良反应在可耐受的范围内。Haddock 等[26]报道既往接受过EBRT 的患者行术前新辅助EBRT 联合IORT,同时联合5-氟尿嘧啶化疗,5年生存率为32%,显著高于单纯IORT组的22%。
IORT可作为手术切缘阳性或切缘阴性但距肿瘤<2 mm 情况下的联合治疗。R0 切除是否需联合IORT仍有争议,有研究报道R0切除联合IORT组的5年生存率与单纯R0 切除组相比无显著性差异,但局部复发风险更低[27]。
Mirnezami 等[28]纳入29项研究共3 003例患者的研究表明,IORT 显著增加伤口相关并发症的发生率。伤口感染和盆腔脓肿是最常见的伤口并发症,发生率高达25%。此外,在IORT 联合EBRT 的治疗中,周围神经损伤是常见的并发症,主要表现为不伴肌力和感觉减弱的疼痛,其发病主要与IORT 的剂量有关。Haddock 等[26]报道IORT 剂量高于12.5 Gy 时2~3级神经病变的发生率为3%,当剂量高于15 Gy时发生率为23%。
目前关于IORT 的前瞻性研究较少。单纯IORT疗效不佳,应联合术前EBRT和5-氟尿嘧啶或卡培他滨化疗[28]。
4 放射性粒子植入治疗
目前使用最多的是I125粒子,其具备半衰期短(59.6 d)、光子能量低(28 KeV)和组织穿透距离短(1.7 cm)等优点,能持续释放低剂量的X射线和γ射线,持续杀伤肿瘤细胞。放射性I125粒子植入治疗是指在影像学引导下,将有放射性的I125粒子经皮植入肿瘤组织中,利用其物理特性杀伤肿瘤细胞而不损伤周围正常组织的治疗方式。该技术无需开腹或腹腔镜,可经皮穿刺植入粒子,仅需硬膜外麻醉或局部麻醉,故患者耐受性较好。
有研究[29]对29例盆腔复发的结直肠癌患者行术中I125粒子植入术,中位最小外周剂量为140 Gy,中位局部控制时间和中位生存时间分别为11个月和18个月,4年局部控制率和生存率分别为17%和21%。总并发症发生率为45%,主要包括盆腔脓肿(14%)、瘘(10%)、盆腔疼痛(7%)和肠梗阻(3%)等。随着影像学技术的进步和三维计划系统的出现,I125粒子植入技术发展迅速,术中粒子植入被经皮粒子植入取代,疗效也得到进一步提高。张亮等[30]对21例LRRC患者行CT 引导下经皮粒子植入,76%的患者疼痛完全缓解,影像学评估病灶完全缓解(complete response,CR)率为76.2%(16/21),部分缓解(partial response,PR)率为18.8%(3/16),稳定(stable disease,SD)率为9.5%(2/21)。1例患者出现了粒子移位(4.8%)。Wang 等[31]报道15例LRRC 患者植入I125或Pd103,中位局部控制时间和中位生存时间分别为7个月和9个月。2年局部控制率和生存率分别为8.1%和10.7%。不良反应包括:瘘6.7%(1/15)、软组织纤维化26.7%(4/15)、会阴水肿6.7%(1/15)和粒子移位6.7%(1/15)等。
3D打印非共面模板的引入进一步提高了粒子植入的精准性。王皓等[32]分析了3D 模板辅助CT 引导下放射性粒子植入治疗LRRC 的术前术后剂量学参数之间的差异,统计结果显示均无显著性差异。
I125粒子植入治疗创伤小,对患者体力要求不高,对既往放疗剂量无限制,故可用于既往行手术或放疗、不能耐受再次手术或放疗的LRRC 患者治疗,但目前物理剂量和预后的关系尚不明确。
5 热疗
热疗是通过加热使肿瘤组织升温至40~44℃,从而直接杀伤肿瘤细胞或诱导其凋亡的治疗方式。热疗能刺激机体合成热休克蛋白,激活机体免疫反应,还能解除肿瘤细胞对机体免疫反应的抑制。其可改变肿瘤微环境,增加肿瘤细胞对于放化疗的敏感性,作为放化疗的辅助治疗手段能起到协同和互补的作用[33]。
Juffermans等[34]对54例不能耐受手术的LRRC患者行热疗联合再程放疗,结果显示87%的患者能完成治疗,中位无进展期为6个月,不良反应最高为2级。Milani 等[35]对24例既往接受过放疗的LRRC 患者行放疗联合热疗,同步5-氟尿嘧啶化疗,患者疼痛缓解率为70%,中位局部无进展生存时间为15个月,1、3年的生存率分别为87%、30%,12.5%的患者出现3级胃肠不良反应。吕晓涓等[33]对比研究单纯放疗与放疗联合热疗两组患者,结果显示单纯放疗组与放疗联合热疗组的症状缓解率分别为82.6%和91.3%,中位局部无进展生存期分别为14.1个月和16.3个月,两组比较有显著性差异,放疗联合热疗在不增加放疗不良反应的同时提高了疗效。金连玉等[36]的研究同样揭示了放疗联合热疗能提高疗效,同时不增加不良反应的发生率。热疗作为新辅助治疗能增加患者R0切除的几率。沈雄虎等[37]随机对比单纯放疗和放化疗联合热疗作为LRRC 的术前新辅助治疗的疗效,结果显示放化疗联合热疗组达到R0切除的比例显著高于单纯放疗组。既往接受过放疗或手术的LRRC患者盆腔组织常有纤维化,局部血液供应不佳,故而对放化疗敏感性较差,热疗能增加局部血液供应从而增加氧气和药物的灌注,进而增强放化疗的疗效。Hildebrandt等[38]对9例放疗后LRRC患者予以盆腔热疗联合奥沙利铂、亚叶酸钙和5-氟尿嘧啶化疗,结果显示6例患者得到显著的症状缓解,6例患者出现疾病进展,中位进展时间为29周。2例患者化疗后完成R0切除。热疗联合放化疗对既往接受过放疗的患者是一种有效且安全的治疗方式,能增加患者R0切除的几率。
6 射频消融
射频消融是指在超声、CT 等影像学技术的引导下,把电极插入肿瘤内部,利用高能射频产生的生物物理效应,使组织细胞温度升高最终凝固坏死从而达到治疗的目的。目前广泛应用于肝癌的治疗。
Hein 等[39]报道1例射频消融治疗的LRRC 患者,该患者在治疗后6 周疼痛显著缓解。Ohhigashi 等[40]研究表明,10例接受射频消融的LRRC患者均取得了显著的疼痛缓解,<3 cm且远离大血管的病灶疗效较好。Green等[41]报道射频消融用于治疗1例术后放疗后二次复发的患者,复发病灶约5.9 cm×2.3 cm 且侵犯盆壁,治疗后5年随访期内未再次复发,疼痛症状缓解。Mylona等[42]报道27例患者的平均简明疼痛评估量表(brief pain inventory,BPI)评分从射频消融术前的6.59 分降至1个月后的0.11 分,疼痛缓解显著。Pusceddu等[43]报道12例患者,1个月后7例患者影像学上病灶无强化,疼痛评分较术前显著降低。1例患者出现直肠脓肿,1例患者出现直肠膀胱瘘。目前射频消融主要用于姑息治疗,对于疼痛剧烈、无法手术、无法耐受放化疗的患者有显著的疼痛缓解效果。多项研究报道并发症主要包括:直肠瘘、直肠脓肿、神经痛、出血等[40-42]。射频消融用于治疗LRRC的研究较少,多是小样本、回顾性研究,仍缺乏远期局部控制和生存的研究和报道。
7 结语
LRRC的治疗目前仍是以手术和放疗为主。若患者可行R0切除术,则进行手术治疗;对于潜在可行R0切除的患者,可根据患者的耐受情况,先行新辅助放化疗后再手术。R0切除是影响预后的独立因素。随着IMRT和SBRT的出现,再程放疗的疗效被肯定,不良反应也在可接受的范围内。IORT可作为手术切除的辅助治疗,联合术前新辅助放疗能提高疗效。对不能耐受手术或放疗的患者,可行I125粒子植入治疗。热疗作为放化疗的辅助治疗,可提高疗效。射频消融目前研究较少,对于疼痛显著、难以耐受其他治疗方式的患者,是一个有效的姑息止痛手段。LRRC的治疗是需要多学科医师的共同参与的综合治疗,适当有效的治疗方式的选择仍需要更多的研究证据支持。
