DNMT1、DNMT3a在进展期直肠癌新辅助治疗中的表达及临床意义
2020-05-07高晓斌武雪亮赵轶峰聂双发刘小飞张迎春
高晓斌,武雪亮,赵轶峰,聂双发,梁 峰,刘小飞,张迎春
(1.河北北方学院附属第一医院普通外科,河北 张家口 075000;2.河北北方学院附属第一医院小儿外科,河北 张家口 075000)
有研究表明,2015年我国结直肠癌新发病例约为38.80万例,发病率位居第3,死亡例约为18.7万例,死亡率位居第5[1]。目前,手术治疗仍是治疗直肠癌的主要方法,然而,单纯依靠手术治疗往往面临术后高复发率、高转移率的问题。近年来,新辅助治疗因其降期、提高R0切除率、延长患者生存期等优势,成为进展期直肠癌的标准治疗模式[2]。新辅助治疗的评估有内镜评估、影像学评估、病理学评估等,但很大程度上依赖于直观印象和个人主观性,缺乏特异性强、准确度高的生物学标记物支持[3]。
DNA甲基转移酶(DNMTs)是人类表观遗传学中催化并维持DNA基化结构和功能的重要酶家族,内含3个重要成员:DNMT1、DNMT2和DNMT3,其中DNMT1是目前研究最为广泛也最为深入的酶类,其在DNA修复和正常甲基化功能过程中发挥关键作用;DNMT2主要负责tDNA的甲基转移;DNMT3内含3个亚基,3a、3b和3L,3a、3b与启动子区CpG岛、DNA的异常甲基化关系密切,而3L系调节蛋白[4]。研究证实,DNMT1、DNMT3a、DNMT3b的活性增强或表达上调能介导DNA异常甲基化,与人类诸多肿瘤的发生、发展密切相关[5]。有研究表明DNMT1和DNMT3a的异常表达在结直肠癌的发生、发展中发挥重要作用,二者均可作为结直肠癌早期诊断的重要潜在生物学指标。我们拟应用免疫组化法检测二者在进展期直肠癌新辅助治疗前后的表达,结合肿瘤消退学分级分析新辅助治疗对进展期直肠癌根治手术的疗效及对上述两种蛋白表达的影响,现报道如下。
1 材料与方法
1.1 一般材料
选取河北北方学院附属第一医院普通外科2017-02-2018-02月间行新辅助治疗+全直肠系膜切除术(TME)50例患者的直肠癌组织标本和临床资料,其中男31例,女19例;年龄34~71岁,平均52.5岁;CEA≤5 μg·L-133例,CEA>5 μg·L-117例;低分化9例,中分化26例,高分化15例。本研究经我院伦理委员会审核批准,患者及家属知情同意。纳入标准:①经相关检查、依据国际抗癌联盟UICC结直肠癌TNM分期系统(2018年第八版)[6]确诊为进展期直肠癌;②均为首次治疗;③对新辅助治疗有较好的依从性和耐受性。排除标准:①拒绝行新辅助治疗;②伴严重的基础病,有明显的手术禁忌症;③病例资料不完整。
1.2 方法
1.2.1 新辅助治疗
患者先行盆腔适形调强技术的术前SCRT,总放射剂量25.0 Gy,剂量分割5Gy×5次。之后行化疗治疗,Xelox方案:奥沙利铂130 mg/m2,1d;卡培他滨2 000 mg/m2,1~14 d。3周为1周期,共4周期。新辅助治疗完成后6~8周,满足手术条件后,行遵循TME原则的根治性手术治疗。
1.2.2 免疫组化检测及结果判定
癌组织标本连续切片,4 μm,贴附于经多聚赖氨酸处理的玻片上,80℃烘烤50 min,光镜下观察切片中DNMT1、DNMT3a的表达和分布情况,每张切片选取5个高倍视野(×400)。DNMT1阳性主要分布于细胞核中,而DNMT3a阳性主要分布于细胞质和细胞膜中,均呈棕黄色颗粒。判断标准:按染色强度:无着色为0分,淡黄为1分,深黄2分,棕褐或棕黄3分;阳性细胞计数:<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。两者相加<2分为阴性(-),2~3分为弱阳性(+),4~5分为中等强度阳性(++),6~7分为强阳性(+++)。由两名具备高级职称的病理医师双盲法独立评分。
1.3 观察指标
观察新辅助治疗前后DNMT1、DNMT3a表达水平,新辅助疗效评价标准采用2010年AJCC第七版推荐的TRG[7]评估方法:0级:完全退缩;1级:中等退缩;2级:轻微退缩;3级:无退缩。
1.4 统计学方法
采用SPSS 22.0进行统计学分析,DNMT1和DNMT3a的临床病理特征和免疫组化特征比较采用χ2检验,相关性分析采用Pearson’s等级相关分析,P<0.05为差异具有统计学意义。
2 结果
2.1 DNMT1和DNMT3a在进展期直肠癌组织中的表达及与病理特征之间的关系
DNMT1和DNMT3a在直肠癌组织中的阳性表达分别为84.00%和78.00%,二者均与病变的分化程度、cT分期、cN分期和cTNM分期关系密切(P<0.05),而与患者的性别、年龄、CEA、CA199无关(表1,图1A、图2A)。
2.2 DNMT1和DNMT3a在进展期直肠癌组织中的阳性表达
DNMT1和DNMT3a在新辅助治疗后直肠癌组织中的阳性表达分别为36.00%和30.00%,与治疗前相比,明显降低,差异显著(P<0.05)(图1B、图2B)。

图1 新辅助治疗前(A)、后(B)DNMT1表达情况(SP×400)
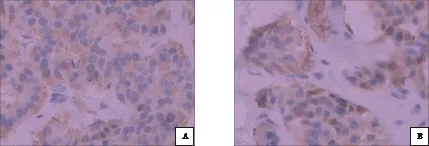
图2 新辅助治疗前(A)、后(B)DNMT3a表达情况(SP×400)
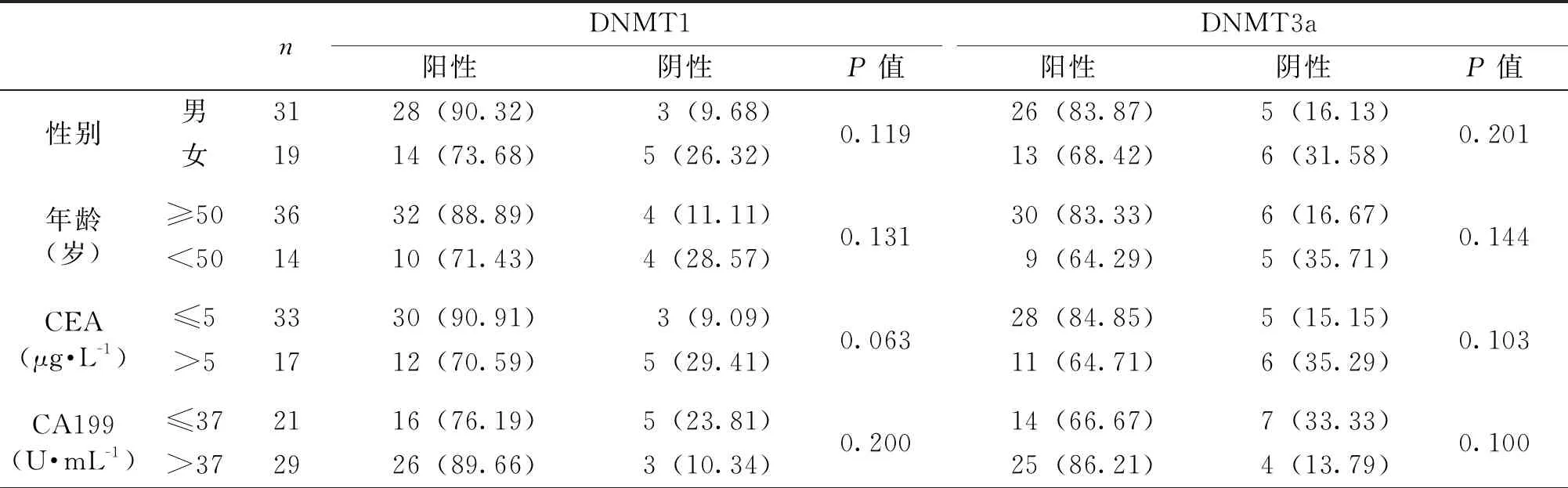
表1 新辅助治疗前DNMT1和DNMT3a阳性表达与直肠癌临床病理特征间的关系 n(%)

表1:续
2.3 直肠癌组织中DNMT1和DNMT3a表达与新辅助疗效的关系
新辅助放化疗后50例患者中,TRG分级:0级2例(4.00%),1级22例(44.00%),2级19例(38.00%),3级7例(14.00%),不同DNMT1和DNMT3a表达患者新辅助放化疗后疗效差异有统计学意义(Z=2.233、2.047,P<0.05);其中DNMT1和DNMT3a阳性表达者疗效较阴性表达者差(P<0.05)(表2)。

表2 不同疗效患者的DNMT1和DNMT3a的表达(n)
2.4 DNMT1和DNMT3a表达在直肠癌组织中的相关性
DNMT1和DNMT3a蛋白表达呈正相关(r=0.455,P=0.000)(图3)。

图3 直肠癌组织中DNMT1和DNMT3a表达相关性
3 讨 论
肿瘤的发生、发展与诸多因素相关,其中抑癌基因的失活和原癌基因的激活发挥关键作用,其病变机制涉及表观遗传学的改变:DNA甲基化、染色体重塑、组蛋白修饰和lncRNA调控[8-10],其中DNA甲基化是目前研究最为深入的机制之一。
DNMT为DNA修饰酶,具有高度保守性且在表观遗传调控中发挥着重要作用,参与细胞的增殖、分化和调控[11]。在哺乳动物细胞中鉴定出3种活性的DNMT分别为DNMT1、DNMT3a及DNMT3b,其中DNMT1主要负责复制先前存在的甲基化模式,DNMT3a和DNMT3b主要作为从头开始的甲基转移酶,负责通过在胞嘧啶上添加甲基来建立DNA甲基化模式。SARABI等[12]研究证实大肠癌细胞DNMT的表达与总体DNA甲基化水平呈正相关,其在大肠癌的发生、发展中发挥重要作用。
研究发现DNMT1不仅与胚胎发育、细胞衰老过程相关,同时在人类诸多肿瘤的发生、发展中发挥重要作用。DNMT1是DNA甲基化的关键作用酶,DNMT1活性的增加能促进DNA异常甲基化。HE等[13]应用免疫组化检测胰腺肿瘤及肿瘤旁正常组织中GLI1和DNMT的表达,发现肿瘤组织中GLI1、DNMT1和DNMT3a的阳性表达明显高于正常组织,表明上述3种因子的异常高表达与胰腺癌的发生密切相关;引入环巴胺抑制GLI1 mRNA和蛋白水平表达后,发现DNMT1和DNMT3a mRNA和蛋白水平亦随之下降,因而考虑DNMT1和DNMT3a在胰腺肿瘤中受GLI1的调控,且二者的编码基因均是其靶基因。YANG等[14]应用免疫组织化学方法检测了54例胃癌患者石蜡切片中DNMT1和DNMT3a的表达,结果显示胃癌组织中DNMT1和DNMT3a表达分别为35(64.8%)和38(70.4%)明显高于正常组织,且二者的阳性表达与TNM分期(P=0.001)和淋巴结转移(P=0.002)相关,因而预测DNMT在胃癌中存在过表达状态,且与异常启动甲基化有关。FENG等[15]应用酶联免疫吸附试验法检测136例肺癌患者和147名健康对照者中DNMT1和DNMT3a的蛋白表达,发现DNMT1和DNMT3a蛋白表达水平均显著高于正常对照组,进一步Logistic回归结果证实二者蛋白的高表达能增加肺癌发病率。
本研究应用免疫组化法检测分析以上两种蛋白在新辅助治疗前后直肠癌组织中的表达情况,结果显示DNMT1、DNMT3a的阳性表达均与病变的分化程度、临床分期有关,且二者在直肠癌组织中的表达呈正相关。HUANG等[16]应用免疫组织化学和Western印迹检测DNMT1,DNMT3a和DNMT3b在结直肠癌组织中的表达,同样发现其表达均显著上调,支持本研究结论。本研究显示二者在新辅助治疗前后在直肠癌组织中的表达水平存在明显差异,结合TGR结果,二者的表达与新辅助治疗后肿瘤消退程度关系密切,其中,DNMT1和DNMT3a阴性表达者较其阳性表达者肿瘤消退更明显,表明对于二者均为阳性的直肠肿瘤患者预后较阴性患者差。
综上,DNMT1和DNMT3a在进展期直肠癌组织中的阳性表达均与肿瘤临床病理特征相关,可作为新辅助治疗疗效和预后评估的重要分子生物学监测指标。本研究纳入样本相对较少,且为单中心研究,二者之间的具体的相互作用机制仍未阐明,需继续研究。
