丹参酮IIA调控孕烷X受体的转录因子活性诱导肝细胞癌细胞对分子靶向药物索拉非尼耐受
2020-05-07唐滋贵赵松峰王艳丽
唐滋贵, 赵松峰, 王艳丽*
(1.河南医学高等专科学校,郑州 451191;2.郑州大学第一附属医院药学部,郑州 450052)
目前,中国肝细胞癌(HCC)最为主要的危险因素(流行病学特征)是以乙型肝炎病毒(hepatitis B virus,HBV)为代表的各种肝炎病毒[1-2]。HBV等肝炎病毒能够造成患者的多种急性/慢性肝病,尽管现有抗病毒治疗-对症治疗策略取得了诸多进展,但仍有相当部分患者疾病会发生进展,最终罹患肝细胞癌[1-2]。Polaris[3]在Lancet Gastroenterol Hepatol撰文系统总结了HBV相关流行病学资料:目前中国(包括港澳台地区)有超过8 000万人感染HBV或患有HBV相关的各种慢性肝病,这使得HCC不仅严重影像患者身体健康,也是中国公共卫生系统的巨大挑战。现有HCC抗肿瘤药物治疗策略主要是以索拉非尼(Sorafenib)为代表的各类分子靶向药物(即各种口服小分子蛋白激酶抑制剂)[4],这些药物不仅治疗费用极为昂贵,也存在严重的耐药现象[5]。因此,探索HCC分子靶向药物耐药的分子机制不仅有重大的理论意义,也有助于研究和开发更为有效的HCC分子靶向治疗策略。
孕烷X受体(PXR)是一类重要的核受体,是细胞对外源性药物、毒物代谢与清除的调控枢纽[6]。Feng等[7]的研究显示,分子靶向药物索拉非尼能够作为配体或激动剂(ligand/angonist)诱导PXR的活性进而上调PXR下游耐药相关基因MDR-1以及CYP3A4的表达,最终以类似“负反馈调节”的方式最终造成HCC对其自身的耐药作用。因此,PXR是HCC分子靶向治疗耐药的重要调控枢纽[7-8]。丹参酮IIA(Tanshinone ⅡA)是丹参等重要提取所得的活性物质,被广泛应用于冠心病等心脑血管病疾病的辅助治疗等[9-11]。丹参酮IIA的抗肿瘤作用也多有报道,Chiu等[12]、Ren等[13]以及Lin等[14]表明,丹参酮IIA具有对HCC细胞的抗肿瘤活性。本研究检测了Tanshinone ⅡA对HCC细胞PXR活性的影响,发现丹参酮IIA能够调控孕烷X受体的转录因子活性诱导肝细胞癌细胞对索拉非尼耐受。
1 实验材料与仪器
抗肿瘤药物与试剂盒:丹参酮IIA单体购买自美国MCE公司(产品编号为HY-N0135);分子靶向药物索拉非尼(产品编号为S7397)、瑞戈非尼(Regorafenib/BAY 73-4506)(产品编号为S1178)、仑伐替尼(Lenvatinib/E7080)(产品编号S1164)、阿帕替尼(Apatinib)(产品编号S5248)以及安罗替尼(Anlotinib/AL3818)(产品编号为S8726)购买自美国Selleck公司;蛋白印迹实验使用的抗体包括P-糖蛋白(P-glycoprotein,P-gp)的抗体(产品编号为ab3366)、CYP3A4的抗体(产品编号为ab3572)等购买自美国Abcam公司;分子生物学研究使用的表达载体包括荧光素酶报告基因XREM-Luc、PXRE-Luc、DR3-Luc以及ER6等,PXR的表达载体以及干扰载体为中国人民解放军第三〇二医院冯帆博士惠赐[7,15];定量PCR实验(qPCR)使用的RNA提取试剂盒、反转录试剂盒以及定量PCR试剂盒均购买自美国ABI公司;细胞MTT实验使用的试剂盒购买自美国Amerresco公司;药物代谢与清除相关生化试剂如乙腈等购买自国药集团。
细胞系与细胞培养相关试剂:HEK293细胞、高侵性的HCC细胞MHCC97-H为本实验室保存;细胞培养使用的DMEM培养基、胎牛血清(FBS)、胰蛋白酶等购买自美国Thermo公司;培养细胞使用的细胞培养板购买自美国Corning公司;转染试剂脂质体购买自美国Invitrogen公司;含有PXR干扰载体的慢病毒颗粒购买自济南Vigene公司。
实验动物与动物实验器材:研究使用的胸腺缺失的裸鼠(Bal B/c品系)购买自北京斯贝福生物科技有限公司;动物实验使用的吸入麻醉机异氟烷、动物手术的器械、动物手术相关耗材(包括注射器、缝合针线、棉签、碘酒以及粘鼠板)等由本实验室保存。
实验涉及的仪器:分子生物学实验相关设备[DNA电泳仪(ABI公司)、PCR仪(ABI公司)、qPCR仪(ABI公司)]、蛋白印迹实验相关设备[SDS-PAGE电泳仪(BioRad公司)、转膜仪(BioRad公司)]、细胞培养实验相关设备[细胞培养箱(Thermo公司)、倒置显微镜(尼康公司)]、动物实验相关设备[吸入麻醉机(北京六一设备厂)、多功能酶标仪(Thermo公司)]等均由本实验室保存。
2 实验方法
2.1 药物配制
使用精密天平称取抗肿瘤药物纯品粉末,以DMSO溶解配置为药物母液,使用含有0.5%FBS的DMEM对药物母液进行稀释,配置系列浓度梯度(10、3、1、0.3、0.1、0.03、0.01 μmol/L)的抗肿瘤药物工作液(DMSO终浓度为1‰左右)。
2.2 细胞培养与MTT实验
使用含有10% FBS的DMEM培养HCC细胞,待细胞状态良好时,使用胰蛋白酶消化细胞制备细胞悬液,再将细胞悬液接种96孔细胞培养板中,每孔接种细胞8 000个,待细胞充分贴壁后以药物工作液处理细胞48 h后,按厂商说明书进行MTT实验,以490 nm波长处的吸光度值(O.D.)反映出细胞的数量。以1‰ DMSO为溶液对照,药物作用于细胞的抑制率的计算公式为
抑制率=
(1)
对于细胞实验,使用脂质体按照厂商说明书在HCC细胞中转染相应质粒;对于动物实验,MHCC97-H细胞中感染慢病毒颗粒,进行筛选获得稳定克隆后可进行动物实验。
2.3 定量PCR实验
用系列浓度梯度的丹参酮IIA处理MHCC97-H细胞24 h后,依据厂商说明书提取总RNA样品,对样品进行反转录,再进行定量PCR实验。目的基因的表达前度检测方法为SYBR Green染色2-△△CT法,以内参基因β-Actin为参比,依据定量PCR实验中各目标基因的相对表达水平。各基因定量PCR实验检测使用的引物如表1所示。

表1 qPCR (Real-time PCR)实验引物Table 1 Primers used in qPCR (Real-time PCR) experiments
2.4 蛋白印迹检测实验
用系列浓度梯度的丹参酮IIA处理MHCC97-H细胞48 h后,收集细胞,使用SDS-PAGE上样缓冲液混合细胞后以沸水浴15~20 min进行裂解,之后在12 000 r/min离心20~30 min,收集上清即为细胞中总蛋白样品。对样品进行SDS-PAGE电泳(浓缩胶为5%,分离胶为12.5%)后,将凝胶中的蛋白样品转印到PVDF膜上;使用15%的脱脂奶粉TBST溶液进行封闭,再使用抗体进行孵育。一抗(primary antibodies)的稀释倍数为P-糖蛋白(P-glycoprotein,P-gp)的抗体(1∶1 000)、CYP3A4的抗体(1∶5 000)、内参β-Actin(1∶5 000);再孵育二抗(Secondary antibody),化学发光法显色。
2.5 HCC裸鼠成瘤实验
对于皮下肿瘤模型,培养获得MHCC97-H细胞,利用生理盐水制备细胞悬液,将细胞悬液接种于裸鼠皮下,获得MHCC97-H细胞的皮下肿瘤组织。对于肝脏原位肿瘤组织,预先制备MHCC97-H细胞的肿瘤皮下肿瘤,再将皮下肿瘤组织制备为组织微块备用。以吸入麻醉的方式将裸鼠麻醉,再进行开腹手术将前述获得的组织微块接种裸鼠肝脏原位以形成裸鼠HCC的肝脏原位肿瘤模型。通过精密天平的称量保证组织微块质量的均一与一致。在前述基础上进行灌胃给药,动物给予溶液对照(生理盐水)、系列浓度梯度的丹参酮IIA、分子靶向药物索拉非尼进行治疗。动物每两天灌胃给药一次,待灌胃治疗约10次(即治疗3周左右)后,收集动物获取皮下肿瘤组织或形成肿瘤组织的肝脏脏器。对于皮下肿瘤,使用天平称重或计算肿瘤质量。皮下肿瘤体积计算公式为
肿瘤体积=肿瘤长度×肿瘤宽度×肿瘤宽度/2
(2)
使用图像分析软件Image J,按照Chen等[16]的方法进行定量分析,确定肿瘤病灶的总面积。
2.6 索拉非尼在HCC细胞中的代谢与清除检测
按照Wu等[17]和Chen等[18]的方法配置分子靶向药物索拉非尼的药物溶液,对于细胞实验,使用含有索拉非尼的培养孵育HCC细胞12 h后,换正常培养基孵育细胞,在系列时间点收集细胞样品;对于动物实验,在HCC皮下肿瘤组织中注射索拉非尼的溶液后,动物口服给予溶液对照或丹参酮IIA,在系列时间点收集肿瘤组织。使用超声破碎细胞养品、使用液氮研磨破碎肿瘤组织样品,再以有机溶剂乙腈萃取样品中的药物,按照Wu等[17]和Chen等[18]的方法进行液相色谱-质谱联用检测(LC-MS/MS)检测,确定索拉非尼在HCC细胞及肿瘤组织中的代谢与清除情况。
2.7 统计学分析
结果显示为均值±标准差以表明生物学重复和结果偏差;使用SPSS 17.0版本的统计分析软件进行t-检验或单因素方差分析;使用Origin 8.0版本软件计算药物作用的半数作用浓度以及药物代谢与清除的半衰期;P<0.05显示组间差异具有统计学显著性。
3 研究结果
(1)丹参酮IIA能够剂量依赖地诱导PXR的转录因子活性,结果如表2所示,丹参酮IIA处理HCC细胞,能够剂量依赖地上调PXR转录因子活性报告基因XREM-Luc、PXRE-Luc、DR3-Luc以及ER6-Luc的活性。进一步检测了PXR下游耐药相关基因MDR-1和CYP3A4的mRNA与蛋白表达水平。结果如图1和图2所示,丹参酮IIA能够剂量依赖地诱导PXR下游基因MDR-1、CYP3A4的mRNA表达水平(图1);诱导MDR-1、CYP3A4的蛋白表达水平(图2)。
(2)丹参酮IIA能够诱导细胞对分子靶向药物索拉非尼的耐受。首先确定了丹参酮IIA的作用浓度,结果如图3所示,丹参酮IIA能够剂量依赖地杀伤HCC细胞系,其中30 μmol/L以及10 μmol/L剂量的丹参酮IIA具有一定的抗肿瘤作用;为此结合前述结果(图1、图2),选取3 μmol/L剂量(该剂量下,丹参酮IIA自身无显著细胞毒性,并能够显著诱导PXR下游基因MDR-1、CYP3A4的表达水平)进行进一步实验。进一步结果显示(表3),3 μmol/L剂量的丹参酮IIA处理HCC细胞能够上调索拉非尼作用于HCC细胞的半数抑制浓度(IC50)诱导细胞对索拉非尼的耐受。除分子靶向药物索拉非尼外,3 μmol/L剂量的丹参酮IIA也能够诱导HCC细胞对其他分子靶向药物,如瑞戈非尼、阿帕替尼、安罗替尼以及仑伐替尼等的耐受作用。

表2 丹参酮IIA对PXR转录因子活性的EC50Table 2 The EC50 values of tanshinone IIA on PXR’s transcription factor activation
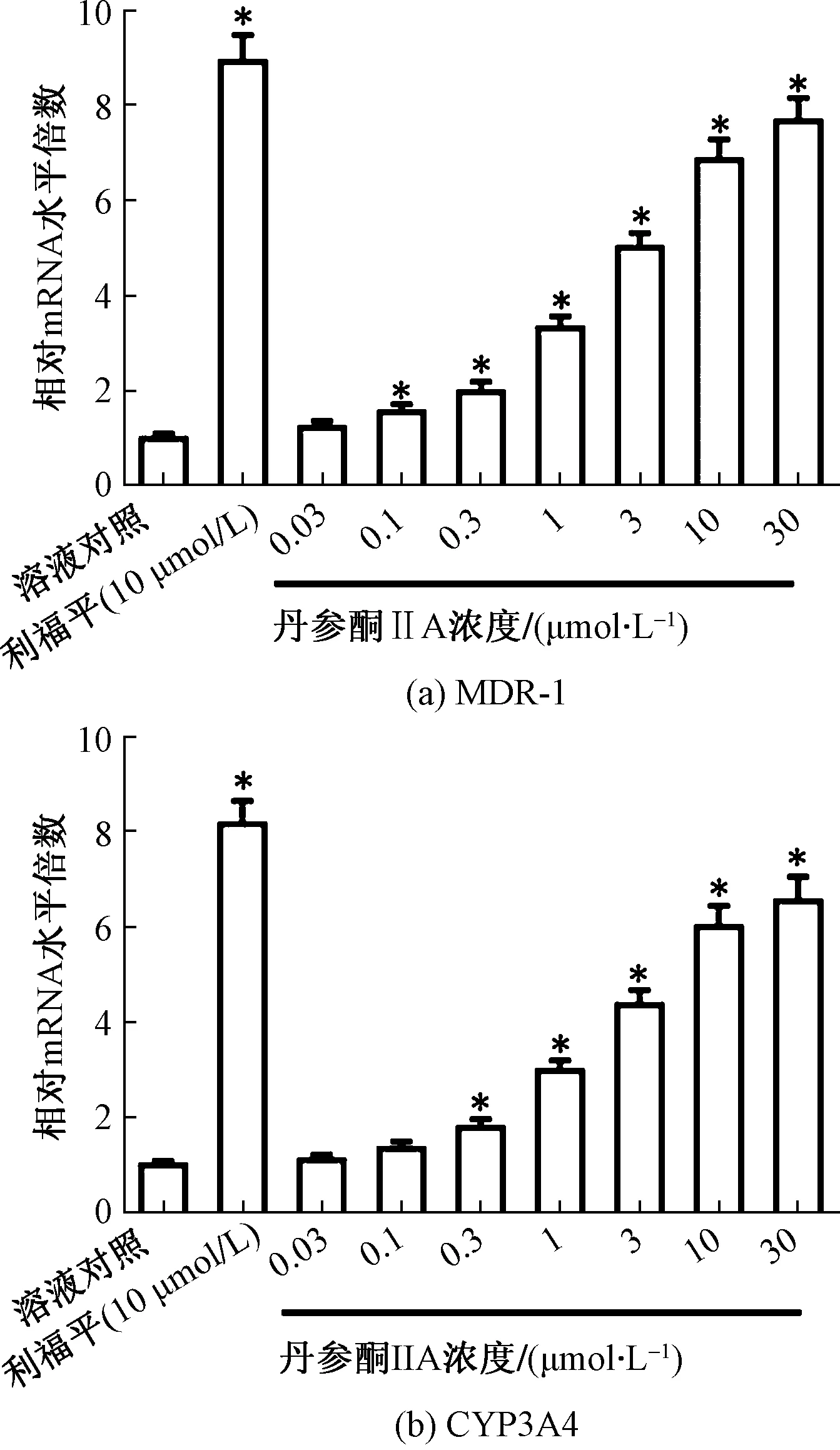
用一定浓度丹参酮IIA处理MHCC97-H细胞24 h。然后,收集细胞进行qPCR实验。MDR-1或CYP3A4 mRNA水平为平均值±SD。丹参酮IIA治疗组与溶液对照组比较,*P<0.05图1 丹参酮IIA诱导两种PXR下游基因的mRNA水平Fig.1 Tanshinone IIA induced the mRNA level of two PXR’s downstream genes
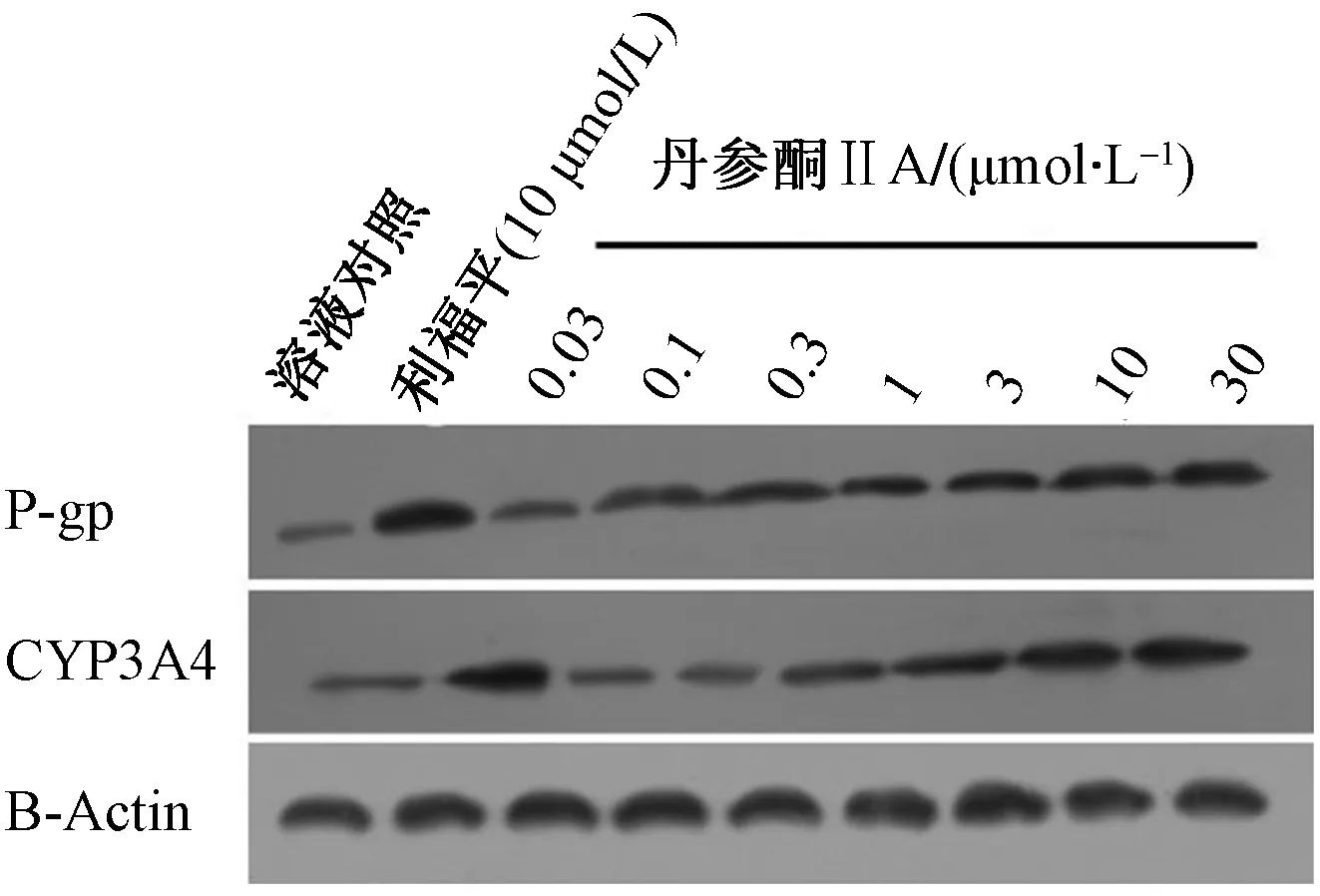
用一定浓度丹参酮IIA处理MHCC97-H细胞24 h。然后,收集细胞进行western blot实验。用抗体检测P-gp或CYP3A4蛋白水平,并进行比较。β-Actin被选作内参(参比)图2 丹参酮IIA诱导两种PXR下游基因的蛋白表达Fig.2 Tanshinone IIA induced the protein level of two PXR’s downstream genes
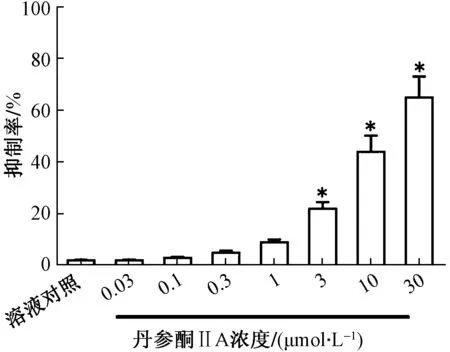
用一定浓度丹参酮IIA处理MHCC97-H细胞48 h。然后,收集细胞进行MTT实验。丹参酮IIA对MHCC97-H细胞存活率的影响以通过O.D. 490nm算得抑制率的平均值±SD表示。丹参酮IIA治疗组与溶液对照组比较,*P<0.05图3 丹参酮IIA抑制MHCC97-H细胞存活Fig.3 Tanshinone IIA inhibited the survival of MHCC97-H cells

表3 丹参酮IIA诱导MHCC97-H细胞对分子靶向药物耐受Table 3 Tanshinone IIA induced the resistance of MHCC97-H cells to molecular targeted agents

将MHCC97-H细胞注射入裸鼠体内形成皮下肿瘤,口服丹参酮IIA给药,收集肿瘤,结果显示肿瘤组织照片、肿瘤体积或肿瘤质量,*P<0.05图4 丹参酮IIA抑制MHCC97-H细胞皮下成瘤Fig.4 Tanshinone IIA inhibited the subcutaneous growth of MHCC97-H cells

将MHCC97-H细胞注射入裸鼠体内形成皮下肿瘤,口服丹参酮IIA给药,收集肿瘤进行qPCR实验。MDR-1或CYP3A4 mRNA水平为平均值±SD。丹参酮IIA治疗组与溶液对照组比较,*P<0.05图5 丹参酮IIA诱导皮下肿瘤中MDR-1或CYP3A4表达Fig.5 Tanshinone IIA induced the mRNA level of MDR-1 or CYP3A4 in subcutaneous tumors
进一步在裸鼠成瘤模型中检测了丹参酮IIA对分子靶向药物杀伤HCC细胞的影响。使用MHCC97-H细胞系接种裸鼠皮下部位(Subcutaneous position)形成皮下肿瘤,给予裸鼠系列浓度梯度的丹参酮IIA,结果如图4所示,仅有较高剂量的丹参酮IIA(10 mg/kg以及5 mg/kg)具有一定的抗肿瘤活性,而较低剂量的丹参酮IIA(1 mg/kg以及2 mg/kg)即能够诱导肿瘤组织中耐药基因MDR-1以及CYP3A4的表达(图5),为此选取较低剂量的丹参酮IIA(2 mg/kg剂量,即其自身无明显细胞毒性即能够诱导耐药基因表达)进行后续实验。在此基础上,2 mg/kg剂量的丹参酮IIA能够下调分子靶向药物索拉非尼对MHCC97-H细胞在裸鼠中的皮下成瘤(图6)以及肝脏原位成瘤(图7)作用,上调MHCC97-H细胞对索拉非尼的耐受作用。

将转染对照siRNA或PXR siRNA (siPXR)的MHCC97-H细胞注入裸鼠体内,形成皮下肿瘤,口服丹参酮IIA(2 mg/kg)、索拉非尼(2 mg/kg)或丹参酮IIA (2 mg/kg) +索拉非尼(2 mg/kg),收集皮下肿瘤组织,结果显示为肿瘤组织照片、肿瘤体积或肿瘤质量,*P<0.05图6 丹参酮IIA抑制索拉非尼的抗肿瘤作用Fig.6 Tanshinone IIA decreased the antitumor effect of sorafenib

将转染对照或PXR siRNA (siPXR)的MHCC97-H细胞注射至肿瘤裸鼠肝脏原位,口服丹参酮IIA (2 mg/kg)、索拉非尼(2 mg/kg)或丹参酮IIA (2 mg/kg) +索拉非尼(2 mg/kg),收集有肿瘤组织的裸鼠肝脏脏器,结果显示为肝脏脏器照片、肿瘤病灶的相对面积,*P<0.05图7 丹参酮IIA降低索拉非尼对MHCC97-H细胞在裸鼠肝脏原位生长的抗肿瘤作用Fig.7 Tanshinone IIA decreased the antitumor effect of sorafenib on the intahepatic growth of MHCC97-H cells
(3)丹参酮IIA诱导细胞对索拉非尼耐受的机制研究。首先确定了丹参酮IIA诱导耐药基因表达的特异性,结果如图8所示,丹参酮IIA诱导CYP3A4的mRNA、蛋白表达是依赖于PXR的(图8):使用PXR的小干扰RNA(PXR的siRNA)在HCC细胞中敲低PXR的表达,此时丹参酮IIA不再能诱导PXR下游耐药相关基因的表达作用;在此基础上,检测了丹参酮IIA诱导HCC细胞对分子靶向药物耐受的特异性,结果如表4所示,在HCC细胞中转染PXR的干扰载体能够阻断丹参酮IIA诱导HCC细胞对分子靶向药物的耐受作用;丹参酮IIA单独作用不能影响索拉非尼对HEK293细胞的杀伤作用,而在HEK293细胞中转染PXR的表达载体后再使用丹参酮IIA处理细胞,此时丹参酮IIA能够诱导细胞对索拉非尼的耐受作用(表4)。
单纯检测丹参酮IIA诱导耐药相关基因的表达不能充分反映出丹参酮IIA的作用机制,进一步检测了索拉非尼在HCC细胞中的代谢与清除作用,结果如表5所示。丹参酮IIA处理HCC细胞能够加速分子靶向药物在HCC细胞中的代谢与清除作用,缩短索拉非尼在HCC细胞中的半衰期;在肿瘤组织中注射索拉非尼溶液后,再对动物灌胃给予丹参酮IIA能够加速分子靶向药物在HCC肿瘤组织中的代谢与清除作用,缩短索拉非尼在HCC肿瘤组织中的半衰期(表5)。这表明,丹参酮IIA能够通过诱导PXR的转录因子活性诱导PXR下游耐药相关基因的表达,最终通过加速索拉非尼在HCC细胞中的代谢与清除作用造成HCC细胞对索拉非尼的耐药。
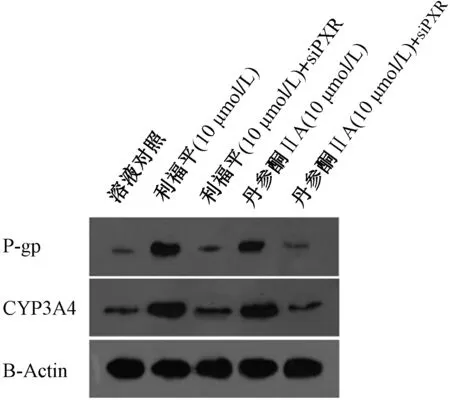
用对照或PXR siRNA (siPXR)转染MHCC97-H细胞,然后,用10 μmol/L利福平(用作阳性对照)或10 μmol/L丹参酮IIA处理细胞,收集细胞进行western blot实验。用抗体检测CYP3A4或P-gp蛋白水平,并进行检测。β-Actin被选为内参(参比)图8 丹参酮IIA通过PXR诱导P-gp或CYP3A4表达Fig.8 Tanshinone IIA indcued the expression of P-gp or CYP3A4 via PXR

表4 丹参酮IIA通过PXR诱导MHCC97-H细胞对索拉非耐受Table 4 Tanshinone IIA induced the resistance of MHCC97-H cells to Sorafenib via PXR

表5 丹参酮IIA通过PXR促进MHCC97-H细胞中索拉非尼的清除Table 5 Tanshinone IIA accelerated the clearance of Sorafenib in MHCC97-H cells via PXR
4 讨论
受到临床诊疗现状等的限制,目前大多数HCC患者初诊即为进展期(Advanced HCC),总体愈后很差[19]。分子靶向药物是进展期HCC的主要治疗策略,但索拉非尼已在临床广泛应用,其治疗效果不能令人满意存在明确的药物耐受[5]。因此,阐明分子靶向药物耐药的分子机制具有重要意义。早期的研究主要关注于PXR在药物代谢等领域的功能与调控机制,最近的研究表明PXR能够作为HCC细胞对分子靶向药物耐药的调控枢纽[6]。诱导PXR的转录因子活性能够上调MDR-1等耐药基因的表达,最终造成药物耐受。本研究使用高侵袭性的MHCC97-H细胞为研究模型以更好地模拟进展期HCC,丹参酮IIA能够诱导PXR的转录因子活性,实现HCC细胞对分子靶向药物的耐受作用。较高剂量的丹参酮IIA具有一定的抗肿瘤活性,但不具备抗肿瘤活性剂量的丹参酮IIA即能够诱导PXR的转录因子活性。丹参酮IIA多种是心脑血管疾病的常用辅助治疗药物,研究的结果不仅有助于拓展对丹参酮IIA参与调控的药物相互作用的认识,也增进了对丹参酮IIA调节HCC分子靶向治疗耐受的认识。
另一方面,肝脏是人体对内源性/外源性有毒/有害物质代谢与清除的主要脏器,HCC作为肝细胞来源的恶性肿瘤,HCC细胞能够通过对索拉非尼等药物的代谢与清除作用保护自身免遭药物的杀伤,最终造成药物耐受。PXR下游耐药基因相关基因,在药物代谢研究领域是药物代谢酶类,如CYP3A4是I相代谢酶,而MDR-1编码的P糖蛋白是III相代谢酶[5,8];这些基因在抗肿瘤耐药等研究领域则能够作为各种耐药基因诱导抗肿瘤药物耐药。本研究的结果不仅检测了丹参酮IIA诱导这些耐药基因的表达,还利用检测了丹参酮IIA对索拉非尼在HCC细胞以及肿瘤组织中半衰期的影响。未来将建立其他分子靶向药物的LC-MS/MS方法学体系,确定丹参酮IIA是否能够加速其他分子靶向药物在HCC细胞或肿瘤组织中的代谢与清除作用。
现已证实,进展期HCC具有对细胞毒性化疗药物多药耐药(MDR)的特性,因此分子靶向治疗对进展期HCC抗肿瘤药物治疗具有重要意义。早期,进展期HCC分子靶向治疗药物仅有索拉非尼一种。最近,仑伐替尼被批准上市成为I线治疗药物[20]、瑞戈非尼[4]被批准上市作为II线治疗药物进入进展期HCC临床诊疗。这些药物应用时间较短,随着时间推移也可能会有耐药的报道。上述3种药物都是国外厂商研发的。除此之外,中国厂商也研发出了同类药物,例如江苏恒瑞医药股份有限公司的阿帕替尼已有对HCC抗肿瘤治疗的报道[21-22],江苏正大天晴公司的安罗替尼作用机制与上述药物类似[23],未来也有希望应用于HCC临床治疗。为此,本研究也选取了阿帕替尼和安罗替尼等进行了检测,不仅有助于深入了解这两种药物的抗肿瘤作用,也有助于研究和开发具有自主知识产权的药物。
5 结论
(1)丹参酮IIA能够剂量依赖地诱导PXR的转录因子活性。
(2)丹参酮IIA能够诱导细胞对分子靶向药物索拉非尼的耐受。
(3)丹参酮IIA调控孕烷X受体的转录因子活性诱导肝细胞癌细胞对索拉非尼耐受。
