老年尿毒症感染尿道致病性大肠埃希菌药敏分析及毒力基因分布研究
2020-05-06马银丽蒋银杨丹
马银丽 蒋银 杨丹
[摘要] 目的 研究临床老年尿毒症患者分离的尿道致病性大肠埃希菌(UPEC)的毒力基因分布情况及耐药特征,为老年尿毒症患者UPEC尿路感染的治疗提供临床研究资料。 方法 采用法国梅里埃生物VitekⅡ系统鉴定2016年1月~2019年1月我院非植入导尿管老年尿毒症患者所分离117株UPEC,并行药敏试验,根据药敏试验结果分为对照组52株,多重耐药组65株。多重PCR检测两组菌株粘附因子、铁载体相关因子、保护性物质及毒素等毒力基因分布情况。 结果 美罗培南、亚胺培南、阿米卡星、呋喃妥因对大肠埃希菌均较为敏感;对照组及多重耐药组中fimH、feoB检出较高均在70%以上,经χ2检验分析,对照组与多重耐药组毒力基因sfa、afa、iha有统计学差异(P<0.05)。 结论 sfa、afa、iha均为粘附因子家族基因,可能与大肠埃希菌的耐药有关。
[关键词] 老年尿毒症;尿道致病性大肠埃希菌;毒力基因;耐药;粘附素
[中图分类号] R691.3 [文献标识码] B [文章编号] 1673-9701(2020)06-0104-04
[Abstract] Objective To study the distribution of virulence genes and drug resistance characteristics of urethral pathogenic Escherichia coli (UPEC) isolated from clinical elderly uremia patients, and to provide clinical research data for the treatment of UPEC urinary tract infections in elderly patients with uremia. Methods The French Merrier Biotek Ⅱ system was used to identify 117 UPECs isolated from elderly uremia patients with non-implantable urinary catheters in our hospital from January 2016 to January 2019. Parallel sensitivity testing was performed. According to the drug sensitivity test results, they were divided into 52 strains in the control group and 65 strains in the multi-drug resistance group. Multiplex PCR was used to detect the distribution of virulence genes such as adhesion factors, iron carrier-related factors, protective substances and virulence gene in two groups. Results Meropenem,imipenem,amikacin,and furantoin were more sensitive to Escherichia coli. In the control group and the multi-drug resistance group, the detection of fimH and feoB was higher than 70%. Chi-square test analysis showed that the virulence genes sfa, afa, and iha in the control group and the multidrug resistance group were statistically different(P<0.05). Conclusion Sfa, afa, and iha are genes of adhesion factor family that may be related to drug resistance of Escherichia coli.
[Key words] Senile uremia; Urethral pathogenic Escherichia coli; Virulence gene; Drug resistance; Adhesion
在感染性疾病中,尿路感染(Urinary tract infections,UTIS)的發病率仅次于呼吸道感染,一直居高不下[1]。老年尿毒症患者因长期接受各种肾替代治疗,自身免疫力低下,为感染发生的高危人群。尿路感染在老年尿毒症患者较为常见。临床研究发现[2],尿道致病性大肠埃希菌(Uropathogenic ecoli,UPEC)为泌尿系感染分离的最主要病原菌,尿道致病性大肠埃希菌毒力因子的存在与毒力的强弱也决定了所致疾病的严重程度。其中尿道致病性大肠埃希菌毒力因子中的菌毛及粘附素在泌尿系感染细菌粘附定植中发挥了关键的作用。目前,对UPEC毒力因子基因分布研究为泌尿系感染研究的热点课题。本研究主要探讨在老年尿毒症患者分离的不同耐药程度尿道致病性大肠埃希菌的毒力基因分布情况以及耐药与细菌粘附功能关系,为老年尿毒症患者尿道致病性大肠埃希菌尿路感染的治疗提供临床研究资料,现报道如下。
1 资料与方法
1.1 菌株来源
菌株来源于2016年1月~2019年1月我院非植入导尿管老年尿毒症患者所分离117株大肠埃希菌,门诊患者分离26株,住院患者分离91株,同一患者同类标本同一时期分离到的同种菌株不重复计入。同时患者尿常规满足每高倍镜白细胞>5个,尿培养菌落计数>105 CFU/mL。
1.2 方法
1.2.1 细菌培养鉴定药敏 取受试者中段尿接种于中国蓝琼脂平板及羊血琼脂平板(上海祥和科学技术有限公司产品)行37℃细菌培养24 h,采用法国梅里埃生物VitekⅡ系统对菌株进行鉴定,配套革兰阴性杆菌药敏卡进行药敏试验,结果判读参照2016年美国临床实验室标准化协会(CLSI)标准[3]。质控标准菌株:大肠埃希菌ATCC25922,并根据药敏结果将117株大肠埃希菌分为对照组52株,多重耐药组65株,分组依据:耐药组对3类或3类以上抗生素耐药,其他设为对照组。
1.2.2 PCR法检测UPEC毒力基因 采用煮沸法提取UPEC DNA,试验菌株接种于5 mL营养肉汤,37℃培养6 h,10 000 rpm离心弃上清,加1 mL生理盐水震荡10 000 rpm离心其上清,于沉淀加100 μL蒸馏水震荡后置于100℃水浴10 min,10 000 rpm离心5 min,上清即为扩增模板DNA。引物设计及合成由华大基因生物有限公司完成,反应体系50 μL,包括10×PCR buffer 5.0 μL、Tap酶聚合酶0.5 μL、2.5 mmol/L dNTP mixture2.5 μL、上游引物、下游引物各1 μL、ddH2O 34.0 μL、DNA模板2.0 μL。见表1。
扩增条件:预变性95℃ 12 min→变性94℃ 30 s→退火63℃ 30 s→延伸68℃ 3 min,共25循环,产物分析采用含0.5 μg/mL的溴乙锭的2%的琼脂糖凝胶电泳法,采用凝胶成像系统紫外线下观察结果,以与阳性对照分子相等位置的目的条带为阳性,结果经重复实验确证。
1.3 观察指标
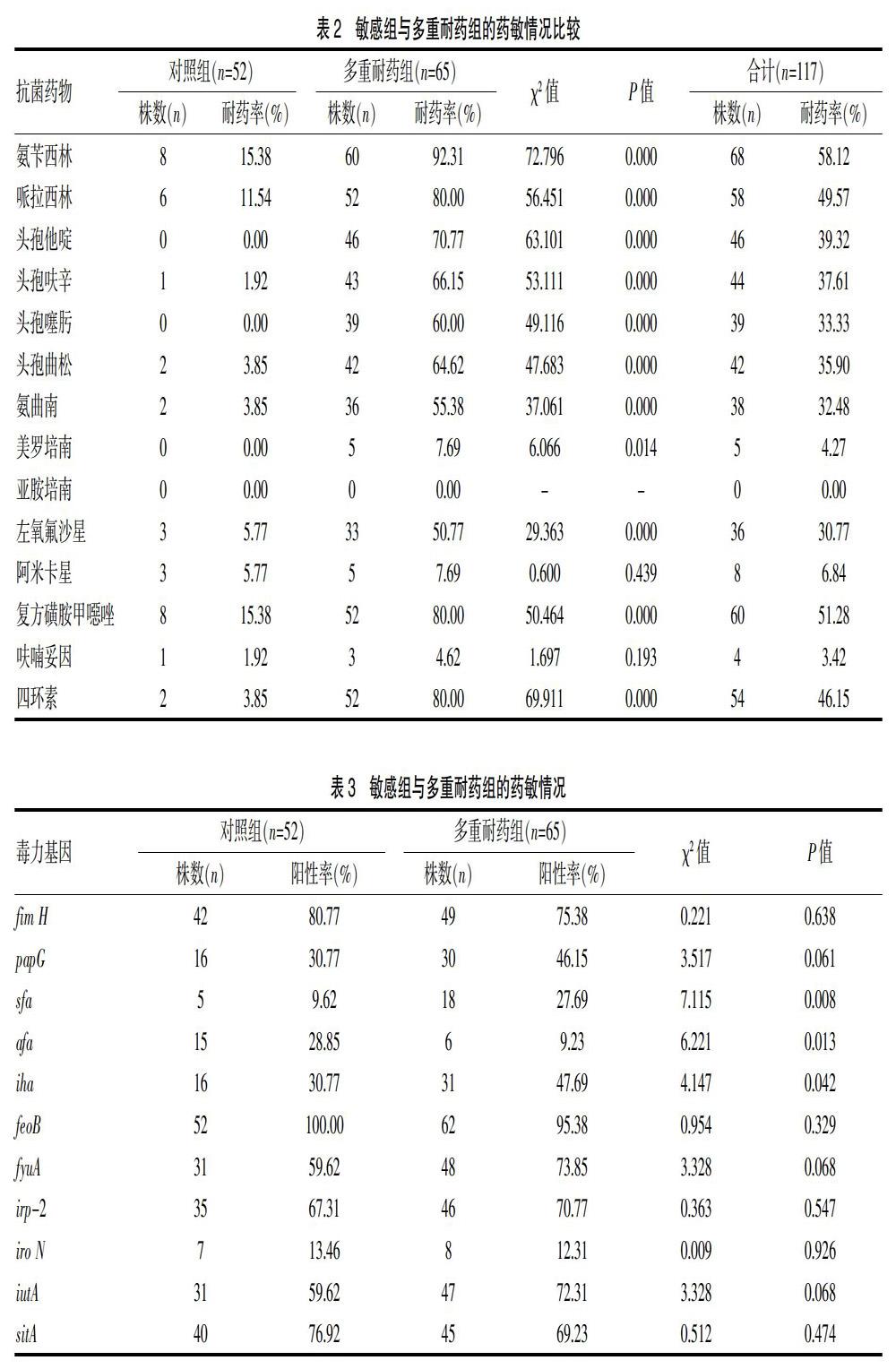
纳入监测抗生素种类:氨苄西林、哌拉西林、头孢他啶、头孢呋辛、头孢噻肟、头孢曲松、氨曲南、美罗培南、亚胺培南、左氧氟沙星、阿米卡星、复方磺胺甲噁唑、四环素、呋喃妥因。
尿道致病性大肠埃希菌含多种毒力基因,纳入研究毒力基因种类包括:A:粘附因子类基因:Ⅰ型菌毛(fim H)、P菌毛(papG)、S菌毛(sfa)、FIC菌毛(focG)Dr粘附素(afa)、其他粘附因子(iha)。B:铁载体相关基因feoB、fyuA、irp-2、iro N、iutA、sitA。C:保护类物质及毒素:cnf-1、hlyD. ksp MT。
1.4 统计学处理
采用统计学软件SPSS22.0对研究数据进行分析处理,敏感组及耐药组毒力基因检出率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 对照组与多重耐药组的药敏情况
美罗培南、亚胺培南、阿米卡星、呋喃妥因对大肠埃希菌均较为敏感,对照组与多重耐药组的耐药情况详见表1。经χ2检验分析对照组与多重耐药组在氨苄西林、哌拉西林、头孢他啶、头孢呋辛、头孢噻肟、头孢曲松、氨曲南、美罗培南、左氧氟沙星、复方磺胺甲噁唑、四环素耐药率均有统计学差异(P<0.05)。见表2。
2.2 对照组与多重耐药组毒力基因分布比较
对照组及多重耐药组中fim H、feoB检出较高均在70%以上,经χ2检验分析,对照组与多重耐药组毒力基因sfa、afa、iha有统计学差异(P<0.05)。见表3。
3 讨论
随着我国进入老年化社会,尿毒症的发病率日益增多[4],多种因素引起的免疫力下降导致尿毒症患者成为感染易发的高危人群[5]。尿路感染可激增患者原发疾病的严重程度,造成患者预后不良。尿路感染的预防及控制对于老年尿毒症的临床疗效以及生活质量的提高具有重要的临床意义。本研究样本均来源于老年尿毒症患者的中段尿培养,据研究报道[6]:临床50%~95%的无症状尿路感染均由尿道致病性大肠埃希菌所引起,其中上行性感染及胞内感染(细菌侵入尿道上皮增殖形成胞内细菌群落并在特定条件下形成的感染)为大肠埃希菌发生泌尿系感染的主要途径[7],评价细菌的致病能力强弱的指标为细菌毒力[8]。其主要包括细菌侵袭力与细菌毒素,诸如细菌的粘附结构纤毛、外膜、水解酶、及毒性代谢产物脂多糖、蛋白等均与细菌毒力强弱相关。大肠埃希菌包含众多的毒力因子,有临床研究显示[9]:部分毒力因子基因与细菌的耐药性关系密切。大肠埃希菌毒力因子基因携带的检测对于临床诊断、抗生素的选择以及预后评估均有重要的临床意义。
本研究以细菌的耐药性为分组依据,数据显示:多重耐药组大肠埃希菌仅对美罗培南、亚胺培南、阿米卡星以及呋喃妥因敏感,而对临床大肠埃希菌所致尿路感染的传统用药头孢类、喹诺酮类抗菌药物耐药情况均较为严重,多数耐药率均超过70%。尿道致病性大肠埃希菌有一系列特异性的毒力因子,毒力基因携带的不同与细菌导致疾病的严重程度以及耐药情况关系密切[10-11]。feoB、fim H、irp-2、iutA、sitA在本项研究中的检出率较高,均超过60%。fim H为Ⅰ型菌毛的粘附蛋白,其特异性受体可定植于尿路上皮细胞,尤其膀胱上皮,研究人员推测其与膀胱炎的发病有关[12]。而papG为P型菌毛的粘附蛋白,分布于肾小管、集合管上皮细胞,研究证明与急性肾盂肾炎关系密切[13]。Sfa、afa、iha均为粘附因子家族基因,有研究人员认为[14-16]:泌尿系感染的迁延难愈及反复感染与粘附因子家族關系密切,粘附因子作为大肠埃希菌最强的毒力因子近年引起了临床研究者的广泛关注,粘附因子介导大肠埃希菌在尿路定植,并帮助细菌形成细菌库逃避机体的免疫攻击及抗菌药物的杀菌作用[17]。本研究数据显示:Sfa、afa、iha的检出率在对照组与多重耐药组存在统计学差异,数据说明,Sfa、afa、iha与大肠埃希菌的多重耐药有关。携带Sfa、afa、iha基因的菌株,其编码的粘附蛋白及侵袭蛋白可识别特异性受体对宿主进行粘附、侵入,增强菌株对药物的耐药性以及对宿主免疫攻击的抵抗力[18]。其具体的耐药机制有待进一步深入研究。国外有研究认为[19]:afa基因与复发性尿路感染有关。feoB、fyuA、irp-2、iro N、iutA、sitA为铁摄取系统独立基因,其在对照组与多重耐药组的检出率并无统计学差异,fyuA位于HPI核心功能区边缘,在细菌水平转移过程中易发生突变[20]。
综上所述,尿毒症患者为感染的高发人群,尤其多见于尿路感染,尿道致病性大肠埃希菌也是引起感染的主要菌株,其毒力基因与菌株的致病性相关,Sfa、afa、iha均为粘附因子家族基因可能大肠埃希菌的耐药有关,研究毒力基因对尿毒症患者尿道致病性大肠埃希菌感染的防治有重要的临床意义。
[参考文献]
[1] 余玮,孙攀,马飞飞.上海市嘉定区检出首例肠出血性大肠杆菌O157:H7[J].世界临床医学,2019,13(2):129-130.
[2] 王栋,王少辉,张焕容,等.双组分系统rcsC基因影响禽致病性大肠杆菌的致病性及相关生物学特性[J].微生物学报,2019,59(3):468-477.
[3] 朱旭慧,周俞,侯红艳,等.急性腹泻患儿致泻性大肠埃希菌流行病学研究和耐药性分析[J].中华检验医学杂志,2019,42(3):214-218.
[4] 王晓,王清海,岳怡明,等.肾移植后尿路大肠杆菌感染特征及毒力因子的检测[J].中华器官移植杂志,2017, 38(1):11-14.
[5] 李柏胜,谢兰丰,刘岩红,等.肝硬化自发性细菌性腹膜炎患者粪便大肠杆菌毒力基因Colv和腹水细菌分布的相关性[J].肝脏,2017,22(5):424-426.
[6] 高清清,邵启文,叶正琴,等.尿道致病性大肠杆菌U17株rstA缺失株降低对小鼠的致病性[J].微生物学报,2018,58(3):501-510.
[7] 胡彬,寇增强,邵纯纯,等.山东省动物粪便中非O157产志贺毒素大肠埃希菌菌株特征及耐药性分析[J].中华预防医学杂志,2018,52(3):271-276.
[8] 闫李侠,黄至澄,徐黔宁,等.实时荧光多重聚合酶链反应-高分辨率溶解曲线分析鉴别6种致腹泻性大肠埃希菌的研究[J].浙江医学,2018,40(6):577-581,599.
[9] 孙智勇,周志江,邓旭明.中国鹿源致病性大肠杆菌的分离鉴定及毒力基因分析[J].解放军预防医学杂志,2017, 35(4):306-309,313.
[10] 庄源,罗嘉远,陈涌,等.上海地区2015-2018年产毒性大肠埃希菌毒力基因及定植因子携带特征分析[J].上海预防医学,2019,31(7):601-606.
[11] 张宇曦,韩先干,左佳坤,等.禽致病性大肠杆菌脂多糖核心型分布与毒力基因的相关性分析[J].微生物学通报,2015,42(8):1619-1625.
[12] 熊长辉,杨梦,刘晓青,等.婴幼儿致病性大肠埃希菌的毒力基因检测研究[J].中华医院感染学杂志,2014,24(1):9-11.
[13] 何冬梅,梁宇恒,柯碧霞,等.2013-2016年广东省腹泻患者致泻性大肠埃希菌病原学监测[J].中华微生物学和免疫学杂志,2018,38(5):345-353.
[14] 金法祥,俞建洪,糜祖煌.大肠埃希菌老年患者分离株β-内酰胺酶基因与毒力基因研究[J].中华医院感染学杂志,2009,19(4):374-376.
[15] 刘双庆,李娟,陈妍妍,等.肠外致病性大肠埃希菌毒力与耐药的相关性分析[J].天津医科大学学报,2017,23(4):349-353.
[16] 许元元,沈瀚,张之烽,等.产CTX-M-14和CTX-M-15大肠埃希菌毒力基因分布差异[J].临床检验杂志,2016, 34(9):710-713.
[17] 余斐,王若南,陈晓,等.浙江省腹泻患者致泻性大肠埃希菌血清型分布及其鉴定效率的评价[J].中华流行病学杂志,2017,38(6):800-804.
[18] 郑洁,曹小利,张之烽,等.尿路感染B2-ST131大肠埃希菌菌株毒力和耐药性分析[J].临床检验杂志,2016, 34(10):798-800.
[19] Park SH,Byun JH,Choi SM,et al. Molecular epidemiology of extended-spectrum beta-lactamase producing Escherichia coli in the community and hospital in Korea:Emergence of ST131 producing CTX-M-15[J]. BMC Infect,2012,12(6):149.
[20] 陳菲,曹小利,程莉,等.尿培养产CTX-M大肠埃希菌的种系分型及耐药和毒力特点分析[J].现代检验医学杂志,2016,31(2):12-19.
(收稿日期:2019-10-29)
