双歧杆菌三联活菌散联合乳果糖治疗婴幼儿功能性便秘临床疗效观察
2020-05-06闵燕华眭颖尹燕
闵燕华 眭颖 尹燕
[摘要] 目的 探讨双歧杆菌三联活菌散联合乳果糖治疗婴幼儿功能性便秘的临床疗效。 方法 将我院2018年3月~2019年3月收治的90例功能性便秘患儿随机分成观察组和对照组两组,每组各45例。对照组进行基础治疗,观察组在基础治疗上,加用双歧杆菌三联活菌散联合乳果糖治疗,对比两组临床疗效。 结果 观察组显效率、总有效率均明显高于对照组(P<0.05),且未见明显不良反应。 结论 双歧杆菌三联活菌散联合乳果糖治疗儿童功能性便秘疗效显著,未见不良反应,值得临床推广。
[关键词] 婴幼儿功能性便秘;双歧杆菌三联活菌散;乳果糖
[Abstract] Objective To investigate the clinical efficacy of bifidobacterium triple viable powder combined with lactulose in the treatment of functional constipation in infants and children. Methods 90 children patients with functional constipation who were admitted to our hospital from March 2018 to March 2019 were randomly divided into observation group and control group, with 45 cases in each group. The control group was given basic treatment, and the observation group was given bifidobacterium triple viable powder combined with lactulose on the basis of the basic treatment. The clinical efficacy was compared between the two groups. Results The significant effective rate and total effective rate in the observation group were significantly higher than those in the control group(P<0.05), and no obvious adverse reactions were observed. Conclusion Bifidobacterium triple viable powder combined with lactulose has a significant curative effect in the treatment of pediatric functional constipation, with no observed adverse reactions, which is worthy of clinical promotion.
[Key words] Functional constipation in infants and children; Bifidobacteria triple viable powder; Lactulose
便秘是婴幼儿期最常见的疾病之一,人群发病率为3%~8%,占胃肠门诊就诊患者的20%~25%[1-2],其中功能性便秘(functional constipation,FC)占大多数。若未给予及时的治疗,不仅影响患儿的身心健康,而且影响其远期生活质量[3]。FC的发生机制复杂,多认为与胃肠道动力异常、肠道菌群失调、心理社会因素、药物不良反应、肠神经递质水平异常和内脏感觉神经异常等因素相关[4]。目前尚无理想的治疗手段,临床常采用调整膳食结构,纠正饮食习惯,训练良好的排便习惯,每天进行适量运动等基础治疗,疗效一般。我院门诊自2018年3月~2019年3月采用在基础治疗上,加用双歧杆菌三联活菌散联合乳果糖治療婴幼儿功能性便秘,疗效满意,未见不良反应,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年3月~2019年3月我院门诊诊治的功能性便秘患儿90例,男49例,女41例,年龄4个月~4岁,平均年龄(2.16±0.54)岁。纳入标准:所有病例均符合最新的功能性便秘的罗马Ⅳ诊断标准[5-6],具体如下:(1)每周排便次数不超过2次;(2)有大量粪便潴留病史;(3)有排便费力和排便疼痛史;(4)排粗大粪便史;(5)有大量的粪便团块存在直肠内;(6)能自己控制排便后,每周大便失禁≥1次;(7)粪便曾堵塞过马桶管道。4岁以下婴幼儿至少出现以上症状中的2条,病程达1个月。排除标准:药物、器质性病变导致的便秘;或合并其他内科疾病。将其随机分为两组:观察组45例,对照组45例。两组在年龄、性别、病情程度等比较均无显著性差异(P均>0.05)。
1.2 治疗方法
对照组进行常规治疗,观察组在常规治疗基础上,加用双歧杆菌三联活菌散联合乳果糖治疗。
对照组:(1)训练患儿养成良好的排便习惯,每天起床后坐便盆或者端便,时间限制为3~10 min,排便过程中注意放松精神;(2)注意患儿均衡饮食,摄入含有丰富纤维素的食物,防止长时间食用高蛋白、细粮等食物;(3)每天进行适量活动。
观察组:与对照组进行同样的基础治疗,并予口服双歧杆菌三联活菌散(生产厂家:上海信谊药厂有限公司;规格:每袋含药粉1 g,含活菌数分别应不低于1.0×107 CFU;批准文号:国药准字S10970105),0~1岁:一次半袋;1~4岁:一次1袋;一日3次。口服乳果糖(生产厂家:Abbott Biologicals B.V.;规格:667 mg/mL;批准文号:进口药品注册证书 H20171057),0~1岁:一次5 mL;1~4岁:一次5~10 mL;一日1次。两组均连续治疗8 周。
1.3 疗效评定标准[7]
显效:患儿排便l~2次/d,排便困难症状如排便费力、哭闹、烦躁等消失,大便为软便;好转:患者排便每1~2日1次,排便困难症状如排便费力、哭闹、烦躁等較前改善,大便较为干燥;无效:患者治疗前后对比,排便次数、排便困难程度、大便形状等未改善。总有效率=(显效+好转)/总例数×100%。
1.4 统计学方法
采用SPSS19.0 统计学软件对数据结果进行分析。计数资料以[n(%)]表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
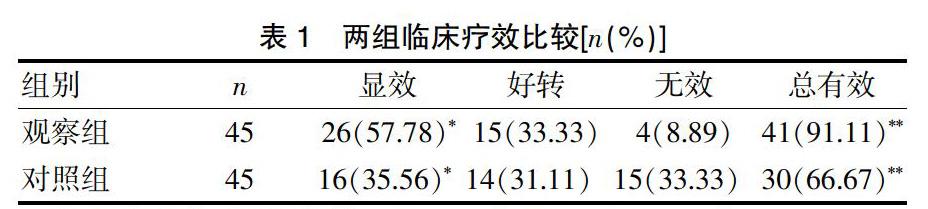
观察组显效26例占57.78%,好转15例占33.33%,无效4例占8.89%,总有效率91.11%(41/45)。对照组显效16例占35.56%,好转14例占31.11%,无效15例占33.33%,总有效率66.67%(30/45)。观察组显效率、总有效率均优于对照组(P<0.05)(表1)。
2.2 不良反应
两组患儿均未出现明显不良反应。其中观察组1例患儿出现腹胀,未予特殊处理,2~3 d 后症状缓解。1例患儿出现稀糊样大便,双歧杆菌三联活菌散和乳果糖剂量均减半后好转。
3 讨论
排便是人体排出未被吸收的食物残渣的途径,排便顺畅是保证人体健康的基础,排便次数减少、粪便干结等易对人体造成危害。功能性便秘与肠道菌群失调、肠功能紊乱等有关,致使患儿肠道pH值升高,肠蠕动减慢。近年来,我国婴幼儿膳食发生了巨大变化,蛋白质含量高,碳水化合物比例降低,饮水不足、肠道正常菌群失调及肠动力障碍等因素导致婴幼儿患功能性便秘的人数越来越多,已成为儿科门诊常见病之一。治疗上只采用加强排便训练、饮食调节、保证足量饮水、指导适量运动等基础疗法,治疗时间较长,依从性比较差,不能长期坚持,疗效并不理想。
肠道菌群的改变可引起婴幼儿肠功能及神经系统的变化[8],若不及时给予有效的治疗,对患儿的胃肠道功能、生长发育及智力发展等均会造成不同程度的影响,甚至可引起遗尿、便失禁等症状[9]。研究发现,肠道微生物及其代谢产物对肠道的运动和吸收都有重要的调节作用[10-11]。Sahakian等[12]及Attaluri等[13]的研究均表明肠道菌群的甲烷排泄会减慢肠道蠕动的速度。肠道内存在多种微生物,以细菌为主,种类超过1000种,总数达100万亿。大多数为绝对厌氧菌,如拟杆菌属、双歧杆菌属、乳杆菌属、消化链球菌属、真杆菌属、瘤胃球菌属、普氏菌属等[14]。Arumugam等[15]指出,人体肠道内的优势菌群存在一定的宿主特异性,可分为拟杆菌型、瘤胃球菌型、普雷奥菌型三种肠型。饮食、环境、基因等均可影响肠道细菌的构成[16]。运用最新的高通量技术如宏基因组测序,发现肠道菌群的构成与人体健康密切相关[17]。各种原因引起的功能性便秘者肠道内菌群失调,肠黏膜屏障破坏,抑制结肠蠕动和吸收而导致便秘,肠道微生态失调参与了便秘的产生或加重过程。张树成等[18]通过对功能性便秘及健康儿童的肠道菌群PCR-SSCP和BOX-PCR指纹图谱分析,发现健康肠道的优势菌属主要为拟杆菌属、埃希氏菌属、双歧杆菌属和乳杆菌属,而便秘者肠道优势菌属主要为脆埃希氏菌属、弱拟杆菌属、梭菌属和真杆菌属。
临床上,功能性便秘的治疗手段多样,主要包括恢复肠道正常运转与排空、通便、调节粪便质地及去除病因等,分为基础治疗和药物治疗,临床上根据患儿的不同情况,选择合适的治疗方案尤为重要[19-20]。益生菌是足量摄入后对宿主有益的微生物,具有与肠道内致病菌竞争、调节肠道黏液分泌、增强肠道黏膜屏障功能及免疫调节等作用。常用于治疗便秘的益生菌有长双歧杆菌、鼠李糖乳杆菌、动物双歧杆菌乳酸亚种、嗜酸乳杆菌、干酪乳杆菌代田株、嗜热链球菌等。Ford等[21]对2个随机对照研究进行Meta分析显示服用益生菌的患者每周排便次数较基线增加1.49次(95%CI:1.02~1.96)。Waitzberg等[22]研究发现,功能性便秘患者服用合生元制剂(内含双歧杆菌、乳杆菌和低聚果糖)1个月后,每周排便次数增加且粪便形状评分下降,效果明显。李豪等[23]研究发现双歧杆菌三联活菌制剂与常规药物联用可提高功能性便秘的总体疗效,并可有效降低功能性便秘的复发率。
双歧杆菌三联活菌散包含长型双歧杆菌、嗜酸乳杆菌及粪肠球菌,可迅速补充对人体有益的细菌,调节肠道菌群,抑制肠道内对人体有害的菌类,且可恢复患儿肠道运动功能,增强其新陈代谢,改善肠道内微生态系统,从而达到迅速缓解便秘症状的目的。研究发现,渗透性通便剂对于规律性排便的维持有重要意义[24]。乳果糖为人工合成的二糖,属于渗透性通便剂,利用二糖的渗透性,使肠道内水、电解质处于高渗状态,保留水分,口服后以原形进入结肠,被肠道菌群分解代谢产生有机酸,使肠道内的pH值降低,粪便体积增加,刺激肠道蠕动,保持排便顺畅,恢复肠道正常的生理规律[25-26]。同时,乳果糖还是一种益生元,其在体内经分解代谢产生的代谢产物能够促进肠道有益菌的增殖,并抑制如拟杆菌、梭状芽孢菌等有害菌,有助于改善功能性便秘患儿肠道内菌群失调状况。乳果糖与双歧杆菌三联活菌散联合使用,效果更佳。乳果糖进入人体后需要被结肠内的细菌分解产生有机酸,而结肠细菌群可通过补充正常生理菌丛产生,促进乳果糖充分分解,发挥生理作用,乳果糖的渗透性能够促进粪便排出。所以两者联合使用疗效更佳。
本研究90例功能性便秘患儿中,对照组45例进行基础治疗,观察组45例在基础治疗的基础上,加用双歧杆菌三联活菌散联合乳果糖口服治疗。观察组显效率57.78%,总有效率91.11%;对照组显效率35.56%,总有效率66.67%。观察组显效率、总有效率均明显高于对照组(P<0.05)。两组患儿在治疗过程中均未出现不良反应,提示双歧杆菌三联活菌散联合乳果糖治疗婴幼儿功能性便秘安全性非常高。
综上所述,双歧杆菌三联活菌散联合乳果糖治疗儿童功能性便秘疗效显著,未见不良反应,值得临床推广。
[参考文献]
[1] Loening-thucke V.Prevalence,symptoms and outcome of constipation in infants and toddler[J].J Pediatr,2005,146(3):359-363.
[2] 中华医学会小儿外科分会肛肠外科学组.儿童功能性便秘诊断标准与治疗流程[J].中华小儿外科杂志,2011, 32(8):629-630.
[3] 眭颖,林梅芳.米雅治疗婴儿功能性便秘的疗效观察[J].中国现代医生,2017,55(22):63-66.
[4] 张大强.酪酸梭菌活菌散联合乳果糖治疗小儿功能性便秘的临床疗效[J].临床合理用药,2018,11(3C):50-51.
[5] Koppen IJ,Nurko S,Saps M,et al.The pediatric RomeⅣ criteria:whats new?[J].Expert Rev Gastroenterol Hepatol, 2017,11(3):193-201.
[6] 铂亮,曲书强.儿童功能性便秘的研究现状[J].中华实用儿科临床杂志,2017,32(7):554-556.
[7] 杨艳君.布拉酵母菌联合乳果糖对儿童功能性便秘患者血清脑肠肽的调节作用[J].中国微生态学杂志,2018, 30(4):441-447.
[8] 何旭霞,李景南. 肠道菌群对脑-肠轴和功能性消化不良的影响[J].胃肠病学,2018,23(10):622-625.
[9] Ludvigsson JF.Abis Study Group:Epidemiological study of constipation and other gastrointestinal symptoms in 8000 children[J].Acta Paediatr,2006,95(5):573-580.
[10] Hwang L,Low K,Khoshini R,et al.Evaluating breath methane as a diagnostic test for constipation-predominant IBS[J].Dig Dis Sci,2010,55(2):398-403.
[11] 徐娜娜,范文廷,毕茹茹,等.功能性便秘患者肠道菌群分析及肠道菌群调节作用的研究进展[J].临床检验杂志,2018,36(1):34-36.
[12] Sahakian AB,Jee SR,Pimentel M.Methane and the gastrointestinal tract[J].Dig Dis Sci,2010,55(8):2135-2143.
[13] Attaluri A,Jackson M,Valestin J,et al.Methanogenic flora is associated with altered colonic transit but not stool characteristics in constipation without IBS[J].Am J Gastroenterol,2010,105(6):1407-1411.
[14] Paasché S. Fecal microbiota transplantation:an innovative approach to treating Clostridium difcile disease[J].Jaapa,2013,26(8):46-49.
[15] Arumugam M,Raes J,Pelletier E,et al.Enterotypes of the human gut microbiom[J].Nature,2011,473(7346):174-180.
[16] Karadsheh Z,Sule S.Fecal transplantation for the treatment of recurrent clostridium diffcile infection[J].N Am J Med Sci,2013,5(6):339-343.
[17] Knaapen M,Kootte RS,Zoetendal EG,et al.Obesity,nonalcoholic fatty liver disease, and atherothrombosis:a role for the intestinal microbiota[J]. Clin Microbiol Infect,2013,19(4):331-337.
[18] 張树成,王维林,高红等.功能性便秘儿童肠道菌群DNA的PCR-SSCP和BOX-PCR指纹图谱分析及临床意义[J].中华小儿外科杂志,2009,30(12):845-846.
[19] Mare AB,DaVid CAC,Jan AT.New treatment options in childhood constipation[J].J Pediatr Gasmtroenterol Nut,2005,41:556-557.
[20] 张洁,闫坤龙,金玉.儿童功能性便秘的治疗现状和进展[J].国际儿科学杂志,2019,46(3):170-173.
[21] Ford AC,Quigley EM,Lacy BE,et al.Efficacy of prebiotics,probiotics,and synbiotics in irritable bowel syndrome and chronic idiopathic constipation:systematic review and meta-analysis[J].Am J Gastroenterol,2014,109(10):1547-1561.
[22] Waitzberg DL,Logullo LC,Bittencourt AF,et al.Effect of symbiotic in constipated adult women-a randomized,double-blind,placebo-controlled study of clinical response[J].Clin Nutr,2013,32(1):27-33.
[23] 李豪,杨永志,袁耀宗,等.双歧杆菌三联活菌制剂治疗功能性便秘临床疗效Meta分[J].中国微生态学杂志,2016,36(8):724-728.
[24] 翁剑锋,邱啸臣,李元新.功能性便秘的治疗进展[J].中国临床研究,2016,29(3):409-412.
[25] 王红.乳果糖口服液治疗小儿功能性便秘的临床疗效和安全性分析[J].现代实用医学,2016,28(11):1462-1463.
[26] 罗真东,梁鉴坤,王哲,等.小麦纤维素联合乳果糖治疗儿童功能性便秘的临床观察[J].中国现代医学杂志,2018, 28(36):96-99.
(收稿日期:2019-06-11)
