玉米ZmMYB59基因启动子的克隆及功能分析
2020-05-04叶浩田郑美霞孙彩霞赵光武
叶浩田 郑美霞 孙彩霞 赵光武
(浙江农林大学 农业与食品科学学院/浙江省农产品品质改良技术研究重点实验室,浙江 临安 311300)
MYB 转录因子参与植物的生长发育、激素信号转导、代谢产物的合成及逆境胁迫应答反应[1-4]。前期研究发现,MYB家族基因在玉米种子顶土萌发过程中受深播和GA大量诱导,是表达基因数最多的转录因子家族,其中ZmMYB59基因表达下调倍数最高[5]。因此,预测该基因可能抑制玉米种子顶土萌发的能力。
启动子是基因转录的调控中心[6],不仅拥有CAAT-box、TATA-box等基本作用原件,还存在某些响应逆境胁迫的顺式作用元件,所以基因表达调控研究的基础是启动子的功能分析[7]。研究ZmMYB59基因启动子的顺式作用元件既可从分子水平探讨与种子顶土萌发性状相关基因表达的机制,又可通过构建该启动子和GUS的融合基因,在水稻中研究该启动子在根、茎和叶中的表达[8]。目前与玉米种子顶土能力相关的关键基因的研究尚未见报道,本研究对玉米ZmMYB59基因启动子序列进行有目的的缺失,应用PCR 技术分别克隆ZmMYB59基因启动子的不同片段,分别连接GUS报告基因,通过农杆菌介导法转化到水稻中,检测水稻根、茎和叶中的GUS活性来初步确定启动子的功能区域[9],旨在阐明ZmMYB59基因启动子的功能及其作用方式,以期为玉米遗传改良提供新的策略和理论依据。
1 材料与方法
1.1 试验材料
ZmMYB59基因启动子克隆所使用的植物材料为玉米自交系‘B73’,种子由本实验室扩繁后,-4 ℃保存备用,遗传转化使用水稻材料是‘日本晴’。
pMD18-T克隆载体、ExTaq、T4连接酶、dNTP混合物、DL10 000TM DNA marker均购自Takara公司,DNA凝胶回收试剂盒、质粒DNA提取试剂盒、100%的乙醇、氯仿和异丙醇等其他试剂购自上海生工生物工程股份有限公司,PCR引物合成和DNA序列测定由上海擎科生物科技有限公司完成[10]。
1.2 ZmMYB59基因启动子的克隆及序列分析
通过CTAB法从玉米自交系‘B73’幼苗组织中提取基因组DNA[11],利用primer 5.0软件设计引物(MYB59-P-1-F: ATACATGGTTTGTGATT-CTGAAT;MYB59-P-1-R: GTTACTACCACAC-TAACGTTG;MYB59-P-2-F: CACAATGTGGA-CTGCAGCAC;MYB59-P-2-R: GTTACTACCA-CACTAACGTTG)。
以玉米基因组DNA为模板PCR扩增启动子序列,20 μL PCR反应体系为:PCR预混液10 μL、10 μmol/L 上下游引物各1 μL、基因组DNA 1 μL、ddH2O 7 μL;PCR反应程序:95 ℃ 5 min;之后95 ℃ 30 s、55 ℃ 30 s、72 ℃ 1.5 min,共35个循环;最后72 ℃ 10 min。PCR扩增产物经检测并回收目的片段,目的片段和pMD18-T载体重组并转化大肠杆菌DH5α,经检测为阳性克隆的菌液送上海擎科生物科技有限公司测序。使用PlantCARE(http:∥www.plantcare.co.uk/)软件对ZmMYB59基因起始密码子前2 000 bp的序列进行分析, 把ZmMYB59基因的2个启动子片段分别命名为MYB59-P-1,MYB59-P-2。
1.3 pCXGUS-MYB-1K和pCXGUS-MYB-2K植物表达载体的构建
将目的基因与pCXGUS-P载体连接,获得重组质粒分别命名为pCXGUS-MYB-1K, pCXGUS-MYB-2K(图1)。挑出重组质粒,转化农杆菌EHA105感受态细胞。参照苏军等[12]的方法转化水稻‘日本晴’(图2)。
1.4 转pCXGUS-MYB-1K和pCXGUS-MYB-2K基因水稻阳性植株的鉴定
获得转基因苗后进行PCR分子鉴定:以转基因水稻叶片DNA为模板,利用启动子pCXGUS-MYB-1K、pCXGUS-MYB-2K上游引物及GUS下游引物5’GTTGCCCGCTTCGAAACCAATG 3’进行PCR。反应程序是95 ℃ 5 min;之后95 ℃ 30 s、55 ℃ 30 s;72 ℃ (1 kb/90 s、2 kb/150 s)共30个循环;最后72 ℃ 10 min[13]。1.0%琼脂糖凝胶电泳检测PCR产物[14]。
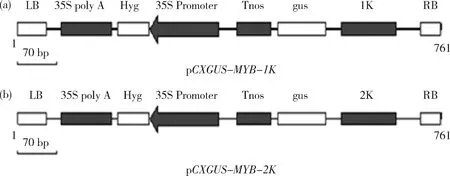
图1 启动子片段pCXGUS-MYB-1K(a)和pCXGUS-MYB-2K(b)的载体构建图

(a)为诱导第7天;(b)为愈伤继代培养;(c)为农杆菌EHA105与目的基因共培养2 d;(d)为筛选第21天;(e)为分化第25天;(f)为28~30 ℃生根培养。
1.5 转基因水稻GUS组织化学染色
分别取T1代转基因阳性水稻的种子,T1代转基因阳性水稻的萌发期水稻幼苗和苗期的根、茎和叶,参照Jefferson等[15]的方法进行GUS染色,照相并记录。
2 结果与分析
2.1 ZmMYB59基因启动子片段的克隆
图3可知,3、4、5号样品获得1 000 bp的条带,为启动子MYB59-P-1片段,但1、2号样品未扩增出启动子片段MYB59-P-1(图3(a));6~10号均扩增出2 000 bp片段的条带,为启动子MYB59-P-2片段(图3(b))。
分别选择5号和10号扩增片段测序后,采用DNAMAN 6.0软件(http:∥xiazai.zol.com.cn/detail/38/374365.shtml)进行比对分析,结果表明,5号和10号与MYB59-P-1和MYB59-P-2的序列完全一致。
2.2 启动子MYB59-P-1和MYB59-P-2的生物信息学分析
表1可知,除与启动子MYB59-P-1和MYB59-P-2基本活性相关的TATA Box和CAAT Box以外,还存在许多与激素响应相关的元件,如响应ABA信号的ABRE元件;响应水杨酸信号的TCA-element元件;响应赤霉素的作用元件GARE-motif和P-box元件;与茉莉酸甲酯信号途径相关的TGACG-motif元件;参与抗病和胁迫调节的TC-rich repeats元件;与分生组织特异性激活相关的GCN4-motif元件;参与玉米醇溶蛋白代谢调控的O2-site元件;与分生组织表达相关的CAT-box元件;参与热应激反应的HSE元件。此外,还发现1个受干旱诱导的 MYB 结合位点的MBS元件。
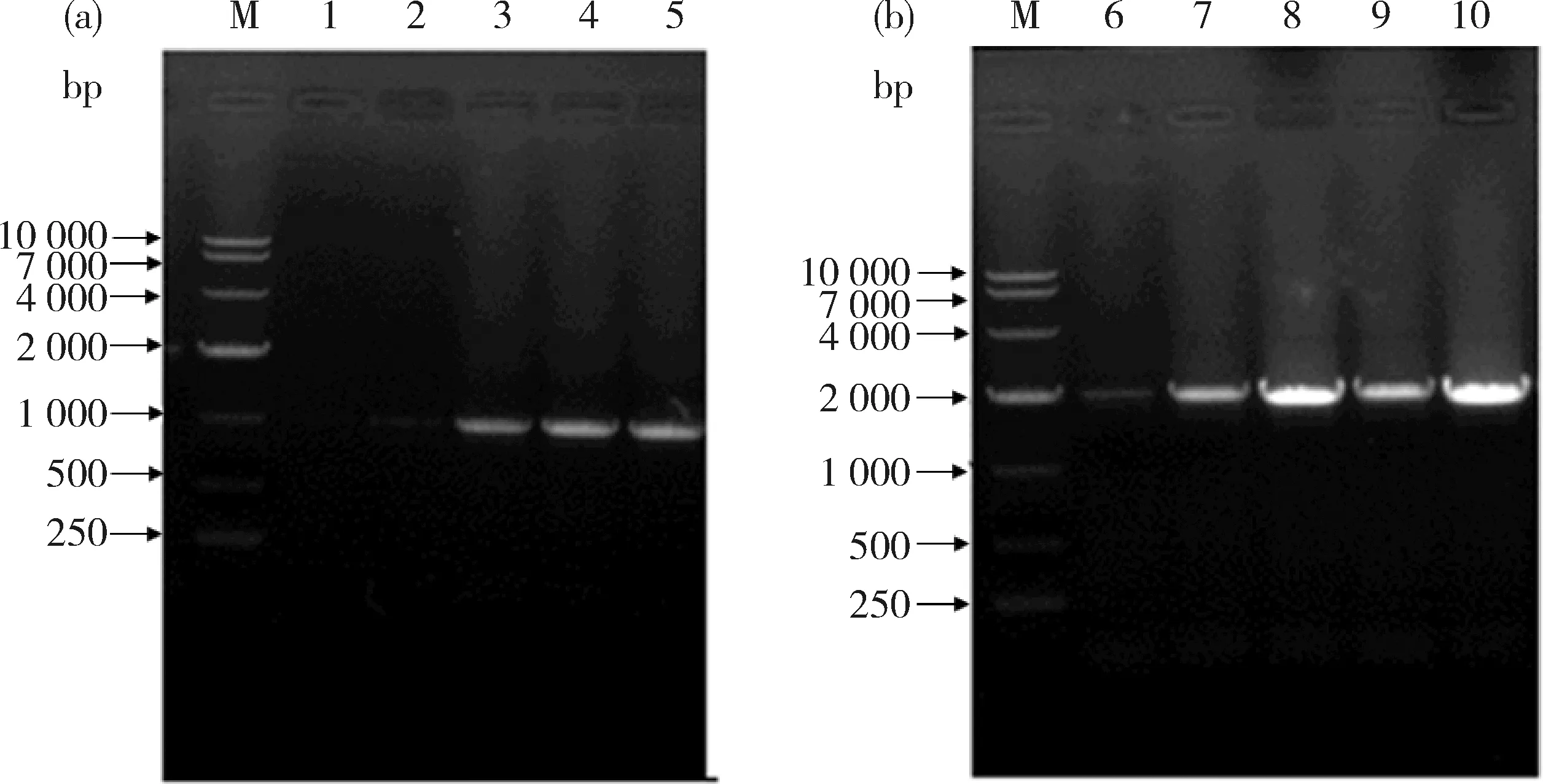
M,DL10 000分子量标准;1~5,MYB59-P-1片段;6~10,MYB59-P-2片段。

表1 启动子MYB59-P-1和MYB59-P-2中存在的顺式作用元件
2.3 转pCXGUS-MYB-1K、pCXGUS-MYB-2K基因水稻的阳性鉴定结果
图4可知,转基因水稻幼苗和表达载体pCXGUS-MYB-1K、pCXGUS-MYB-2K质粒均能扩增到目标条带MYB59-P-1和MYB59-P-2,而野生型水稻幼苗没有扩增到目标条带。结果表明,ZmMYB59基因起始密码子上游1 000和2 000 bp已整合到转基因水稻基因组中。
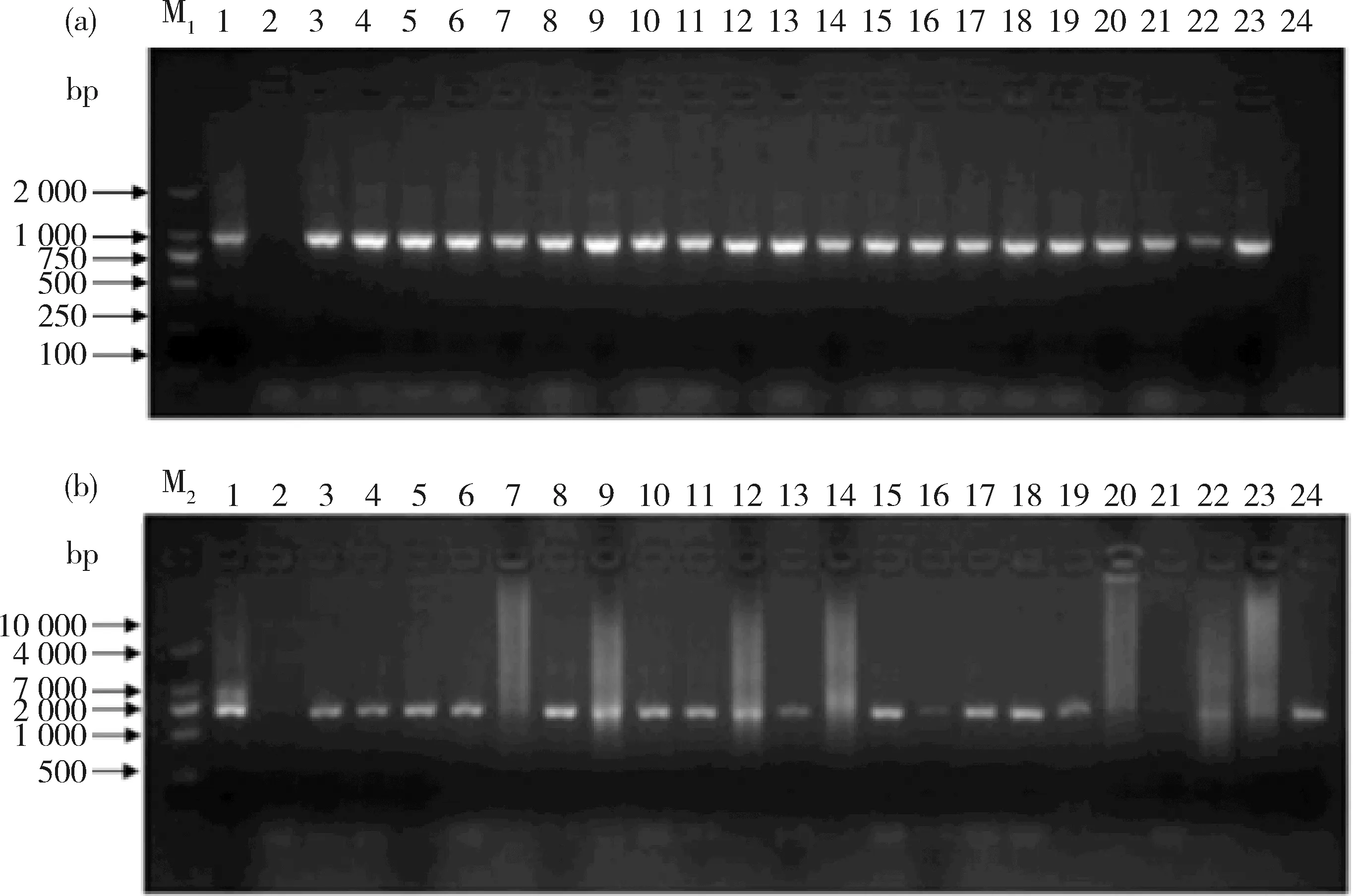
M1,DL2 000分子量标准; M2,DL10 000 分子量标准;1,阳性对照;2,阴性对照;3~24,转基因水稻阳性植株。
2.4 pCXGUS-MYB-1K、pCXGUS-MYB-2K转基因水稻萌发期和苗期GUS染色分析
图5所示,pCXGUS-MYB-1K转基因水稻的种子未着色,pCXGUS-MYB-2K转化植株的种子胚乳边缘着色,表明pCXGUS-MYB-1K未驱动GUS在种子中表达,而pCXGUS-MYB-2K驱动的GUS在种子胚乳边缘表达;pCXGUS-MYB-1K的转化植株种子萌发后仅有芽尖着色,表明其仅驱动GUS在芽尖部位表达,而pCXGUS-MYB-2K的转化植株的根与芽尖均有着色,根中维管束细胞着色较少,芽尖着色较深,表明pCXGUS-MYB-2K驱动的GUS主要在芽尖表达,而在根部维管束组织中表达较弱。
图6可知,pCXGUS-MYB-1K,pCXGUS-MYB-2K植株的根、茎、叶均能着色,其中根部仅维管束细胞着色,后者的根、茎、叶着色均比前者深。推测ZmMYB59基因的启动子没有组织特异性,同时也说明起始密码子前1 000 bp序列是启动子发挥正常调控功能所必须的,且2 000 bp中可能存在增强启动子表达的顺式作用元件。
3 讨论与结论
启动子作为转录水平重要的调节方式备受关注,通过对启动子的研究可以预测基因启动子中重要的元件,还能由此对基因的表达模式进行研究。根据启动子中相关顺式作用元件的分布,将启动子划分为包含不同长度的缺失片段,并将缺失片段与带有GUS报告基因的植物表达载体融合,通过比较不同缺失片段启动报告基因表达的强弱及其在组织中的定位来鉴定启动子缺失片段的时空表达特性与启动子中相关顺式作用元件的作用[16]。

(a)和(e)分别为转pCXGUS-MYB-2K的T1代种子,萌发期GUS组织化学染色结果;(b)~(d)为转pCXGUS-MYB-1K的T1代种子,萌发期GUS组织化学染色结果。(a),(b),(e)的比例尺为1 mm;(c)和(d)的比例尺为2 mm。

(a)~(c)依次为‘日本晴’野生型植株的茎、叶和根;(d)~(f)分别为pCXGUS-MYB-1K转化植株的茎、叶、根;(g)~(i)分别为pCXGUS-MYB-2K转化植株的水稻茎、叶、根。
孙永伟等[17]利用启动子缺失的方法发现响应外源激素ABA的应答元件在启动子序列660~2 000 bp。大豆rbcS[18]基因启动活性最高的是长度为712 bp的启动子,长度为1 089 bp的rbcS基因启动子含有光诱导元件并且还有组织特异表达特性。PGHNBS[19]启动子的调控元件中,-1 071~-959 bp 区域存在韧皮部特异表达元件,增强子元件位于-1 559~-1 420 bp。
本研究发现pCXGUS-MYB-1K转化的T1代种子未着色,pCXGUS-MYB-2K转化的种子的胚乳边缘有着色。通过对MYB59-P-1和MYB59-P-2的生物信息学分析发现可能含有与胚乳表达相关的顺式调控元件GCN4-motif有关,而调控模式需要进一步探究。叶荣建[20]通过突变体研究发现顺式作用元件(GCN4-like motif)以负向调控元件身份来对EnP3-292胚乳特异表达模式进行调控。
pCXGUS-MYB-1K转化材料的种子萌发期只有芽尖着色,pCXGUS-MYB-2K转化材料的芽尖和根均着色,芽尖着色较深,根少量着色,并且GUS在MYB59-P-2的调控下表达量较高。苗期pCXGUS-MYB-1K,pCXGUS-MYB-2K植株的根、茎、叶均能染色,推测ZmMYB59基因的启动子没有组织特异性,同时也说明起始密码子前1 000 bp是启动子发挥正常调控功能所必须的;而后者的根、茎、叶染色均比前者深,说明起始密码子前1 000 bp启动能力不强,推测前2 000 bp中可能存在增强启动子表达的顺式作用元件。
综上所述,MYB59-P-1在种子中没有启动功能,在萌发期和苗期启动功能不强,在萌发期仅芽尖处发挥功能,而在苗期根、茎和叶中均有调控功能;表明MYB59-P-1在调控种子萌发时存在时空差异表达。启动子的高效表达需要多个顺式作用元件的协同及相互作用。通过对MYB59-P-1和MYB59-P-2的生物信息学分析,发现MYB59-P-2中存在大量的脱落酸应答元件(ABRE)、与赤霉素响应有关的顺式作用元件(GARE-motif)、与分生组织特异性激活相关的顺式调控元件(CCGTCC-box)、与胚乳表达相关的顺式调控元件(GCN4-motif)、参与热应激反应的顺式作用元件(HSE)、参与玉米醇溶蛋白代谢调控的顺式调控元件(O2-site),本研究推测ZmMYB59基因的启动子是组成型启动子。组成型启动子的调控不受外界条件的影响,所启动基因的表达具有持续性,可显著地提高外源基因在植物组织中的表达量,特别是在叶片和茎中,但不具备时空特异性。明确ZmMYB59基因的启动子类型,有利于后期更好地研究该基因的时空表达模式。
