microRNA-130b的表达对靶向治疗肺腺癌患者预后的影响
2020-05-03应朝辉隗玉川程万宏
应朝辉, 隗玉川, 程万宏
肺癌是当今世界各国最常见的恶性肿瘤之一,其发病率呈不断上升趋势,并已成为人类因癌症死亡的主要原因之一[1-2]。目前,手术仍是治疗肺癌的主要方法,但其仅适用于早期肺癌患者的治疗,而对于晚期患者则疗效不佳。近年来,分子靶向治疗因其靶向性和安全性等优点而受到越来越多的关注,并成为晚期肺癌患者的一种新的治疗方法。虽然表皮生长因子受体(epidermal growth factor receptor,EGFR)、酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)等靶向治疗药物被开发和引进,但现有的治疗方法对肺癌的治疗效果仍不理想[3-4]。微小RNA(microRNAs)可通过调节细胞生长、凋亡、转移和侵袭在肺癌发生发展中起着关键作用[5-6]。有研究显示,microRNA-130b(miR-130b)可靶向抑制胃癌细胞增殖及诱导凋亡[7];miR-130b在黑色素瘤[8]中表达上调,而在子宫内膜癌[9]和垂体腺瘤[10]中表达下调;miR-130b可靶向调控PTEN,通过促进细胞增殖和抑制凋亡来促进儿童急性早幼粒细胞白血病的发病进程[11]。但关于miR-130b对靶向治疗肺腺癌患者预后的影响尚少见相关报道。本研究旨在探讨经靶向治疗肺腺癌患者术前血清miR-130b的表达水平与预后的关系。
1 资料与方法
1.1 临床资料
选择2013年1月至2014年1月于我院胸外科接受靶向治疗的肺腺癌患者。纳入标准:① 根据世界卫生组织(WHO)肺癌组织学分型和分期标准确诊为肺腺癌[12];② 未接受靶向治疗;③ 无其他恶性疾病(如糖尿病伴严重并发症者、严重肾脏疾病患者等);④ 证实为EGFR突变阳性。排除标准:① 合并胃癌、肝癌等其他恶性肿瘤;② 合并抑郁症、老年痴呆等精神类疾病;③ 不符合靶向治疗适应证的患者。最终纳入符合上述条件的患者278例,其中男113例,女165例;年龄40~82岁,平均年龄(60.8±10.3)岁。有肺癌家族史者41例,有吸烟史者71例。根据TNM分期,Ⅲ期115例,Ⅳ期163例。按照2004年WHO分类标准,肿瘤分化程度为中高分化(G1~2)者170例,低分化(G3~4)者108例。本研究经我院医学伦理委员会批准,获患者和家属知情同意且签署知情同意书。
1.2 方法
1.2.1 靶向治疗 于治疗前7 d对患者进行全面的身体检查。所有患者均行EGFR-TKIs治疗,口服250 mg/d的吉非替尼(阿斯利康)或150 mg/d的厄洛替尼(上海罗氏制药有限公司),患者只要未出现死亡、无法耐受的不良反应或者明显的耐药情况,就持续使用药物维持治疗。
1.2.2 主要试剂及仪器 RNA提取试剂盒TRIzol(美国Invitrogen公司)、NanoDrop 2000c紫外分光光度计(美国Thermo Scientific)、逆转录试剂盒Prime-ScriptTMRT reagent Kit(TaKaRa,Japan)、普通RT-PCR仪(BIO-RAD,USA)、罗氏LC 480荧光定量PCR仪(Applied Biosystems, USA)。
1.2.3 采用定量实时聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测miR-130b的表达 靶向治疗前4 h内,采集患者空腹静脉血5 ml,并在45 min内以3 000 r/min的速度离心10 min分离血清,置于-80 ℃冰箱备用。RNA的分离使用miRNeasy血清试剂盒(Qiagen,Hilden, Germany)。利用TRIzol(美国Invitrogen公司)提取总RNA。采用反转录试剂盒反转录获得cDNA。以U6基因为内参,应用qRT-PCR仪在ABI PRISM 7500序列检测系统中进行扩增。反应条件如下:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,60 ℃延伸1 min,45个循环。引物序列见表1。采用2-ΔΔCt法计算miR-130b的相对表达量。测量3次取平均值。
表1 miR-130b和U6引物序列

基因名称序列(5'-3')产物长度(bp) miR-130b正向CGGCAGTGCAATGATGAAAG100 反向CAGTGCGTGTCGTGGAGT96 U6正向TGCGGGTGCTCGCTTCG-GCAGC100 反向CCAGTGCAGG GTCCGAGGT96
1.2.4 随访 根据我院自制的随访登记表进行随访,包括患者的睡眠、饮食、用药、生存情况以及出院后的治疗情况。随访方式:上门随访、电话随访以及门诊随访等多种方式相结合。随访时间:患者出院1年内每3个月随访1次,2~4年每6个月随访1次,4~5年每年随访1次。生存时间:患者的靶向治疗时间记为该患者的生存起始时间。若死亡,则死亡时间记为终点时间;若未发生死亡,则随访结束时间记为终点时间,终点时间与起始时间的时间间隔为生存时间。
1.3 统计学方法

2 结果
2.1 miR-130b对靶向治疗肺腺癌患者生存的预测价值
278例患者靶向治疗前miR-130b表达水平为11.3±2.1,治疗后miR-130b表达水平为9.3±1.8,差异有统计学意义(t=10.388,P<0.001)。治疗前miR-130b对靶向治疗肺腺癌患者生存的预测价值见图1,miR-130b预测靶向治疗肺腺癌患者死亡的最佳临界点为9.93。当miR-130b为9.93时,miR-130b预测靶向治疗肺腺癌患者死亡的灵敏度为82.2%,特异度为66.2%;ROC曲线下面积(AUC)为0.76。

图1 miR-130b预测靶向治疗肺腺癌患者死亡的ROC曲线
2.2 miR-130b表达与肺癌患者临床病理特征的关系
根据ROC曲线分析结果进行分组,miR-130b≥9.93者为高表达组(n=145),miR-130b<9.93者为低表达组(n=114)。miR-130b高表达组有肿瘤家族史、吸烟、低肿瘤分化程度以及高TNM分期患者比例高于低表达组(P<0.05),见表2。
表2 miR-130b表达与肺癌患者临床病理特征的关系[例(%)]
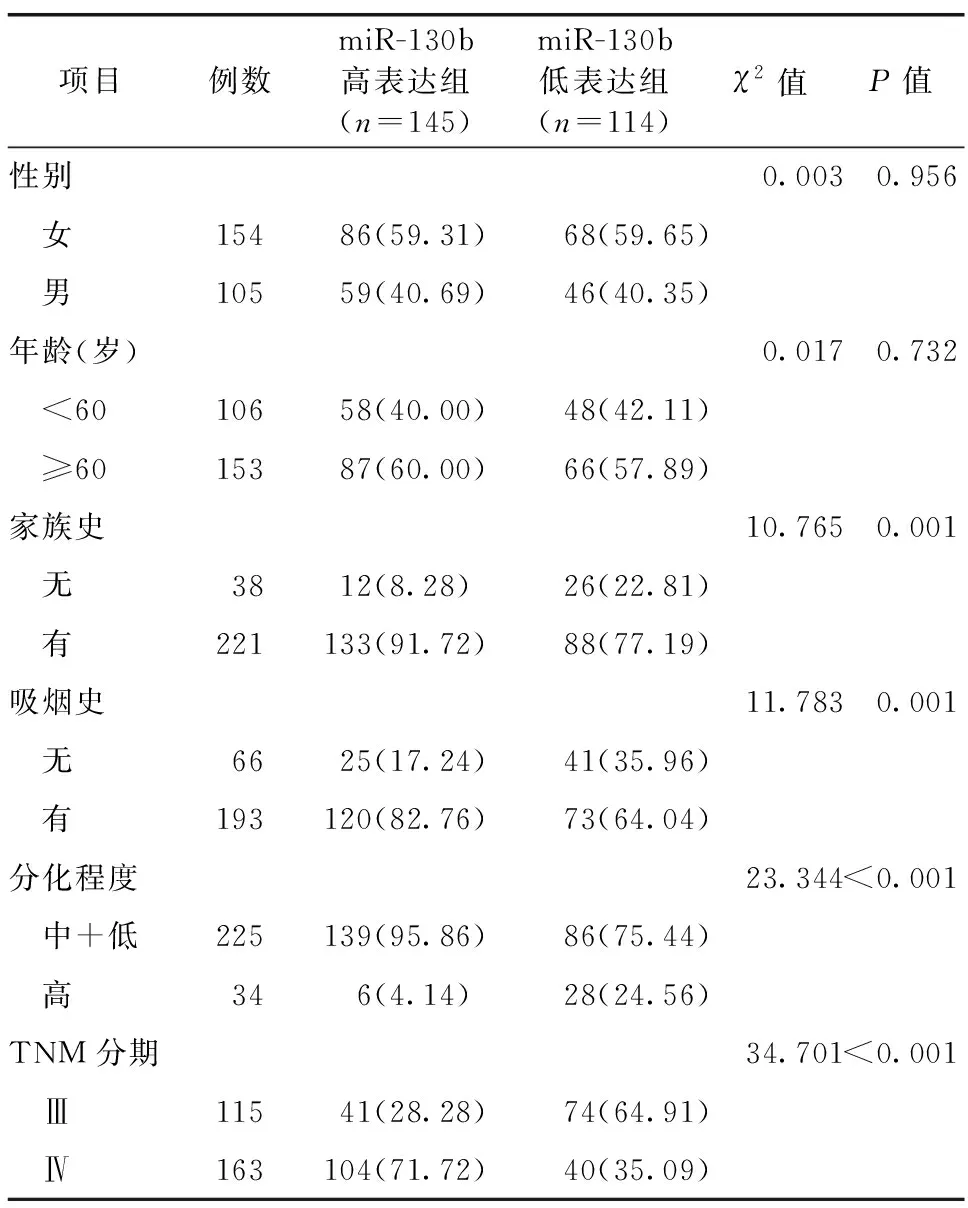
项目例数miR-130b高表达组(n=145)miR-130b低表达组(n=114)χ2值P值 性别0.0030.956 女15486(59.31)68(59.65) 男10559(40.69)46(40.35) 年龄(岁)0.0170.732 <6010658(40.00)48(42.11) ≥6015387(60.00)66(57.89) 家族史10.7650.001 无3812(8.28)26(22.81) 有221133(91.72)88(77.19) 吸烟史11.7830.001 无6625(17.24)41(35.96) 有193120(82.76)73(64.04) 分化程度23.344<0.001 中+低225139(95.86)86(75.44) 高346(4.14)28(24.56) TNM分期34.701<0.001 Ⅲ11541(28.28)74(64.91) Ⅳ163104(71.72)40(35.09)
2.3 肺腺癌患者单因素生存分析
随访起止时间为2014年2月至2019年1月,278例肺腺癌患者中失访19例,随访率93.17%。在随访到的259例患者中,死亡191例,中位随访时间为42个月。Kaplan-Meier并Log-rank检验结果显示,miR-130b低表达组患者中位生存时间为48个月,高表达患者中位生存时间为36个月,miR-130b低表达组患者的生存情况优于高表达组(Log-rankχ2=28.341,P<0.001),见图2。
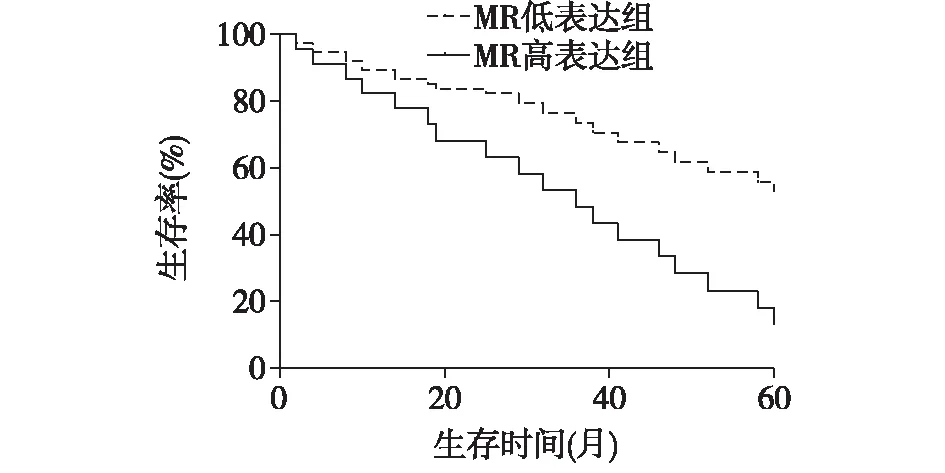
图2 miR-130b表达与经靶向治疗肺腺癌患者总体生存相关性
2.4 肺腺癌患者多因素Cox回归分析结果
以生存状态(生存=0,死亡=1)为因变量,肿瘤家族史(无=0,有=1)、吸烟史(无=0,有=1)、分化程度(高=0,中+低=1)、TNM分期(Ⅲ期=0,Ⅳ期=1)、miR-130b表达(<9.93为0,≥9.93为1)为自变量,进行多因素Cox回归分析。结果显示,肺癌家族史、吸烟史、较低分化程度、较高TNM分期、miR-130b高表达是经靶向治疗肺腺癌患者死亡的独立危险因素,见表3。
表3 肺腺癌患者靶向治疗预后多因素生存分析

因素βSEWaldPHR95%CI 肿瘤家族史0.1370.028174.745<0.0011.1471.124~1.170 吸烟史0.7940.083115.256<0.0012.2121.914~2.557 分化程度0.2310.09127.895<0.0011.2591.156~1.373 TNM分期0.6830.11353.489<0.0011.9801.649~2.377 miR-130b0.9680.18927.099<0.0012.6331.829~3.790
3 讨论
肺癌患者的预后较差,虽然早期肺癌患者通过常规手术治疗一般可起到根治的效果,但是手术对晚期肺癌的治疗效果较差,其5年生存率不足15%[13]。近年来,晚期肺腺癌患者分子靶向治疗虽取得了新的进展,然而由于个体异质性,不同患者的靶向治疗效果并不一致。microRNA被证明是肿瘤细胞对治疗反应的重要调节因子[14],其表达与患者对靶向治疗的反应及肿瘤的发生发展密切相关[15-16]。
Wang等[17]研究发现,miR-130b表达上调提示肝癌患者死亡风险增大。霍续磊等[18]研究发现,miR-130b在肝硬化患者血清中的表达量显著高于健康对照者。目前关于miR-130b表达与肺癌患者预后的报道尚少见。本研究结果显示,治疗前miR-130b预测肺腺癌患者预后的AUC为0.76,灵敏度为82.2%,特异度为66.2%;另外,miR-130b低表达组患者的生存情况优于高表达组,且miR-130b高表达是经靶向治疗肺腺癌患者死亡的独立危险因素,提示miR-130b对经靶向治疗肺腺癌患者的预后判断具有一定价值。易敏等[19]研究发现,miR-130b在结肠癌组织中表达下调,并与肿瘤体积增大及高TNM分期有关。本研究结果显示,miR-130b高表达组有肿瘤家族史、吸烟、低肿瘤分化程度以及高TNM分期患者比例高于低表达组。本研究与易敏等[19]的研究结果不一致,可能是由于胚层分化来源差异造成的。miR-130b对肺癌患者预后影响的机制尚不清楚。体外实验表明,miR-130b可靶向过氧化物酶体增殖物激活型受体(PPARγ),通过血管内皮生长因子A(VEGF-A)/B淋巴细胞瘤-2(BCL-2)途径抑制肺癌细胞凋亡[20]。Zhang等[21]研究发现,miR-130b通过激活Wnt蛋白与β-连环蛋白(Wnt/β-catenin)通路,靶向调控PTEN诱导肺癌细胞的耐药性。
综上所述,miR-130b对肺腺癌患者靶向治疗预后的判断具有一定价值,miR-130b表达上调的肺腺癌患者靶向治疗预后更差,其可能作为肺腺癌患者靶向治疗预后的生物标志物之一。
