例谈电化学中电极反应式的书写
2020-04-30杜雪文
杜雪文
摘要:电化学知识是高中化学的重点和难点,其中电极反应式的书写在选考中是一个出现频率达到百分百的考点,而学生对此却是困难多、耗时长、得分低。如何使学生快捷、准确的书写电极反应式?本文从电化学原理出发,通过一些例子来阐述如何快捷、准确的书写电极反应式。
关键词:电极反应式;三步;氧化还原
一、夯实电化学基础知识
写好电极反应式首先要夯实电化学的基础知识,然后再谈书写的方法和技巧。如:区分原电池和电解池,灵活判断电极的名称及电极反应的类型,原电池中,负极发生氧化反应(失电子),正极发生还原反应(得电子);电解池中,阳极发生氧化反应(失电子),阴极发生还原反应(得电子),明确电化学装置中电子的流向、溶液中离子的迁移方向等。建立原电池和电解池工作原理的基本模型。学生熟练掌握上述电化学基础是学生快捷、准确的书写电极反应式的基础。
其次,在电化学的教学过程中,教师要根据学生认知水平的发展和接受能力的提升做出适应的调整。虽然苏教版《化学·选修·化学反应原理》将电解饱和食盐水阴极电极反应式表达为:2H++2e-=H2↑,但笔者认为溶液中的H+来源于水的电离,遵循离子方程式书写的规则,应该写成水得到电子。教师应该将电解饱和食盐水的阴极的电极反应式改为2H2O+2e-=H2↑+2OH-,这样的表达方式可以帮助学生客观准确、科学合理的表达电极及其附近溶液的变化,更直观的解釋电解后阴极附近溶液呈碱性的事实,也更符合学生认知发展的规律,为后续电极反应式的书写建立了一个共同的标准,也只有这样,学生才能建立起科学、开放的、相互衔接的知识体系。
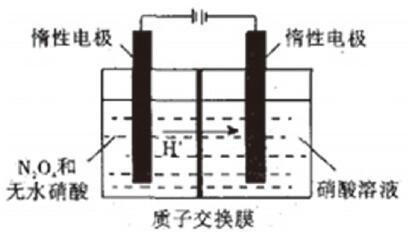
例 N2O5是绿色硝化试剂,溶于水可得硝酸.右图是以N2O4为原料电解制备N2O5的装置示意图,写出阳极区生成N2O5的电极反应式是_________。
解析:阳极发生氧化反应,根据题意可知,阳极为N2O4被氧化为N2O5,根据电荷守恒,阳极必然要产生H+,但是H+不是来自于水(阳极是一个无水的环境),而是来自于无水硝酸,而硝酸在没有水的情况下是不能发生电离的,因此题中无水硝酸在电极反应式里不能拆,电极反应式应为:2HNO3+N2O4-2e-=2N2O5+2H+。
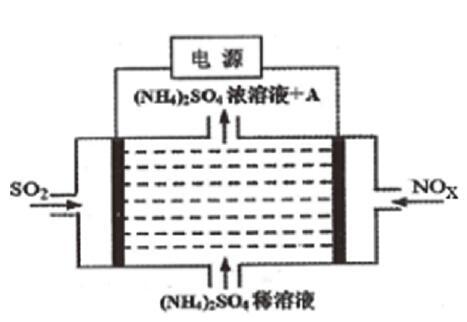
例 利用如图所示的电解装置,可将大气中的NOx、SO2变废为宝,则物质A的化学式为_______,阴极的电极反应式为_______。
答案:物质A的化学式为NH4HSO4,阴极的电极反应式为:NOx+(2x+3)e-+(2x+4)H+=NH4++xH2O
由图可知,该装置的电解液中不存在强酸性物质,为何阴极的电极反应式中反应物中可以出现H+而不是水呢?不妨可以先写出阳极的电极反应式:SO2-2e-+ 2H2O=SO42-+4H+,可以看出原来是阳极产生的H+迁移到阴极区参与了电极反应。如果将两个电极反应相加,可以得到电解的总反应为:(2x+3)SO2+2NOx+(2x+6)H2O= (2x+3)SO42-+2NH4++ (4x+4)H+,通过电解NH4+、SO42-、H+的浓度都增大了,电解后硫酸铵稀溶液就变成了浓溶液,与之共存的A则为NH4HSO4。
二、学会书写电极反应式的方法、技巧
学生在掌握电化学基本原理及氧化还原反应的基本规律之后,电极反应式的书写需要走好两个“三步”。
第一个“三步”为审题分三步走。第一步,判断装置是原电池还是电解池;第二步,判断电极的名称;第三步,判断电极上发生的反应类型(氧化反应还是还原反应)?为后续电极反应式的书写做好铺垫。
第二个“三步”为书写分三步。原电池和电解池电极发生的都是氧化还原反应,因此电极反应式的书写也要遵循氧化还原反应的书写原则,即电子守恒、电荷守恒和质量守恒。具体来看,第一步,找到是什么微粒失去(或得到)多少电子被氧化(或还原)成什么微粒;第二步,看环境找到用什么微粒来配平电荷守恒;第三步,同样看环境找到用什么微粒来配质量守恒。
例 以熔融Na2CO3 为电解质的乙醇燃料电池具有广泛的应用,写出负极的电极反应式:。
解析:第一个“三步”,根据题意可知,燃料电池为原电池装置,负极发生氧化反应。第二个“三步”,步骤一,找到1molCH3CH2OH失去12mole-被氧化成2molCO2,表达为:CH3CH2OH-12e-=2CO2。步骤二,看环境,以熔融Na2CO3为电解质,则用CO32-来配平电荷守恒并调整质量守恒,表达为:6CO32-+CH3CH2OH-12e-=8CO2。步骤三,看环境,用水配平质量守恒,表达为:6CO32-+CH3CH2OH-12e-=8CO2+3H2O。
假如该题将“熔融Na2CO3为电解质”改为“NaOH溶液为电解质”,则乙醇被氧化成“CO32-”,电荷守恒用“OH-”来配平,则负极的电极反应式为:16OH-+CH3CH2OH-12e-=2CO32-+11H2O。由此可见,在书写的三个步骤中无论哪一步都要注意题给环境,这也是学生答题经常踩到的雷区,教师应对学生多加训练,增强学生答题的敏感度。
面对错综复杂的电极反应,教师只要帮助学生立足基础,走好两个“三步”,才能以不变应万变,提升学生的综合能力。
参考文献:
[1]浙江省基础教育课程改革专业指导委员会制定.浙江省普通高中学科教学指导意见[M].浙江:浙江教育出版社,2012
[2]倪全芬.如何正确书写电极反应式[J].高中数理化,2013 (19).
