Cd与羧基化多壁碳纳米管复合胁迫下蚕豆幼苗Cd的富集与分布*
2020-04-30王苏杭赵薪程刘海涛汪承润
刘 玲, 王苏杭, 张 进, 陈 成, 赵薪程, 刘海涛, 汪承润
Cd与羧基化多壁碳纳米管复合胁迫下蚕豆幼苗Cd的富集与分布*
刘 玲, 王苏杭, 张 进, 陈 成, 赵薪程, 刘海涛, 汪承润**
(淮南师范学院生物工程学院 淮南 232038)
纳米材料因大量开发、生产和应用不可避免地被释放到环境中, 给生态环境和人体健康带来潜在的风险。因此为了探究羧基化多壁碳纳米管(MWCNTs-COOH)和重金属Cd双重胁迫对植物器官中Cd的富集、转运及细胞中Cd分布的影响, 以及为MWCNTs-COOH与Cd复合污染对植物的毒性和生态风险性评价提供理论依据, 本研究以蚕豆幼苗为试验材料, 采用水培方式, 设置MWCNTs-COOH (0 mg·L-1、1.5 mg·L-1、3.0 mg·L-1、6.0 mg·L-1、12.0 mg·L-1)+10.0 µmol·L-1Cd 5个处理组, 用石墨炉原子吸收光谱法测定不同处理下蚕豆幼苗根茎叶及细胞中Cd的含量, 分析MWCNTs-COOH复合Cd处理下蚕豆幼苗营养器官对Cd的富集、转运及细胞内分布状况。结果表明: 复合胁迫下, 3种营养器官Cd含量均高于对照; 根茎叶对Cd的富集、Cd富集系数及器官间(根-茎、茎-叶)的转移系数均随MWCNTs-COOH浓度升高呈先升高后降低趋势, 当MWCNTs-COOH浓度为6.0 mg·L-1时, 以上指标均达到最大值。同时, 随着MWCNTs-COOH浓度的增大, 根茎叶细胞中Cd逐渐从细胞壁向原生质体转移, 加深了对细胞的毒害。综上所述, 中低浓度的MWCNTs-COOH不仅可促进蚕豆根茎叶对Cd的累积及向上转运, 而且也能加强细胞中Cd的转移。
羧基化多壁碳纳米管; 镉; 复合胁迫; 富集系数; 转移系数; 蚕豆
碳纳米管(CNTs)是碳的新型同素异形体, 由石墨烯片层卷曲而成, 按照石墨烯片的层数可分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)。相对于SWCNTs, MWCNTs易制取且表面更活泼, 可与各种基团相结合, 其中, 羧基化多壁碳纳米管(MWCNTs-COOH)凭借自身独特结构和优异理化性能被广泛生产和使用, 自其问世以来便广受关注[1]。随着外界对MWCNTs-COOH的不断开发、生产和应用, 使其不可避免地被释放到土壤及其他环境中, MWCNTs-COOH的长期积累, 给生态环境和人体健康带来潜在的风险。所以, 作为CNTs表面功能化的典型代表, MWCNTs-COOH的生物效应、环境安全性和潜在毒性成为人们普遍关注的问题[2]。
与此同时, 随着工农业的迅速发展, 人类活动如污水排放、火力发电、冶金、造纸等, 使越来越多的重金属进入土壤或水域, 导致农产品重金属超标, 使重金属污染成为影响国计民生的问题[3-4]。重金属污染中镉(Cd)污染最为普遍和严重, 因其在环境中具有迁移性差、残留时间长、难以降解的特点, 使得水体和土壤中的Cd含量逐年积累, 对环境和生物体产生极大的损害[5]。当土壤中的MWCNTs- COOH与Cd接触后, 两者间的关系怎样、对植物特别是农产品会有怎样的影响, 这些问题都有待进一步研究。
目前研究表明, MWCNTs对动植物[6-8]、人体[9]和微生物[10-11]均会产生毒害作用。而植物作为生态系统的重要组成部分, 对CNTs具有潜在的吸附累积效应, 是CNTs进入生物循环的重要途径。因此, 研究CNTs对植物的理化毒性对于评价其生态安全性至关重要。在CNTs与重金属复合污染的环境介质中, 两者之间不可避免地会发生相互作用, 进而干扰重金属对生态系统的毒性效应。由于MWCNTs-COOH表面具有大量的微孔和微界面, 可以强化各种界面反应, 具有吸附、催化、辐射、吸收等新特性[12], 当其进入环境后往往成为其他污染物的载体, 并对其毒性产生影响[13]。已有研究证明, CNTs具备吸附重金属的能力, 促进重金属向植物细胞内部渗透, 进而增强重金属的生物积累[14]。但是国内外有关MWCNTs-COOH复合重金属Cd对植物生命活动及Cd富集变化以及植物生态安全性评价的研究较少, 仅在某种碳纳米管[15-16]、金属胁迫[17]或不良环境(如干旱、盐胁迫、酸雨等)与重金属复合胁迫[18]等方面进行了大量研究, 未能证明环境中存在的MWCNTs-COOH在重金属与植物之间所起的作用。所以, 本研究拟采用蚕豆()幼苗为试验对象, 选取Cd为典型重金属, 研究蚕豆幼苗在重金属Cd和MWCNTs-COOH复合污染下器官细胞对Cd的富集、转运及分配情况, 明确MWCNTs-COOH在Cd与蚕豆间所起的作用, 为诊断和评价MWCNTs-COOH与Cd复合污染的生态风险性提供理论参考。
1 材料与方法
1.1 供试材料
供试蚕豆‘临蚕5号’由甘肃省临夏州农业科学研究所制种, 购于安徽省淮南市圆和种子公司, 为淮南当地部分农户种植品种。
1.2 MWCNTs-COOH
MWCNTs-COOH[纯度大于95%, 羧基质量分数()为2.56%; 灰分<1.5%; 内径范围3~5 nm, 外径范围8~15 nm, 长度0.5~50 μm, 比表面积233 m·g-2, 电导率>100 S·m-1]购自中国科学院成都有机化学有限公司。使用前进行6次间歇式超声处理(15 s·min-1)并利用透射电子显微镜(TEM) (JEM-100CX, 日本)对样品进行表征。在TEM下MWCNTs-COOH呈管状结构, 直径为(8.97±1.25) nm。
1.3 试验设计
选用籽粒饱满、大小均匀且无病虫害的蚕豆种子, 消毒催芽参照卢垟杰等[19]的方法, 并略加改动: 用0.5%高锰酸钾溶液浸泡消毒3 h, 清水漂洗4~5次, 室温浸泡催芽36 h(每隔3~4 h淘洗、换水1次)。待种子露白后进行土培, 在蚕豆发芽出苗后筛选芽势、株高、根长相近的幼苗悬浮培养于1/4-Hoagland培养液中, 预培养1周后移至MWCNTs-COOH+Cd复合处理液中。共设5个处理: 对照(CK, 10.0mmol·L-1Cd)、10.0mmol·L-1Cd+1.5 mg·L-1MWCNTs- COOH (Cd+1.5)、10.0mmol·L-1Cd+3.0 mg·L-1MWCNTs- COOH (Cd+3.0)、10.0mmol·L-1Cd+6.0 mg·L-1MWCNTs- COOH (Cd+6.0)、10.0mmol·L-1Cd+12.0 mg·L-1MWCNTs- COOH (Cd+12.0), 培养液皆为Hoagland全营养液, Cd皆为CdCl2·2.5H2O, 处理液pH控制在5.5~5.8, 每个处理重复3次, 每个重复48株蚕豆幼苗。培养环境: 15 h光照, 75%相对湿度, 连续充气。幼苗处理2周后进行采样分析测定, 每个处理随机采集10株鲜样分离根、茎、叶, 70 ℃烘干后测其Cd含量, 另取根、茎、叶鲜样用于测定各器官亚细胞中Cd含量及分布。
1.4 测定项目及方法
1.4.1 Cd含量测定
样品的前处理采用硝酸-高氯酸(4∶1,/)湿式消解法[20]。每个处理取10株蚕豆幼苗, 蒸馏水洗净后, 把根、茎、叶分离, 置于烘箱(70 ℃, 处理12~24 h, 干燥至恒重)烘干。研磨后分别称取根、茎、叶粉末0.5 g, 加5 mL HNO3-HClO4(4∶1,/)混合液, 过夜, 150 ℃消煮3 h后, 升温至180 ℃。溶液消解至澄清且剩余体积0.5 mL左右时停止加热, 冷却后用去离子水转移至10 mL离心管中定容。
利用石墨炉原子吸收光谱法[21-22]测定Cd含量。原子吸收分光光度计(novAA 400P)购于德国Annalytik Jena公司。标准样为GBW(E)080119, 灰化温度250 ℃, 原子化温度1 800 ℃。
1.4.2 Cd在蚕豆植株各器官的细胞分布
分别称取根、茎和叶鲜样0.5 g, 加入10 mL提取液[23]后, 冰浴研磨成匀浆, 提取液组成为Tris-HCl缓冲液(pH 7.5, 50 mmol·L-1)、蔗糖(250 mmol·L-1)、二硫赤藓糖醇(1.0 mmol·L-1)、抗坏血酸(5.0 mmol·L-1)、1.0%(/)聚乙烯吡咯烷酮(PVPP)。匀浆液经240 μm尼龙网过滤, 残渣为细胞壁(F1)部分, 滤液为原生质体(F2), 主要包括细胞质、有机物、无机离子和液泡内的大分子。70 ℃下烘干细胞壁(F1)和原生质体(F2)后, 同法进行消解和Cd含量测定。
1.5 数据处理和分析
利用富集系数(bioconcentration factor, BCF)和转移系数(translocation factor, TF)对蚕豆器官的Cd富集特征进行评估, 其计算公式分别为: Cd富集系数(BCF)=器官中Cd含量/处理液中Cd含量; Cd转移系数(TFA-B)=器官B中Cd含量/器官A中Cd含量。
采用SPSS 13.0对数据进行单因素方差分析(One-way ANOVA), 计量采用均数±标准偏差表述, 用Duncan法对各处理间的差异性进行多重比较, 各处理间的显著性差异均设为<0.05的水平。
2 结果与分析
2.1 MWCNTs-COOH复合Cd胁迫下蚕豆营养器官Cd含量
由表1可知, MWCNTs-COOH复合Cd胁迫下, 蚕豆幼苗根茎叶Cd含量皆高于CK, 4个复合处理的营养器官Cd含量的变化呈现相同的趋势: 当MWCNTs-COOH浓度介于1.5~6.0 mg·L-1时, 3种营养器官Cd含量皆表现为随着MWCNTs-COOH浓度的增大而增加; Cd+6.0 mg·L-1MWCNTs-COOH处理下, 蚕豆幼苗根茎叶Cd含量达最大值, 分别为90.62 µg·g-1、30.33 µg·g-1、14.02 µg·g-1; 而Cd+12.0 mg·L-1MWCNTs-COOH处理的蚕豆幼苗根茎叶Cd含量皆下降。此外, 不同营养器官对Cd的积累状况不同, 复合胁迫下, 不同处理间根茎叶的Cd含量差异显著, 3种营养器官对Cd的累积显示为根>茎>叶。研究结果表明1.5~12.0 mg·L-1MWCNTs-COOH与Cd复合可促进蚕豆幼苗根茎叶对Cd的吸收。
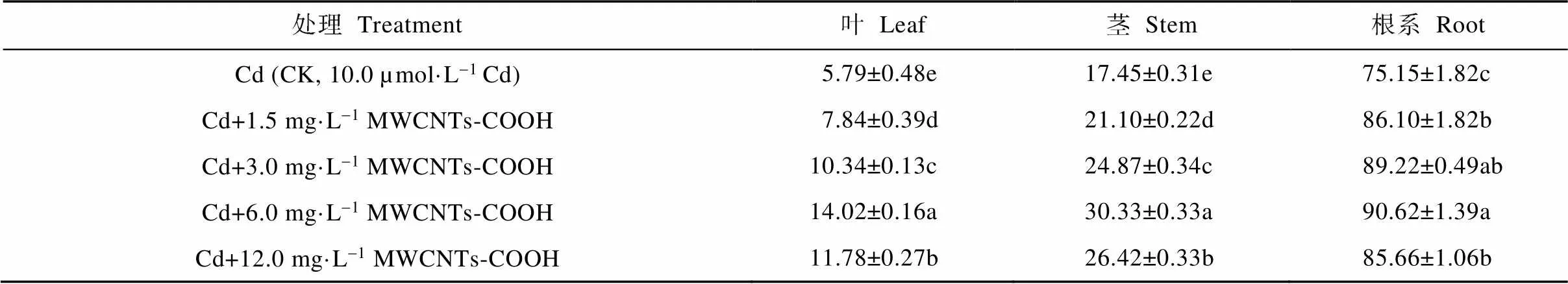
表1 MWCNTs-COOH复合Cd胁迫下蚕豆幼苗各器官Cd含量
同列不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters in the same column indicate significant differences among different treatments at< 0.05 level.
2.2 MWCNTs-COOH复合Cd胁迫下蚕豆幼苗营养器官Cd富集系数及转移系数
由表2可知, 与CK相比, MWCNTs-COOH与Cd复合处理组蚕豆各器官对Cd的富集能力呈先升高后降低趋势, 1.5~12.0 mg·L-1MWCNTs-COOH均显著诱导蚕豆各器官对Cd的积累, 当MWCNTs- COOH浓度为6.0 mg·L-1时, 根、茎、叶对Cd的富集系数最大, 分别是CK的1.20倍、1.73倍、2.42倍; MWCNTs-COOH浓度为12.0 mg·L-1时, 蚕豆各器官对Cd的富集系数减小, 但仍显著高于CK。Cd转移系数也呈现先升高后降低趋势, MWCNTs-COOH与Cd复合处理显著促进根-茎、茎-叶间Cd的转移。当MWCNTs-COOH浓度为6.0 mg·L-1时蚕豆各器官间Cd转移系数最大, 分别为33.47%(根-茎)和46.23%(茎-叶); MWCNTs- COOH浓度为12.0 mg·L-1时, 蚕豆各器官间Cd的转移系数减小, 但也显著高于CK。因此, 试验结果表明, 1.5~12.0 mg·L-1MWCNTs-COOH可加强Cd在蚕豆营养器官中的富集, 并促进向地上部分转移, 且茎-叶间Cd的转移系数大于根-茎。
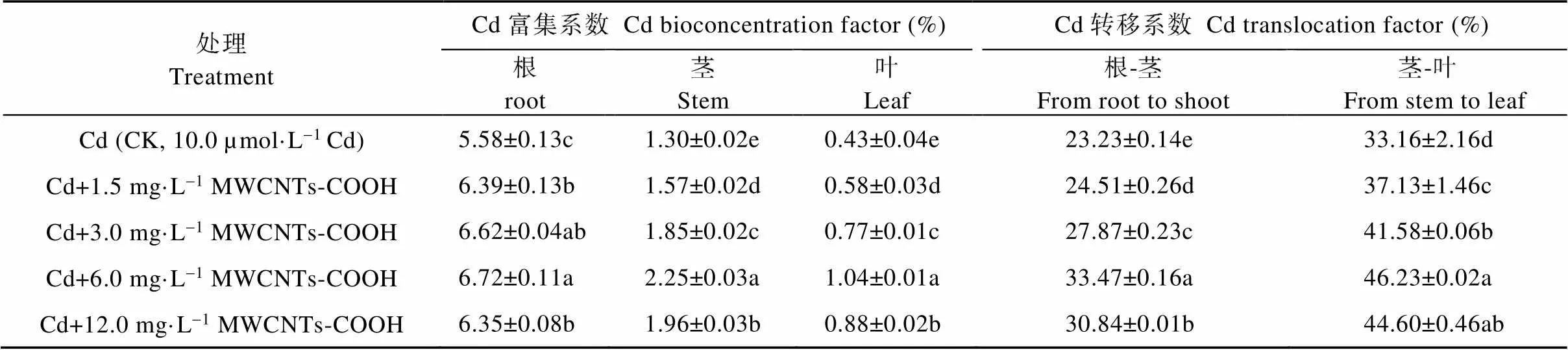
表2 MWCNTs-COOH复合Cd胁迫下蚕豆幼苗各器官对Cd的富集系数及转移系数
同列不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters in the same column indicate significant differences among different treatments at< 0.05 level.
2.3 MWCNTs-COOH复合Cd胁迫下蚕豆幼苗细胞亚显微结构Cd含量和分配比例
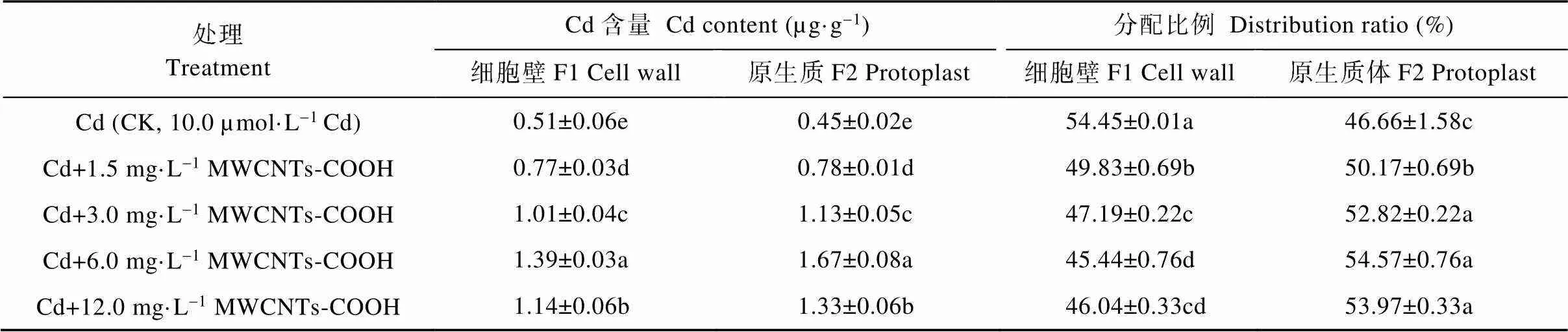
2.3.1 根细胞壁和原生质体Cd含量及分配比例
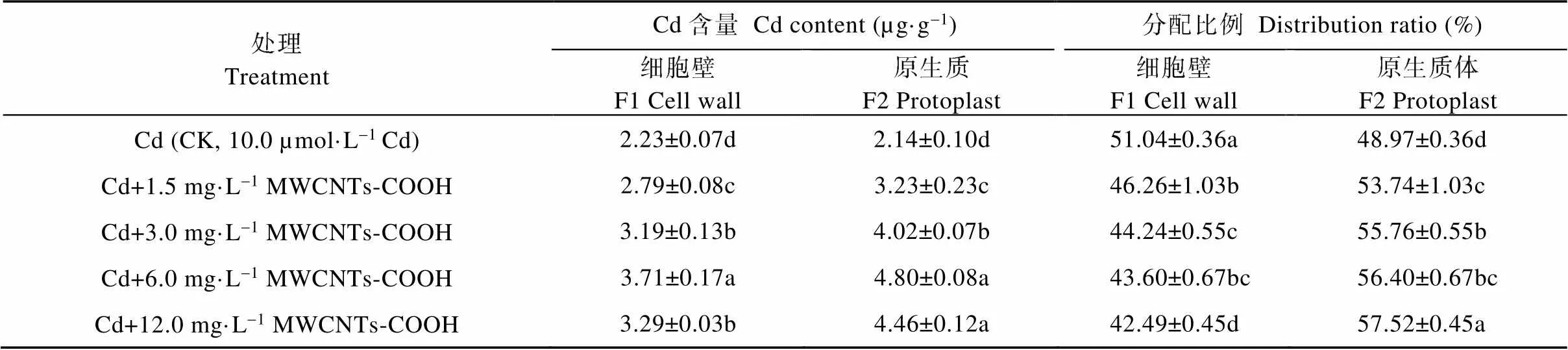
由表3可知, CK处理的蚕豆根细胞F1和F2的Cd含量分别为7.51 µg·g-1和4.04 µg·g-1, 分配比例为67.03%和32.98%, 细胞亚显微结构部分的Cd含量及分配比例均表现为F1>F2。与CK相比, 复合处理中蚕豆根细胞F1和F2的Cd含量均显著高于CK, 且呈现先增高后降低的趋势, 其中, Cd+6.0 mg·L-1MWCNTs-COOH处理下蚕豆根细胞F1和F2中Cd含量最高, 显著高于其他处理组, 且分别为CK的1.24倍和3.03倍。然而, 当MWCNTs-COOH浓度达到6.0 mg·L-1以上时, 细胞的Cd含量及分配比例变为F1 表3 MWCNTs-COOH复合Cd胁迫下蚕豆根细胞亚显微结构Cd含量及分配比例 同列不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters in the same column indicate significant differences among different treatments at< 0.05 level. 2.3.2 茎细胞细胞壁和原生质体Cd含量及分配比例 由表4可知, CK处理中蚕豆茎细胞壁F1和原生质体F2的Cd含量分别为2.23 µg·g-1和2.14 µg·g-1, 分配比例为51.04%和48.97%, 细胞亚显微结构的Cd含量及分配比例均为F1>F2。与CK相比, 复合处理中蚕豆茎细胞Cd含量均显著提高, Cd的含量及分配比例皆表现为F1 表4 MWCNTs-COOH复合Cd胁迫下蚕豆茎细胞亚显微结构Cd含量及分配比例 同列不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters in the same column indicate significant differences among different treatments at< 0.05 level. 2.3.3 叶细胞细胞壁和原生质体Cd含量及分配比例 由表5可知, CK处理蚕豆叶细胞壁F1和原生质体F2的Cd含量分别为0.51 µg·g-1和0.45 µg·g-1, 分配比例为54.45%和46.66%, 细胞亚显微结构部分的Cd含量及分配比例表现为F1>F2。与CK相比, 复合处理中蚕豆叶细胞F1和F2中Cd含量的变化趋势与根茎相同, 先增高后降低, 均显著高于CK。F1和F2 Cd含量及分配比例表现为F1 表5 MWCNTs-COOH复合Cd胁迫下蚕豆叶细胞亚显微结构Cd含量及分配比例 同列不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters in the same column indicate significant differences among different treatments at< 0.05 level. 本研究以蚕豆为研究对象, 幼苗长出6片真叶后取样, 此阶段蚕豆幼苗对各种营养元素的吸收快、需求大。相关研究显示, 植物通过根部吸收营养的同时, 环境中的Cd也会通主动运输和协助扩散等方式进入细胞, 并因根压和蒸腾拉力由木质部运输到地上部位[24-25], 而根部吸收Cd并向地上部迁移的能力是决定植物耐Cd性的重要机理之一[26-27]。本研究结果显示, 随MWCNTs-COOH浓度的增加, 蚕豆各器官的Cd含量均显著增加, 具体表现为根>茎>叶, 与周建等[28]研究的Cd胁迫对刺槐()幼苗Cd离子富集影响和舒启豪等[18]研究的干旱与Cd双重胁迫对土壤-小麦()-蚜虫系统Cd转移规律影响的结果一致。说明MWCNTs-COOH有促进蚕豆吸收和运输Cd的功能。由于不同MWCNTs-COOH处理浓度下蚕豆吸收Cd的能力存在显著差异, 表现为在一定浓度范围内(1.5~6.0 mg·L-1)随着MWCNTs-COOH浓度的增大, 根茎叶的Cd含量呈增加趋势, 说明蚕豆根部吸收Cd并向地上转移Cd的能力在一定浓度梯度内与MWCNTs-COOH呈正相关。对5个处理下蚕豆各器官Cd的富集和转移能力进行研究, 发现复合胁迫下蚕豆各器官中Cd含量显著高于单一Cd胁迫, 且转移系数也显著高于单一Cd胁迫, 这可能是由于MWCNTs-COOH表面的拓扑微孔吸附大量Cd附着于蚕豆根部并促进Cd向植物体内部渗透所导致[18]; 中低浓度MWCNTs-COOH可促进蚕豆对Cd的富集与转运, 高浓度MWCNTs-COOH则抑制这一作用, 这可能是因为中低浓度MWCNTs-COOH加速蚕豆细胞中可溶性蛋白生成和生理代谢, 而高浓度MWCNTs-COOH加剧蚕豆细胞所受氧化压力, 使大量氧自由基积累并进攻氨基酸残基, 导致蛋白水解酶被激活, 蛋白质功能失活或降解[29]。 组成植物细胞细胞壁的成分果胶、纤维素、木质素等均对重金属有较强的络合作用, 是重金属进入细胞的第一道屏障, 在Cd污染环境中细胞初生壁中纤维素、果胶质和糖蛋白等结构物质可形成网架结构将Cd离子阻隔在质外体外, 经阻隔沉降后的Cd活性降低, 可使原生质体免受伤害[30-32]。目前, 在研究植物亚细胞中Cd的主要分布位置方面仍存有争议, 有研究表明Cd在亚细胞中的含量分配表现为细胞壁>原生质体[28,33], 而张路等[24]的研究则表明亚细胞中Cd的分配表现为原生质体>细胞壁。本研究发现, 单一Cd胁迫下, 蚕豆根、茎、叶中Cd主要分布于细胞壁, 这一结论与唐杰等[33]的研究结果一致。而在MWCNTs-COOH与Cd复合污染的情况下, 蚕豆各器官亚细胞Cd分配随MWCNTs- COOH浓度的变化而变化。MWCNTs-COOH浓度在0~3.0 mg·L-1范围内, 蚕豆根部Cd分配表现为F1>F2, 浓度为6.0 mg·L-1、12.0 mg·L-1时, Cd分配表现为F1 MWCNTs-COOH与Cd复合胁迫影响了Cd在蚕豆体内的富集与转移, 复合胁迫下蚕豆根茎叶中Cd含量显著高于单一Cd胁迫, Cd富集系数和转移系数也显著高于单一Cd胁迫。不同浓度的MWCNTs-COOH对蚕豆营养器官Cd富集、转移及细胞分布的影响不同, 中低浓度MWCNTs-COOH可促进Cd在蚕豆根茎叶的积累与转移, 高浓度MWCNTs-COOH则抑制Cd积累与转移。结果表明: 中低浓度MWCNTs-COOH可促进植物对环境中Cd的吸收, 加强植物地上部分对Cd的富集; 高浓度MWCNTs-COOH对植物根部损害较大, 通过损害细胞功能抑制了植物对Cd的富集和转运。 [1] 邹鹏, 黄德欢. 碳纳米管的应用进展[J]. 科学, 2014, 66(6): 30–32 ZOU P, HUANG D H. Application progress of carbon nanotubes[J]. Science, 2014, 66(6): 30–32 [2] 文海若, 邵安良, 陈亮, 等. 适合纳米材料遗传毒性评价方法的选择[J]. 癌变·畸变·突变, 2018, 30(4): 326–331 WEN H R, SHAO A L, CHEN L, et al. The selection of genetic toxicity evaluation method is suitable for nanometer materials[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2018, 30(4): 326–331 [3] 董萌, 赵运林, 周小梅, 等. 土壤镉污染现状与重金属修复方法研究[J]. 绿色科技, 2012, (4): 212–215 DONG M, ZHAO Y L, ZHOU X M, et al. Current situation of soil cd pollution and research progress of heavy metal repairing[J]. Journal of Green Science and Technology, 2012, (4): 212–215 [4] 杨树深, 孙衍芹, 郑鑫, 等. 重金属污染农田安全利用: 进展与展望[J]. 中国生态农业学报, 2018, 26(10): 1555–1572 YANG S S, SUN Y Q, ZHENG X, et al. Safe utilization of farmland contaminated with heavy metals in China: Progress and outlook[J]. Chinese Journal of Eco-Agriculture, 2018, 26(10): 1555–1572 [5] 李烨, 孙约兵, 徐应明, 等. 镉污染区水稻土磷素含量特征及其形态分布规律[J]. 环境化学, 2017, 36(3): 542–548 LI Y, SUN Y B, XU Y M, et al. Characteristics and speciation distribution of phosphorus in Cd contaminated paddy soil[J]. Environmental Chemistry, 2017, 36(3): 542–548 [6] 郄明丽, 李志慧, 张伟伟, 等. 羧基化多壁碳纳米管对雌性小鼠卵泡发育的影响[J]. 生态毒理学报, 2018, 13(6): 369–374 QIE M L, LI Z H, ZHANG W W, et al. Effects of MWCNTs- COOH on follicular development in female mice[J]. Asian Journal of Ecotoxicology, 2018, 13(6): 369–374 [7] 董霞, 宋丽萍, 冷希岗. 羟基化多壁碳纳米管对RAW264.7细胞增殖及功能影响研究[J]. 生物医学工程与临床, 2012, 16(5): 415–419 DONG X, SONG L P, LENG X G. Impact of hydroxyl multi-walled carbon nanotubes on viability and function of RAW264.7 cells[J]. Biomedical Engineering and Clinical Medicine, 2012, 16(5): 415–419 [8] 杨思楠, 刘玲, 郑刘根. 多壁碳纳米管与镉复合污染对水稻生长的影响[J]. 环境化学, 2019, 38(5): 1113–1118 YANG S N, LIU L, ZHENG L G. Effects of multiple wall carbon nanotubes and cadmium on rice growth[J]. Environmental Chemistry, 2019, 38(5): 1113–1118 [9] 周金鹏, 张方方, 黄红英, 等. 多壁碳纳米管职业接触致工人氧化损伤及炎症反应水平研究[J]. 职业卫生与应急救援, 2019, 37(3): 213–217 ZHOU J P, ZHANG F F, HUANG H Y, et al. Oxidative stress and inflammatory response levels of workers occupationally exposed to multiple wall carbon nanotubes[J]. Occupational Health and Emergency Rescue, 2019, 37(3): 213–217 [10] 王应军, 李娜, 罗潇宇, 等. 多壁碳纳米管对铜绿微囊藻生长及生理特征的影响[J]. 生态毒理学报, 2018, 13(6): 316–325 WANG Y J, LI N, LUO X Y, et al. Effects of multi-walled carbon nanotubes on the growth and physiology of[J]. Asian Journal of Ecotoxicology, 2018, 13(6): 316–325 [11] 罗潇宇, 任垠安, 高浩杰, 等. 2种类型多壁碳纳米管对蛋白核小球藻的毒理研究[J]. 生态毒理学报, 2018, 13(6): 333–341 LUO X Y, REN Y A, GAO H J, et al. The toxicology effects of two types of multi-walled carbon nanotubes on the physiology of[J]. Asian Journal of Ecotoxicology, 2018, 13(6): 333–341 [12] 王萌, 陈世宝, 李娜, 等. 纳米材料在污染土壤修复及污水净化中应用前景探讨[J]. 中国生态农业学报, 2010, 18(2): 434–439 WANG M, CHEN S B, LI N, et al. A review on the development and application of Nano-scale amendment in remediating polluted soils and waters[J]. Chinese Journal of Eco-Agriculture, 2010, 18(2): 434–439 [13] 姚欢, 魏永鹏, 尹双, 等. 碳纳米材料与共存污染物的联合毒性[J]. 中国科学: 化学, 2018, 48(5): 491–503 YAO H, WEI Y P, YIN S, et al. Joint toxicity of carbon nanomaterials and coexisting pollutants[J]. Scientia Sinica Chimica, 2018, 48(5): 491–503 [14] WANG C R, LIU H T, CHEN J Y, et al. Carboxylated multi-walled carbon nanotubes aggravated biochemical and subcellular damages in leaves of broad bean (L.) seedlings under combined stress of lead and cadmium[J]. Journal of Hazardous Materials, 2014, 274: 404–412 [15] YADAV T, MUNGRAY A A, MUNGRAY A K. Effect of multiwalled carbon nanotubes on UASB microbial consortium[J]. Environmental Science and Pollution Research, 2016, 23(5): 4063–4072 [16] WU Y, WANG Y J, LI Y W, et al. Effects of single-walled carbon nanotubes on growth and physiological characteristics of[J]. Journal of Central South University, 2018, 25(7): 1628–1641 [17] 李冬香, 陈清西. 锌在再力花体内的富集性及亚细胞分布和化学形态研究[J]. 中国生态农业学报, 2013, 21(9): 1114–1118 LI D X, CHEN Q X. Determinating zinc accumulation, sub-cellular distribution and chemical forms ofFraser[J]. Chinese Journal of Eco-Agriculture, 2013, 21(9): 1114–1118 [18] 舒启豪, 孔艳艳, 罗坤, 等. 干旱与Cd双重胁迫对土壤-小麦-蚜虫系统Cd转移规律影响的研究[J]. 中国生态农业学报(中英文), 2019, 27(11): 1656–1662 SHU Q H, KONG Y Y, LUO K, et al. Cadmium transfer in the ecosystem of soil-wheat-aphid under dual stress of cadmium and drought[J]. Chinese Journal of Eco-Agriculture, 2019, 27(11): 1656–1662 [19] 卢垟杰, 刘淑慧, 郭建忠, 等. 盐碱胁迫对紫花苜蓿和草木樨发芽及出苗的影响[J]. 种子, 2017, 36(8): 83–87 LU Y J, LIU S H, GUO J Z, et al. Effect of salt and alkaline stress on the seed germination and emergence ofLinn andLedeb[J]. Seed, 2017, 36(8): 83–87 [20] 周劲松, 闫平, 张伟明, 等. 生物炭对水稻苗期生长、养分吸收及土壤矿质元素含量的影响[J]. 生态学杂志, 2016, 35(11): 2952–2959 ZHOU J S, YAN P, ZHANG W M, et al. Effects of biochar on seedling growth, nutrient absorption of japonica rice and mineral element contents of substrate soil[J]. Chinese Journal of Ecology, 2016, 35(11): 2952–2959 [21] 王伟, 蔡晓东, 李惠华, 等. 湿式消解-石墨炉原子吸收光谱法测定金线莲铅、铜、镉含量[J]. 亚热带植物科学, 2014, 43(4): 298–301 WANG W, CAI X D, LI H H, et al. Determination of Pb, Cu and Cd inwith wet digestion and graphite furnace atomic absorption spectrometry[J]. Subtropical Plant Science, 2014, 43(4): 298–301 [22] 吴彩霞, 张洪荣. 微波消解石墨炉原子吸收光谱法测定植物中的铅[J]. 草业科学, 2010, 27(2): 66–70 WU C X, ZHANG H R. A determination of lead content in plant by microwave-heating and GF-AAS[J]. Pratacultural Science, 2010, 27(2): 66–70 [23] 唐杰, 徐强, 罗成, 等. 灌浆期镉胁迫下水稻Cd在组织细胞中的特征研究[J]. 环境科学与技术, 2017, 40(S1): 49–55 TANG J, XU Q, LUO C, et al. Filling stage of rice under cadmium stress Cd characteristics research in tissue cells[J]. Environmental Science & Technology, 2017, 40(S1): 49–55 [24] 张路, 张锡洲, 李廷轩, 等. Cd胁迫对水稻亲本材料Cd吸收分配的影响[J]. 农业环境科学学报, 2014, 33(12): 2288–2295 ZHANG L, ZHANG X Z, LI T X, et al. Effects of Cadmium stress on uptake and distribution of cadmium in different rice varieties[J]. Journal of Agro-Environment Science, 2014, 33(12): 2288–2295 [25] DE VOOGT P. Reviews of Environmental Contamination and Toxicology[M]. Amsterdam: Springer International Publishing,2017: 73–137 [26] NISHIZONO H, ICHIKAWA H, SUZIKI S, et al. The role of the root cell wall in the heavy metal tolerance of[J]. Plant and Soil, 1987, 101(1): 15–20 [27] AHMAD P, NABI G, ASHRAF M. Cadmium-induced oxidative damage in mustard [(L.) Czern. & Coss.] plants can be alleviated by salicylic acid[J]. South African Journal of Botany, 2011, 77(1): 36–44 [28] 周建, 张毅川, 齐安国, 等. 镉胁迫对刺槐幼苗的生长、镉离子富集及其细胞分布的影响[J]. 河南科技学院学报: 自然科学版, 2018, 46(1): 1–7 ZHOU J, ZHANG Y C, QI A G, et al. Effects of cadmium stress on growth, ions accumulation and cellular distribution inseedlings[J]. Journal of Henan Institute of Science and Technology: Natural Science Edition, 2018, 46(1): 1–7 [29] 邓祥元, 胡小丽, 成婕, 等. 纳米二氧化铈对蛋白核小球藻生物学效应研究[J]. 生态毒理学报, 2016, 11(5): 111–116 DENG X Y, HU X L, CHENG J, et al. Effects of nanoparticle CeO2on the physiology of[J]. Asian Journal of Ecotoxicology, 2016, 11(5): 111–116 [30] 张玉秀, 于飞, 张媛雅, 等. 植物对重金属镉的吸收转运和累积机制[J]. 中国生态农业学报, 2008, 16(5): 1317–1321 ZHANG Y X, YU F, ZHANG Y Y, et al. Uptake, translocation and accumulation of cadmium in plant[J]. Chinese Journal of Eco-Agriculture, 2008, 16(5): 1317–1321 [31] 潘智立, 李军. 硫、硅对水稻体内NPT含量及镉亚细胞分布的影响[J]. 土壤通报, 2016, 47(5): 1253–1258 PAN Z L, LI J. The response of non-protein thiols and subcellular distribution of cadmium in rice to the exogenous sulfur and silicon[J]. Chinese Journal of Soil Science, 2016, 47(5): 1253–1258 [32] 方继宇, 贾永霞, 张春梅, 等. 马缨丹对镉的生长响应及其富集、转运和亚细胞分布特点研究[J]. 生态环境学报, 2014, 23(10): 1677–1682FANG J Y, JIA Y X, ZHANG C M, et al. Effects of cadmium on growth response ofL. and its accumulation, translocation and subcellular distribution of Cd[J]. Ecology and Environmental Sciences, 2014, 23(10): 1677–1682 [33] 唐杰, 徐强, 王昌全, 等. Cd胁迫下不同水稻品种组织细胞中Cd的转运分配研究[J]. 生态环境学报, 2016, 25(12): 2014–2020 TANG J, XU Q, WANG C Q, et al. Research of Cd stress on transfer and distribution of Cd in histocyte of different rice varieties[J]. Ecology and Environmental Sciences, 2016, 25(12): 2014–2020 [34] 林道辉, 冀静, 田小利, 等. 纳米材料的环境行为与生物毒性[J]. 科学通报, 2009, 54(23): 3590–3604 LIN D H, JI J, TIAN X L, et al. Environmental behavior and toxicity of engineered nanomaterials[J]. Chinese Science Bulletin, 2009, 54(23): 3590–3604 Cd enrichment and distribution in broad bean seedlings under stress of Cd combined with MWCNTs-COOH* LIU Ling, WANG Suhang, ZHANG Jin, CHEN Cheng, ZHAO Xincheng, LIU Haitao, WANG Chengrun** (School of Biological Engineering, Huainan Normal University, Huainan 232038, China) Nanomaterials are inevitably released into the environment because of developed production and application, which brings potential risks to the ecological environment and human health. The aim of this study was to explore the effect of MWCNTs-COOH and heavy metals Cd double stress on Cd enrichment, transport, and distribution in plant organs, and provide a theoretical basis for evaluating phytotoxicity and ecological risk of the combined pollution of MWCNTs-COOH and Cd. In this study, broad bean seedlings were cultured as experimental material using the hydroponics method, and MWCNTs-COOH (0 mg·L-1, 1.5 mg·L-1, 3.0 mg·L-1, 6.0 mg·L-1, 12.0 mg·L-1) and 10.0 µmol·L-1Cd treatment groups were set. The contents of Cd in roots, stems, leaves, and cells of broad bean seedlings under the different treatments were determined by Graphite Furnace atomic absorption spectrometry; and Cd enrichment, transport in vegetative organs, and distribution in cells of broad bean were analyzed. The results showed that Cd contents in three kinds of vegetative organs under MWCNTs-COOH and Cd compound stresses were higher than those in CK. Cd enrichment in roots, stems, and leaves; Cd enrichment coefficient, and translocation coefficient between organs (root-stem and stem-leaf) all first and then decreased. The above indicators reached their maximum values when the concentration of MWCNTs-COOH was 6.0 mg·L-1. At the same time, with the increase of MWCNTs-COOH concentration, Cd in cells of roots, stems, and leaves gradually transferred from cell wall to protoplast, which deepened the toxicity to cells. In conclusion, medium and low concentrations of MWCNTs-COOH not only promoted Cd accumulation and upward transport in roots, stems, and leaves, but also enhanced Cd transfer in cells. MWCNTs-COOH; Cd; Complex stress; Enrichment coefficient; Translocation coefficient; Broad bean , E-mail: chengrunwang@163.com Nov. 19, 2019; 10.13930/j.cnki.cjea.190815 刘玲, 王苏杭, 张进, 陈成, 赵薪程, 刘海涛, 汪承润. Cd与羧基化多壁碳纳米管复合胁迫下蚕豆幼苗Cd的富集与分布[J].中国生态农业学报(中英文), 2020, 28(5): 756-763 LIU L, WANG S H, ZHANG J, CHEN C, ZHAO X C, LIU H T, WANG C R. Cd enrichment and distribution in broad bean seedlings under stress of Cd combined with MWCNTs-COOH[J]. Chinese Journal of Eco-Agriculture, 2020, 28(5): 756-763 X592 * 安徽省教育厅重点项目(KJ2018A0472)、安徽省重大专项项目(18030701189)和安徽省高校优秀青年人才支持计划(gxyq2019078)资助 汪承润, 主要研究方向为生态毒理学。E-mail: chengrunwang@163.com 刘玲, 主要研究方向为植物生态学及植物逆境生理。E-mail: lliiuu494@sina.com 2019-11-19 2020-02-02 * This study was supported by the Priority Projects of Education Department of Anhui Province (KJ2018A0472), the Major Special Projects of Anhui Province (18030701189) and the Excellent Young Talents Support Program for Colleges and Universities in Anhui Province (gxyq2019078). Feb. 2, 2020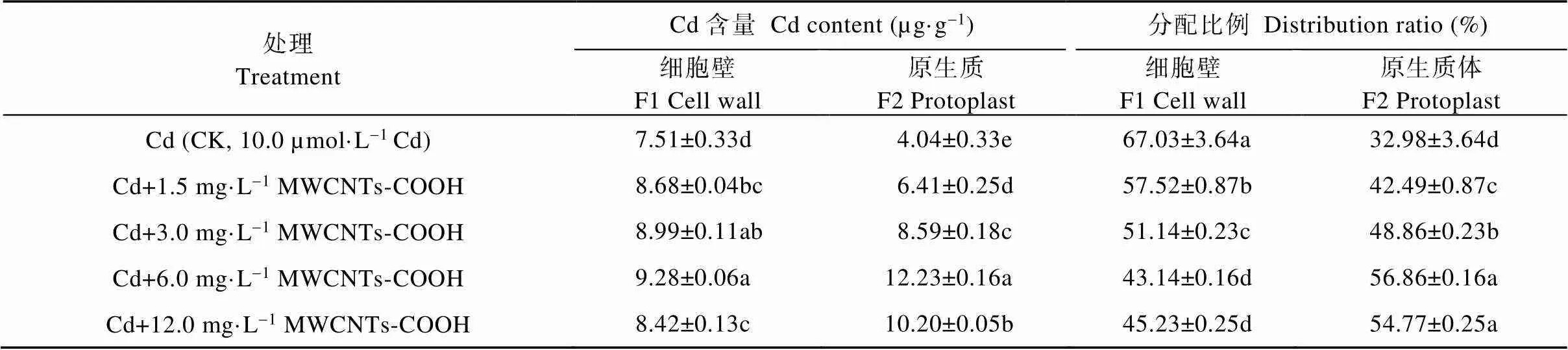
3 讨论
4 结论
