FFA上调AMPK/ Vimentin促进前列腺癌细胞PC-3的增殖、侵袭和迁移
2020-04-30陈柯茹王竞州王翠喆唐慧哈晓丹邓玉春张雪婷李雪冯家乐谢建新张君
陈柯茹,王竞州,王翠喆,唐慧,哈晓丹,邓玉春,张雪婷,李雪,冯家乐,谢建新,张君*
(1石河子大学医学院/新疆地方病与民族高发病教育部重点实验室,新疆 石河子 832002;2石河子大学科研处,新疆 石河子 832002)
前列腺癌(Prostate Cancer,PCa)是最常见的男性泌尿系统恶性肿瘤,居男性恶性肿瘤发病率第二位,致死率第五位[1]。肥胖是PCa发生发展的重要危险因素之一,并且与PCa的恶性程度密切相关。肥胖后,体内过多的游离脂肪酸(Free Fatty Acid,FFA)蓄积与PCa发生密切相关[2],而FFA导致前列腺癌发生的具体机制尚不十分明确。
肥胖引起体内FFA升高引起能量代谢异常,最终导致前列腺癌的发生和发展[3]。作为细胞能量代谢的调节器,磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)能够感受细胞内AMP浓度及AMP/ATP的比值变化,通过一系列复杂而精准的调节机制维持能量代谢平衡[3]。AMPK在不同肿瘤发生发展中发挥不同的作用。
有文献报道,AMPK具有一定的促血管生成和促肿瘤细胞生长的功能,同时,也有研究表明AMPK通过抑制TSC-mTOR信号通路,发挥抑癌的作用[4]。AMPK的活化,能够抑制结肠癌细胞系SW480的增殖、侵袭和迁移[5]。AMPK在前列腺癌的发生发展过程中具有促癌和抑癌的双重作用。
Tennakoon J B等[6]发现,雄激素可以与AMPK-PGC-1α信号级联反应(一种已知的稳态机制)的协同作用,促进前列腺癌细胞的生长。亦有文献表明,新型的AMPK激活剂可通过阻止脂肪生成来抑制前列腺癌细胞的生长[7]。AMPK是否在肥胖条件下导致FFA水平升高,继而在促进前列腺癌发生发展的过程中发挥作用,尚未见文献报道。
本研究通过探讨FFA对人前列腺癌细胞PC-3生物学行为的影响及可能机制,将为阐明肥胖相关前列腺癌发生发展的分子机制,以及临床预防提供新的理论基础。
1 材料与方法
1.1 FFA混合液的配制
用DMSO(Sigma,美国)分别将油酸(OA) (Sigma,美国)和棕榈酸(PA) (Sigma,美国)稀释为0.67 mol/L和0.33 mol/L的母液,4 ℃保存。将油酸(OA)和棕榈酸(PA)按 2∶1制成混合液。用含有1% BSA(中杉金桥,北京)的培养基调配成使用前所需的浓度。
1.2 人前列腺癌细胞PC-3的体外培养及生物学行为的检测
1.2.1 人前列腺癌细胞PC-3的体外培养
人前列腺癌细胞PC-3购自中国科学院上海细胞库。PC-3细胞在10%胎牛血清(Biological Industries,以色列)+F12培养液(Life technologies,美国)+1%青霉素-链霉素(Life technologies,美国)条件下,于37 ℃、5%CO2孵育箱中培养。
1.2.2 游离脂肪酸筛选
采用F12基础培养基重悬PC-3细胞后,将细胞悬液以每孔1.5×104个细胞接种于96孔板,每组设置3个平行孔,将FFA混合液的母液与PC-3培养基按不同比例配制成不同浓度的FFA混合液(0、0.5、1.0、1.5、2.0、4.0 mmol/L)刺激PC-3细胞,于37°培养箱中常规培养24 h,再加入10 μL的CCK8 (北京同仁化学研究所)和100 μL F12基础培养基混合后,移入每个细胞孔中,培养箱孵育3.5 h,在酶标仪(Bio-Rad公司xMarkTM,美国)上读取各孔的OD值,波长为450 nm。实验重复3次。
1.2.3 细胞周期测定
收集各实验组的PC-3细胞,移入预冷的75%乙醇中,4 ℃固定过夜。PBS洗涤2遍,离心5 min,弃上清,尽量吸净。每管样品中加入500 μL PI/RNase Staining Buffer(Life technologies,美国)使其重悬细胞,4°冰箱避光孵育30 min。置于流式细胞仪(Thermo Fisher,美国)进行细胞周期检测。
1.2.4 细胞侵袭实验
采用8 μm孔径的Transwell小室(corning,美国)置于24孔板(corning,美国)上方,将Matrigel基质胶(Solarbio,北京)均匀平铺于Transwell小室的底部,且无气泡,37 ℃培养箱孵育2 h,用无血清F12培养基将各组实验的PC-3细胞(3×104个/室)制成细胞悬液,移至Transwell小室的上室,下室为含10% FBS的F12培养基。常规培养24 h或48 h后取出小室,弃去上室液体,PBS清洗,4%福尔马林 (Solarbio,北京)固定30 min,再次PBS清洗,用吉姆萨(Solarbio公司,北京)染色5 min,PBS清洗,用棉签将上室内部未侵袭的细胞擦去,晾干后置于载玻片上,在倒置显微镜(Axio Observer A1,德国)下随机选取6个视野,使用Image J软件(NIH Bethesda,美国)统计细胞侵袭数目。实验重复3次。
1.2.5 细胞迁移实验
采用8 μm孔径的Transwell小室置于24孔板上,不加Matrigel基质胶,用不含血清的F12培养基将上述各组PC-3细胞(3×104个/室)制成细胞悬液,移至Transwell小室的上室,下室是含10% FBS的F12培养基。常规培养24 h或48 h后取出小室,弃去上室液体,PBS清洗,4%福尔马林 (Solarbio,北京)固定30 min,PBS清洗,用棉签将上室内未侵袭的细胞擦去,PBS清洗,用吉姆萨染色5 min,晾干后置于载玻片上,在倒置显微镜下随机选取6个视野,使用Image J软件(NIH Bethesda,美国)统计细胞迁移数目。实验重复3次。
1.3 AMPK的过表达和干扰
1.3.1 AMPK的过表达
取对数生长期PC-3细胞用无抗生素的培养基重悬后接种于6孔板,置于常规培养箱中培养过夜,细胞密度约为60%~70%时方可进行转染,具体操作参照 Lipofectamine3000(Life technologies,美国)说明书进行,实验分为3组:转染AMPK(pcDNA3.1) (购自中国苏州吉玛因股份有限公司)的细胞为 Ad-AMPK组,转染空载质粒组为阴性对照组,未转染组为空白对照组。将上述各组细胞移至常规培养箱中继续培养,转染后4 h 换液,转染48 h后进行后续实验。
1.3.2 AMPK干扰
取对数生长期PC-3细胞用无抗生素的培养基重悬后接种于6孔板,置于常规培养箱中培养过夜,细胞生长密度约为60%~70%时方可进行转染,具体操作步骤参照 Lipofectamine3000说明书进行,实验分为四组:转染AMPK siRNA(购自中国苏州吉玛因股份有限公司)的细胞为 si-AMPK组,FFA混合液处理的同时转染AMPK siRNA为FFA+ si-AMPK组,转染随机序列组为阴性对照组,未转染组为空白对照组。将上述各组细胞移至常规培养箱中继续培养,转染后4 h 换液,转染48 h后进行后续实验。
1.4 关键基因表达的检测
1.4.1 实时定量PCR
使用TRIZOL(life technologies,美国)试剂裂解细胞提取细胞总RNA。反转录体系每20 μL体系使用RNA 5 μL最终得到cDNA20 μL;反转录仪(Eppendorf AG,Germany)程序设置:42 ℃ 60 min,70 ℃ 15 min。使用qRT-PCR仪(ABI公司7500 Fast,美国)进行检测mRNA表达水平。qRT-PCR程序如下:95 ℃ 4 min,45个循环:95 ℃ 10 s,60 ℃ 30 s,70 ℃ 40 s。AMPK序列为5′-TTGAAACCTGAAAATGTCCTGCT-3′,5′-CAGGGATGAGTTCGGCACTT-3′;Vimentin序列为5′-AGTCCACTGAGTACCGGAGAC-3′,5′-CATTTCACGCATCTG GCGTTC-3′;VEGF序列为5′-GCTTGTCAACTGCGGTTGC-3′,5′-TCCGAGAGATG AGTCAAGAGG-3′;GAPDH序列为5′-GGTGGTCTCCTCTGACTTCAA-3′;干扰片段AMPK-homo-330序列为5′-GAGGAGAGCUAUUUGAUUATT-3′,5′-UAAUCAAAUAGCUCUCCUCTT -3′。
1.4.2 Western blot
使用含1%PMSF(索莱宝科技有限公司,北京)和RIPA(索莱宝科技有限公司,北京)裂解液裂解细胞,提取细胞内总蛋白。蛋白样品和4×loading buffer(Thermo公司,美国)按3∶1混合,100 ℃干预锅处理10 min。10% SDS-PAG进行电泳,将蛋白转到NC膜、用BSA封闭2 h,以β-actin为内参,一抗使用小鼠抗β-actin 36 kDa (中山金桥,中国),AMPK 63 kDa (Abcam)工作浓度均为1∶1000;4 ℃ 冰箱敷育过夜;TBST洗膜,分别使用对应的二抗(中山金桥,中国)工作浓度均为1∶10000室温下培育2 h;TBST洗膜,配制化学发光液,使用ECL化学发光仪(ProteinSimple公司,美国)检测系统进行可视化蛋白质(FluorChem HD2,USA)拍照,Photoshop软件图像处理。
1.5 数据分析
使用SPSS 20.0版软件进行数据统计分析。当数据符合正态分布时,使用两个独立样本t检验评估组间差异。P<0.05被认为具有统计学意义。
2 结果
2.1 高浓度FFA混合液促进PC-3细胞的增殖、侵袭和迁移,同时可上调AMPK,Vimentin和VEGF的表达
运用细胞计数试剂盒CCK8检测不同浓度FFA混合液(0、0.5、1.0、1.5、2.0、4.0 mmol/L)对PC-3细胞的毒性作用,结果提示1.5 mmol/L FFA混合液对PC-3细胞的毒性作用最小,可用于后续实验(图1A)。用1.5 mmol/L FFA混合液处理PC-3细胞48 h后,细胞周期实验结果显示:与对照组相比,FFA混合液干预组处于G0/G1期的PC-3细胞数量显著减少,而处于S期的PC-3细胞数量显著增加(P<0.05)(图1B)。Transwell实验结果显示:1.5 mmol/L FFA混合液处理48 h后,PC-3细胞的侵袭和迁移能力显著高于对照组(P<0.05)(图1C)。1.5 mmol/L FFA处理PC-3细胞48 h后,与对照组相比,FFA混合液处理组的AMPK,Vimentin(侵袭迁移相关基因)和VEGF(血管生长因子)的mRNA表达水平均显著增高(P<0.01)(图1D)。
2.2 FFA混合液干预的同时,下调AMPK后,PC-3细胞的生物学行为被抑制, Vimentin的表达降低
FFA混合液干预的同时下调AMPK,细胞周期实验结果表明:与FFA单纯干预组相比,处于G0/G1期和G2/M期数目显著升高,而处于S期的PC-3细胞数目显著降低 (P<0.05)(图2A)。
Transwell实验结果显示,与FFA单纯干预组相比,PC-3细胞的侵袭和迁移能力显著降低(P<0.01)(图2B)。qRT-PCR结果显示:与FFA单纯干预组相比,PC-3细胞中Vimentin的表达显著降低(P<0.01)(图2C)。
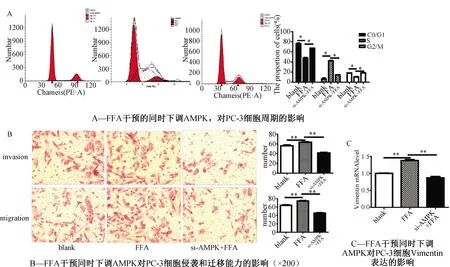
注:t检验,*表示P<0.05,**表示P<0.01图2 FFA干预的同时下调AMPK,对PC-3细胞的生物学行为及Vimentin表达的影响
2.3 AMPK可通过调控Vimentin的表达,促进PC-3细胞的增殖、侵袭和迁移
转染AMPK质粒48 h后,与对照组相比,PC-3细胞内AMPK的 mRNA和蛋白表达水平均显著增高,提示上调AMPK模型构建成功,可用于后续实验(图3A、图3B)。
细胞周期实验结果显示:过表达AMPK后处于G0/G1期的PC-3细胞数目显著降低,而处于S期的PC-3细胞数目显著增加(P<0.05)(图3C)。Transwell实验结果显示:与对照组相比,PC-3细胞的侵袭和迁移能力均显著增加(P<0.01)(图3D)。qRT-PCR结果显示:过表达AMPK可显著促进PC-3细胞Vimentin的表达,而抑制VEGF的表达(P<0.01)(图3E)。

注:*表示与空白对照组相比P<0.05,**表示P<0.01;与阴性对照组相比,#表示P<0.05,##表示P<0.01;t检验,*表示P<0.05,**表示P<0.01图3 过表达AMPK对PC-3细胞生物学行为及Vimentin和VEGF表达的影响
转染si-AMPK 24 h后,与对照组相比,PC-3细胞内AMPK的mRNA和蛋白表达水平均显著降低(P<0.05),提示下调AMPK模型构建成功,可用于后续实验(图4A、图4B)。细胞周期实验结果表明:与对照组相比,下调AMPK后处于G0/G1期的PC-3细胞数目显著增加,而处于S期和G2/M期的PC-3细胞数目显著降低 (P<0.05)(图4C)。
Transwell实验结果显示:与对照组相比,PC-3细胞的侵袭和迁移能力显著降低(P<0.01)(图4D)。qRT-PCR结果提示:下调AMPK后,可显著抑制PC-3细胞Vimentin的表达,而VEGF的表达无差异(图4E)。
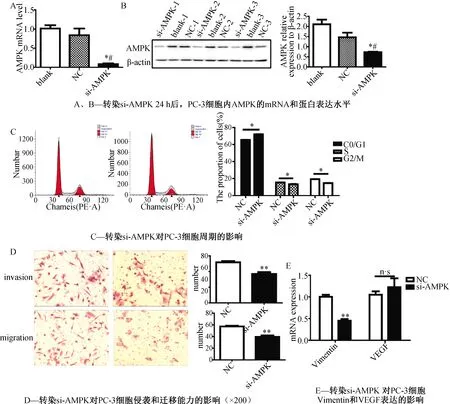
注:t检验,*表示P<0.05,**表示P<0.01图4 下调AMPK对PC-3细胞生物学行为及Vimentin和VEGF表达的影响
3 讨论
肥胖不仅与高血压、心血管疾病、2型糖尿病及其他代谢性疾病的发生密切相关,还与肿瘤的生长、侵袭和转移等过程存在一定的相关性,是多种肿瘤预后不良的关键因素,而肥胖如何导致肿瘤的发生与进展目前尚不十分明确。
肥胖导致体内FFA含量升高是造成多种肥胖相关肿瘤发生发展的关键。越来越多的研究表明,FFA信号在肿瘤发生发展过程中发挥重要作用,脂肪酸的摄入量与癌症的发生密切相关,在乳腺癌患者血清中总FFA的水平显著高于正常个体。体外实验结果表明,FFA可以促进乳腺癌、胰腺癌细胞增殖并能增加其侵袭力[8-9]。以上研究结果提示:肥胖后脂代谢紊乱导致了血浆FFA水平的增加,FFA作为一种信号分子,可能通过参与肿瘤发生发展相关的信号转导过程,导致肿瘤的发生和发展,此过程的具体作用机制目前尚不十分明确,有待进一步研究。而有关FFA与前列腺癌发生发展的关系,亦成为近年来相关领域研究的热点。有文献报道,油酸通过G蛋白偶联受体FFA1 /GPR40促进前列腺癌的恶性表型[2]。此外,二十二碳六烯酸能够抑制前列腺癌的发生[10]。以上文献提示,不同脂肪酸在前列腺癌的发生发展过程中的作用并不一致,并且其作用的具体分子机制目前尚不十分明确。目前已知,人体内主要包含37种FFA,其中含量最高的为油酸和棕榈酸。本研究将油酸和棕榈酸按2∶1比例配成FFA混合液,处理体外培养的人前列腺癌细胞PC-3,实验结果表明,FFA混合液处理显著增加了PC-3细胞的增殖、迁移和侵袭能力。提示FFA混合液可促进前列腺癌的发生和发展,但其具体的分子机制有待进一步明确。
AMPK是调节能量代谢的关键分子,与肿瘤的发生发展密切相关,但在不同肿瘤中发挥不同作用,具有抗肿瘤和促肿瘤的双重作用。已有文献报道,AMPK的激活可以抑制胰腺癌细胞的生长[11]。但是,Eung K等[12]发现溶血磷脂酸(LPA)能够激活AMPK,促进卵巢癌的转移。在肿瘤缺氧微环境中,激活AMPK可上调缺氧诱导因子1和VEGF的表达,促进肿瘤局部侵袭和淋巴结转移[13]。在胰腺癌中,抑制AMPK相关蛋白激酶5(ARK5)可降低Vimentin的表达及上皮-间质转化效率,进而提高了吉西他滨对胰腺癌的敏感性[14]。在前列腺癌中,AMPK同样发挥促癌和抑癌的双重作用。已有文献报道,AICAR通过AMPK/mTOR依赖性途径诱导前列腺癌细胞的凋亡并抑制其迁移和侵袭[15]。相反,Jennakoon J等发现雄激素可以配合AMPK-PGC-1α信号级联反应来促进前列腺癌细胞的生长[6]。本研究结果表明:FFA混合液可促进PC-3细胞的AMPK、Vimentin及VEGF表达,提示FFA可能通过促进上述因子的表达增强了PC-3细胞的增殖、侵袭和迁移能力。
为了进一步明确AMPK、Vimentin及VEGF在FFA促进PC-3细胞生物学行为中的相互关系,本研究在用FFA混合液处理PC-3细胞的同时,下调AMPK的表达后发现,FFA混合液对PC-3细胞生物学行为的促进作用,以及对Vimentin的上调作用均被逆转。以上结果提示:高水平的FFA可通过上调AMPK以及Vimentin的表达促进前列腺癌的发生发展。此外,本研究在PC-3细胞中分别上/下调AMPK后发现:AMPK可通过促进Vimentin的表达增强PC-3细胞的增殖、侵袭和迁移能力。而VEGF的表达则与已有文献不一致,呈现出与AMPK表达负相关的趋势,结合上述FFA促进VEGF的实验结果,提示FFA上调AMPK促进前列腺癌生物学行为可能不是通过VEGF来实现,可能存在其它的分子机制,有待后续研究加以证实。
综上所述,本研究在体外培养PC-3细胞的基础上,发现高浓度的FFA混合液可通过上调AMPK、Vimentin的表达,促进肿瘤细胞增殖、侵袭和迁移能力。上述机制的阐明,将为明确肥胖相关前列腺癌发生发展的机制提供新的理论依据,同时为肿瘤的临床治疗提供可能的靶点。
