半夏泻心汤联合IL-12转染骨髓间充质干细胞对胃癌荷瘤裸鼠抑瘤作用研究
2020-04-29崔国宁刘喜平陈嘉慧崔树婷谭霞
崔国宁 刘喜平 陈嘉慧 崔树婷 谭霞

摘要:目的 觀察半夏泻心汤联合IL-12转染骨髓间充质干细胞(BMSCs)对胃癌荷瘤裸鼠的抑瘤作用。方法 取培养第3代的BMSCs,采用LV5空载慢病毒及LV5 IL-12过表达慢病毒转染BMSCs细胞,分别于转染48、72 h后,倒置荧光显微镜观察,经嘌呤霉素筛选稳定转染BMSCs,RT-qPCR检测BMSCs中IL-12的表达。Balb/C裸鼠腋窝皮下接种人胃癌BCG-823细胞建立胃癌荷瘤裸鼠模型,实验分为成瘤组、空载组、转染组、药物组、联合组。空载组、转染组和联合组经尾静脉注射0.2 mL含1×107/mL转染慢病毒的BMSCs悬液,药物组和联合组给予半夏泻心汤27.43 g/kg灌胃,每次0.5 mL,成瘤组给予等量生理盐水灌胃,隔日测量并计算瘤体体积,连续干预13 d,取瘤体组织,计算抑瘤率。结果 倒置荧光显微镜下稳定转染病毒的BMSCs呈不规则形、星形,蜂窝状绿色荧光分布,经RT-qPCR验证,转染BMSCs的IL-12 mRNA表达升高,与正常BMSCs、空载BMSCs比较差异有统计学意义(P<0.05);与成瘤组、空载组比较,转染组、药物组及联合组瘤体积及瘤质量增加较小(P<0.05);与转染组、药物组比较,联合组瘤体积及瘤质量增加最小(P<0.05);与空载组比较,转染组、药物组及联合组抑瘤率明显升高(P<0.05);与转染组、药物组比较,联合组抑瘤率明显升高(P<0.05)。结论 半夏泻心汤及IL-12转染的BMSCs对胃癌荷瘤裸鼠均有一定的抑瘤作用,二者联合具有协同增效作用。
关键词:半夏泻心汤;骨髓间充质干细胞;白细胞介素-12;裸鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2020)01-0039-06
DOI:10.3969/j.issn.1005-5304.201906381
Study on Antitumor Effects of Banxia Xiexin Decoction Combined with IL-12 Transfected BMSCs on Nude Mice with Gastric Cancer
CUI Guoning, LIU Xiping, CHEN Jiahui, CUI Shuting, TAN Xia
Gansu University of Chinese Medicine, Lanzhou 730000, China
Abstract: Objective To observe the antitumor effects of Banxia Xiexin Decoction combined with IL-12 transfected BMSCs on nude mice with gastric cancer. Methods BMSCs of the third generation were cultured and transfected by LV5 no-load lentiviruses and IL-12 overexpression lentiviruses into BMSCs. The expression of IL-12 in BMSCs was detected by RT-qPCR after transfected 48 hours and 72 hours through inverted fluorescence microscopy. A nude mouse model of gastric cancer was established by subcutaneous inoculation of human gastric cancer BCG-823 cells into the axilla of Balb/C nude mice. The model was divided into tumorigenic group, no-load group, transfection BMSCs, medicine group and combination group. No-load BMSCs, transfection group and combination group were injected 0.2 mL BMSCs suspension containing 1×107/mL lentivirus via tail vein respectively. The medicine group and combination group were given Banxia Xiexin Decoction for gavage (27.43 g/kg, 0.5 mL each time). The tumorigenic group was given the same dose of saline for gavage. Tumor volume of each group was measured and calculated every other day. After 13 days of continuous intervention, tumor tissue was taken to calculate the antitumor rate. Results BMSCs stably transfected with the virus showed irregular, star-shaped and honeycomb-like green fluorescence distribution under inverted fluorescence microscopy. The expression of IL-12
mRNA in the transfection BMSCs was increased by RT-qPCR, and there was statistical significance between the normal BMSCs and no-load BMSCs (P<0.05). Compared with tumorigenic group and no-load group, the tumor mass and tumor weight of the transfection group, the medicine group and the combination group increased little (P<0.05); Compared with the transfection group and the medicine group, the tumor mass and tumor weight of the combination group were the least (P<0.05); Compared with the no-load group, the antitumor rates of the transfection group, the medicine group and the combination group significantly increased (P<0.05). Compared with the transfection group and the medicine group, the antitumor rate of the combination group significantly increased (P<0.05). Conclusion Banxia Xiexin Decoction combined with BMSCs transfected with IL-12 have certain anti-tumor effects on nude mice with gastric cancer, and their combination has a significant synergistic effect.
Keywords: Banxia Xiexin Decoction; BMSCs; IL-12; nude mice
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是起源于中胚层的一种多能干细胞,具有肿瘤趋向特性,是肿瘤靶向治疗首选种子细胞[1]。IL-12是一种免疫刺激性细胞因子,被认为是细胞免疫应答反应中的初始因子,能激活T淋巴细胞、NK细胞,破坏肿瘤细胞的免疫逃逸,具有很强的抗肿瘤作用[2]。转染是真核细胞主动或被动导入外源的DNA片段,从而获得新表型的过程。已有研究表明,通过转染将IL-12导入BMSCs,使其过表达IL-12,对卵巢癌、结肠癌有显著抑瘤作用[3-4]。半夏泻心汤是临床防治胃癌的常用方剂,临床疗效确切[5]。有研究表明,半夏泻心汤可抑制人胃癌细胞增殖、诱导人胃癌细胞凋亡[6-10]。然而,过表达IL-12的BMSCs对胃癌是否有抑瘤作用,半夏泻心汤对其抑瘤作用是否具有协同增效作用迄今尚未见报道。本研究以半夏泻心汤对胃癌荷瘤裸鼠进行灌胃,同时将IL-12转染的BMSCs经胃癌荷瘤裸鼠尾静脉注射进行联合干预,探讨半夏泻心汤联合IL-12转染BMSCs对胃癌荷瘤裸鼠抑瘤作用是否具有协同作用,以期为中西医结合防治胃癌提供可借鉴的思路。
1 实验材料
1.1 动物及细胞株
60只SPF级Balb/C裸鼠,体质量15~20 g,4~8周龄,雄雌不限,北京华阜康生物科技股份有限公司提供,动物许可证号SCXK(京)2014-0004,饲养于重庆威斯腾生物科技有限公司SPF级实验室,温度23~25 ℃,相对湿度50%±10%,12 h/12 h昼夜交替。BGC-823人胃癌细胞,上海中国科学院细胞库提供。裸鼠BMSCs,重庆威斯腾生物公司提供,由本实验室传代培养并保存备用。
1.2 药物及制备
半夏泻心汤(半夏、干姜、黄芩、红参各15 g,炙甘草10 g,黄连6 g,大枣20 g),饮片购于甘肃中医药大学附属医院中药房,经甘肃中医药大学药学院景明教授鉴定符合国家药典规定。饮片按原方比例混合[11],浸泡30 min,煎煮2次,第1次加8倍水,煎煮1 h后取煎液,第2次加6倍水,煎煮30 min后合并煎液,离心,过滤,浓缩,给药量按70 kg成人与裸鼠体表面积换算等效剂量为2.31 g原药材/mL[12]。
1.3 主要試剂及仪器
LV5空载慢病毒、IL-12过表达慢病毒(威斯腾生物提供,滴度为3×108、5×108 TU/mL),嘌呤霉素(美国Sigma公司,批号P8833),sybrgreen Ⅰ(美国Thermo公司,批号A25741),DMEM-F12培养基(美国Thermo公司,批号C11330500BT),胎牛血清(美国Thermo公司,批号10099-141),胰蛋白酶(上海碧云天生物技术有限公司,批号C0201),青霉素-链霉素溶液(上海碧云天生物技术有限公司,批号C0222),DMSO(美国Amresco公司,批号V900090),Trizol(美国Takara,批号9109),荧光定量PCR试剂(美国Takara,批号RR820)。二氧化碳培养箱(日本三洋公司),迷你型超速离心机(德国Eppendorf公司),电子分析天平(瑞士Precisa12A),倒置荧光显微镜、照像系统(日本Olympus公司),实时荧光定量PCR仪(德国Eppendorf公司),0.22、0.45 μm混合纤维素滤膜(美国Millipore公司),切片机、展片机、烤片机(德国Leica公司)。
2 实验方法
2.1 LV5空载慢病毒及LV5-IL-12过表达慢病毒转染骨髓间充质干细胞
取对数生长期BMSCs,PBS清洗,胰蛋白酶(0.25%EDTA)消化细胞3 min,收集细胞15 mL置于离心管,离心5 min重悬细胞,培养板加入细胞悬液,使每孔细胞约为5×105个,置于细胞培养箱培养。当铺板时细胞融合率约为50%,每孔培养基体积为100 μL,融合度约为70%时,细胞生长状态较好。取出病毒,4 ℃冰箱保存,离心20 s,PBS清洗2次,取出离心后的病毒和细胞,使用移液器吸取准确体积病毒液加入准备好的培养基,吸去原细胞培养瓶中培养基,在目的细胞中加感染复数(MOI值)为50的LV5空载慢病毒及LV5-IL-12过表达慢病毒病毒液200 μL,同时每孔按8 μg/mL加入适量的聚凝胺,混匀,置于37 ℃、5%CO2培养箱孵育过夜。8 h后更换完全培养基培养,分别于转染48、72 h后,用倒置荧光显微镜观察绿色荧光蛋白的表达,若阳性则黄绿色比较明亮,并估算慢病毒转染BMSCs的效率。
2.2 嘌呤霉素筛选LV5空载慢病毒及LV5-IL-12过表达慢病毒稳定转染的骨髓间充质干细胞
取对数生长期BMSCs,用新鲜无抗无血清培养基制成1.5×105个/mL细胞悬液。96孔培养板中每孔加细胞悬液100 μL,再向每孔加适量新鲜无抗无血清的培养基,混匀后置于37 ℃、5%CO2培养箱静置过夜。用嘌呤霉素浓度分别为0、2、4、6、8、10 μg/mL新鲜无抗无血清培养基溶液替换各孔中旧的培养基。筛选细胞:24孔板中以5×104~8×104个/孔的密度铺板,孵育过夜;剔除旧的培养基,加MOI值为50的病毒颗粒,加入聚凝胺使其终浓度为8 μg/mL,病毒转导后6~8 h,再加1 mL完全培养基,孵育过夜;病毒转导后48 h,使用嘌呤霉素筛选培养基替换旧的完全培养基,孵育;待抗性细胞长满以后,细胞转入25 cm2培养瓶,收获细胞。
2.3 RT-qPCR验证骨髓间充质干细胞的IL-12过表达
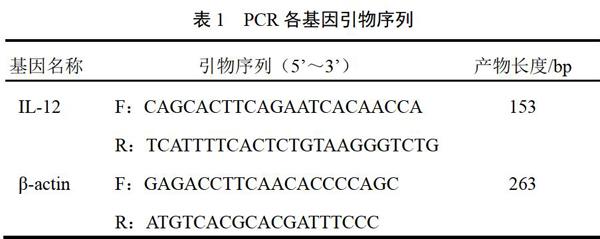
分别取贴壁生长的正常BMSCs、LV5空载慢病毒转染BMSCs、LV5-IL-12过表达慢病毒转染BMSCs,每10 cm2加入Trizol试剂1 mL,直至细胞全部溶化。将上述匀浆液室温放置5 min。每1 mL Trizol试剂用量的匀浆液中加入0.2 mL氯仿,盖紧管盖,震摇15 s,室温静置2~3 min,4 ℃、10 000 r/min离心10 min。吸取上层水相置于新试管中,加等体积预冷的异丙醇,盖紧管盖,轻轻摇匀。室温静置10 min,4 ℃、10 000 r/min离心10 min,弃除上清液,每管加入75%乙醇1 mL润洗,4 ℃、7500 r/min离心5 min。打开管盖,沉淀干燥,将RNA沉淀溶于无RNase水中,测定RNA浓度后进行反转录。反应条件:25 ℃、10 min,42 ℃、50 min,85 ℃、5 min。扩增条件:94 ℃、4 min,94 ℃、20 s,60 ℃、30 s,72 ℃、30 s,35个循环,72 ℃检测信号。基因引物序列见表1。分析目的基因的相对表达量,结果以Ct值表示,Ct值表示每个反应管内荧光信号到达设定阈值时所经历的循环数,Ct值越大,表达量越低。ΔΔCt值=处理组(目的基因Ct值-内参基因Ct值)-未处理组(目的基因Ct值-内参基因Ct值),用2-ΔΔCt表示基因相对表达量[13]。
2.4 造模、分组及干预
实验裸鼠55只,自由摄食饮水,常规饲养1周后,将对数生长期的人胃癌BCG-823细胞制成浓度为1×107/mL细胞悬液,于每只裸鼠腋窝皮下接种150 μL。直到裸鼠肿瘤生长直径约0.5~1 cm3,再从55只裸鼠中选取肿瘤大小比较一致的50只,随机分为5组。成瘤组给予生理盐水0.5 mL/只灌胃;空载组裸鼠尾静脉注射0.2 mL/只空载慢病毒转染的BMSCs细胞悬液(1×107/mL);转染组裸鼠尾静脉注射0.2 mL/只LV5-IL-12过表达慢病毒转染的BMSCs细胞悬液(1×107/mL);药物组给予裸鼠0.5 mL/只(每次0.6 g/20 g)半夏泻心汤灌胃,1次/d;联合组在尾静脉注射0.2 mL/只LV5-IL-12过表达慢病毒转染BMSCs细胞悬液的同时,给予半夏泻心汤0.5 mL/只(每次0.6 g/20 g)灌胃,1次/d。連续干预13 d。实验过程中隔日计算荷瘤裸鼠肿瘤体积变化。肿瘤体积(V)=长径×短径2/2。实验结束后,腹腔注射3.5%水合氯醛(1 mL/100 g)麻醉,取瘤体组织,剔除纤维包膜,称重,计算抑瘤率。抑瘤率(%)=(模型组平均瘤重-干预组平均瘤重)÷模型组平均瘤重×100%。
3 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以±s表示,两组间比较采用两独立样本t检验,多组间比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 荧光显微镜观察LV5-IL-12过表达慢病毒转染骨髓间充质干细胞结果
MOI值为50转染的细胞,细胞转染48 h后,普通光镜自然光下细胞形态规则,生长良好。荧光显微镜下LV5空载慢病毒转染的BMSCs和LV5-IL-12过表达慢病毒转染的BMSCs绿色荧光强度增强,呈不规则形、星形,蜂窝状聚集分布。72 h后细胞融合现象明显,绿色荧光强度达到最高,转染率达90%。结果见图1、图2。
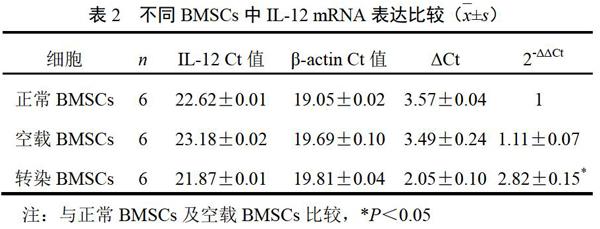
4.2 LV5-IL-12过表达慢病毒转染骨髓间充质干细胞IL-12 mRNA表达结果
经慢病毒转染后,IL-12 mRNA稳定表达于BMSCs中,IL-12 mRNA表达较正常BMSCs和空载慢病毒转染BMSCs明显升高,差异均有统计学意义(P<0.05),而正常BMSC和空载慢病毒转染BMSCs IL-12 mRNA表达变化不明显,差异无统计学意义(P>0.05)。结果见表2。
4.3 半夏泻心汤联合白细胞介素-12转染骨髓间充质干细胞对裸鼠肿瘤体积、瘤质量及抑瘤率的影响
各组裸鼠接种人胃癌BCG-823细胞2 d内,裸鼠体表外观无明显变化,饮食活动基本正常。第3日裸鼠腋下出现瘤块,并逐渐增大,5~7 d裸鼠腋下肿块无明显变化,第9日后裸鼠腋下瘤块明显增大。第13日各组裸鼠饮食及活动明显减少,裸鼠腋下肿瘤体积增大均较显著。与成瘤组及空载组比较,转染组、药物组及联合组裸鼠腋下肿瘤体积及质量增加较小,差异有统计学意義(P<0.05);与转染组、药物组比较,联合组裸鼠腋下肿瘤体积及质量增加最小,差异均有统计学意义(P<0.05);与成瘤组及空载组比较,转染组、药物组及联合组平均抑瘤率分别为36.9%、42.3%、60.5%,差异有统计学意义(P<0.05)。结果见表3、表4。
5 讨论
BMSCs良好的迁移性、肿瘤趋向性[14]、易于分离扩增和易于导入外源基因的特点,使其成为肿瘤生物治疗的首选载体。利用BMSCs作为胃癌生物治疗的载体,追踪并运送肿瘤靶向药物到恶性肿瘤内部,或将基因修饰的BMSCs作为基因治疗的靶向载体以增强其抗肿瘤效应[15-16],是胃癌治疗的全新思路与探索,可能为胃癌的治疗带来希望。有研究表明,BMSCs可靶向迁移到胃癌组织,促进胃癌细胞的增殖[17],而基因修饰后的BMSCs对肿瘤具有靶向治疗作用,如转染解聚素-金属蛋白酶17-shRNA的BMSCs具有靶向归巢至裸鼠乳腺癌移植瘤并发挥抑瘤作用[18],经慢病毒介导的IL-24基因转染BMSCs后,能显著抑制肺癌细胞A549的增殖,促进凋亡[19]。IL-12是一种细胞刺激因子,可刺进T细胞和NK细胞活化[20],T细胞是一类抗恶性肿瘤的特异性效应T细胞,可通过特异性识别,分泌多种细胞因子、趋化因子杀伤肿瘤细胞,而NK细胞活化对肿瘤具有直接杀伤作用[21]。体内研究表明,IL-12可抑制原发肿瘤的生长及转移灶的发生,具有很好的抗肿瘤作用[22-23]。研究发现,慢病毒介导IL-12过表达BMSCs后,通过腹腔注射移植治疗可延长肿瘤腹水模型小鼠的存活率,对恶性腹水肿瘤小鼠具有保护作用[24]。
胃癌属中医学“噎嗝”“癥瘕”等范畴,多由饮食不节、寒温不适,损伤脾胃,使痰浊阻滞中焦,郁久化毒,致痰毒内盛,阻碍气机而成。据此我们提出健脾补虚、化痰散结、清解癌毒是防治胃癌的关键治法,半夏泻心汤是体现该治法的代表方剂。半夏泻心汤源于《伤寒杂病论》,方中半夏、干姜辛开以化痰散结,黄连、黄芩苦降以清解癌毒,人参、大枣、甘草健脾补虚。诸药配伍,共奏健脾补虚、化痰散结、清解癌毒之功,与胃癌的中医病机相对应。半夏泻心汤治疗胃癌等消化道肿瘤,临床疗效确切[25]。我们早期研究发现,半夏泻心汤可降低大鼠胃黏膜肠化增生或异型增生的发生,阻断或逆转胃癌前病变[26],抑制人胃癌细胞增殖,诱导人胃癌细胞凋亡,保护胃癌微环境对腹膜间皮细胞的损伤[27-29],抑制人胃癌腹膜高转移潜能细胞的生长增殖及侵袭转移[30]。
本实验所用半夏为生品,其始载于《神农本草经》,列下品,原书云“多毒,不可久服”。由于其含有毒性成分,所以生半夏的临床应用较少。通过炮制可减轻其毒性作用,但炮制品中肌苷、鸟苷、腺苷、琥珀酸、盐酸麻黄碱含量明显下降[31]。半夏泻心汤中含有半夏、干姜与人参,基础研究发现生半夏粉与干姜、人参配伍后对小鼠孕体及胎儿无明显毒性[32];临床研究表明,炮制半夏多用于轻证、初病,而重症痼疾则力有未逮,名医李可用生半夏45 g治疗中风先兆或急性期,疗效肯定[33];张成铭[34]研究表明,15~45 g生半夏治疗恶性肿瘤16例均取得一定疗效而无不良反应。可见,通过恰当的配伍、准确的辨证及可行的用法可改善生半夏的毒副作用,但是,对于半夏泻心汤中生半夏的拓展应用,仍需要基础研究对其原方的毒副作用机制作进一步探讨。其次,人参为五加科植物人参的干燥根和根茎,红参为人参蒸制后的干燥根和根茎,其性偏热,具有火大、劲足、功效强的特点,补虚作用强于人参。研究表明,人参中多糖及皂苷具有抗肿瘤作用[35],通过比较不同生长年限和不同部位人参与红参中总多糖的含量发现,不同产地、不同年限人参与红参中总多糖含量差别不大,但红参中可溶性多糖含量明显高于人参[36];高效液相色谱法测定红参中含有多种人参皂苷[37],其中,Rg3通过抑制胃癌SGC7901细胞中Wnt/β联蛋白通路激活从而抑制细胞的侵袭、迁移及血管生成拟态的形成[38]。
本研究选择LV5慢病毒质粒为载体,能表达绿色荧光蛋白,并将BMSCs作为载体细胞被慢病毒转染。在荧光显微镜下空载BMSCs和IL-12过表达,均可显示绿色荧光,说明2种BMSCs成功被慢病毒转染,构建了空载病毒和IL-12过表达慢病毒体系。采用RT-qPCR法检测BMSCs中IL-12基因表达,结果显示,经慢病毒介导IL-12基因转染BMSCs后,BMSCs中IL-12基因表达明显升高,证实成功构建了IL-12过表达的BMSCs。通过胃癌荷瘤裸鼠尾静脉注射被IL-12过表达的BMSCs,与成瘤组、空载组比较,胃癌荷瘤裸鼠肿瘤体积明显减小,瘤质量明显减轻,抑瘤率达36.9%,同时发现半夏泻心汤对胃癌荷瘤裸鼠肿瘤也有显著的抑瘤作用。半夏泻心汤与IL-12过表达慢病毒转染BMSCs联合过表达慢病毒对胃癌荷瘤裸鼠肿瘤平均抑制率达60.5%,明显高于转染组和药物组。因此,半夏泻心汤及IL-12过表达慢病毒转染的BMSCs对胃癌荷瘤裸鼠均有一定的抑瘤作用,二者联合具有显著的协同增效作用。本研究为中药复方联合基因转染BMSCs治疗胃癌提供了新的策略与思路,为临床应用提供了依据。
参考文献:
[1] ENGLISH K, MAHON B P, WOOD K J. Mesenchymal stromal cells:role in tissue repair, drug discovery and immune modulation[J]. Curr Drug Deliv,2014,11(5):561-571.
[2] HERNANDEZ-ALCOCEBA R, POUTOU J, BALLESTEROS-BRIONES M C, et al. Gene therapy approaches against cancer using in vivo and ex vivo gene transfer of interleukin-12[J]. Immunotherapy,2016,8(2):179-198.
[3] 張霞,都治香,王娜,等.白细胞介素12基因修饰骨髓间充质干细胞对卵巢癌细胞生长的影响[J].中国组织工程研究,2017,21(9):1346-1351.
[4] 何杨,林晨,高琴,等.慢病毒介导人白细胞介素12转染鼠骨髓间充质干细胞可抑制CT26瘤体的生长[J].中国组织工程研究,2018,22(25):3944-3949.
[5] 花宝金,王芳,侯炜.半夏泻心汤化裁治疗消化系统肿瘤54例[J].中国中医药信息杂志,2006,13(2):74-76.
[6] 刘喜平,李沛清,席时燕,等.半夏泻心方配伍与诱导BGC-823细胞凋亡关系的血清药理学研究[J].中医杂志,2006,47(2):134-137.
[7] 李沛清,刘喜平,席时燕.半夏泻心方及其配伍药组含药血清对人胃癌BGC-823细胞生长抑制作用及p53表达的影响[J].中药药理与临床, 2005,21(5):7-9.
[8] 席时燕,刘喜平,李沛清.半夏泻心方及其配伍药组含药血清对人胃癌BGC-823细胞增殖及bcl-2表达的影响[J].中国中医药信息杂志,2006, 13(4):20-22.
[9] 汪永锋,刘喜平,徐晓艳.半夏泻心方配伍药组含药血清对人胃癌细胞凋亡及凋亡相关基因的影响[J].中国中医药信息杂志,2006,13(5):27-29.
[10] 王萍,李娟,刘喜平,等.半夏泻心方及配伍药组含药血清抑制人胃癌BGC-823细胞增殖的实验研究[J].甘肃中医学院学报,2005,22(5):14-17.
[11] 邓中甲.方剂学[M].北京:中国中医药出版社,2003:88.
[12] 刘喜平,崔国宁,董俊刚,等.参苓白术散与痛泻要方对溃疡性结肠炎大鼠内源性间充质干细胞动员的比较研究[J].中国中医药信息杂志, 2018,25(11):41-45.
[13] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2ΔΔCt method[J]. Methods,2001,25(4):402-408.
[14] 单连慧,李海存,安新颖,等.基于文献计量学的中国干细胞治疗临床应用现状研究[J].中华细胞与干细胞杂志(电子版),2016,6(1):47-51.
[15] CAMMAROTA F, LAUKKANEN M O. Mesenchymal stem/stromal cells in stromal evolution and cancer progression[J]. Stem Cells Int, 2016,2016:4824573.
[16] CHEN T, YANG K, YU J, et al. Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients[J]. Cell Res,2012,22(1):248-258.
[17] 陈超,李海涛.骨髓间充质干细胞移植对胃癌模型大鼠肿瘤细胞的影响[J].中国组织工程研究,2016,20(41):6158-6163.
[18] 贾文婷,蔡准,张雪鹏,等.ADAM17-shRNA转染的骨髓间充质干细胞对裸鼠乳腺癌移植瘤生长的影响[J].中国肿瘤生物治疗杂志,2017, 24(10):1088-1092.
[19] 祁秋干,周清華,李印,等.人骨髓间充质干细胞表达外源性IL-24基因对肺癌细胞A549增殖的影响[J].中国现代医学杂志,2014,24(9):11-16.
[20] ITO S E, SHIROTA H, KASAHARA Y, et al. IL-4 blockade alters the tumor microenvironment and augments the response to cancer immunotherapy in a mouse model[J]. Cancer Immunol Immunother, 2017,66(11):1485-1496.
[21] WANG Z, TILL B, GAO Q. Chemotherapeutic agent-mediated elimination of myeloid-derived suppressor cells[J]. Oncoimmunology, 2017,6(7):e1331807.
[22] TUGUES S, BURKHARD S H, OHS I, et al. New insights into IL-12-mediated tumor suppression[J]. Cell Death Differ,2015, 22(2):237-246.
[23] YUE T, ZHENG X, DOU Y, et al. Interleukin 12 shows a better curative effect on lung cancer than paclitaxel and cisplatin doublet chemotherapy[J]. BMC Cancer,2016,16(1):665.
[24] WANG A, ZHOU X, ZHAO J, et al. Therapeutic effects of bone marrow mesenchymal stem cells expressing interleukin-12 in mice bearing malignant ascites tumor[J]. Int J Clin Exp Med,2015,8(9):15840- 15845.
[25] 刘瑞,花宝金.运用气机升降理论治疗肿瘤探析[J].中国中西医结合杂志,2015,35(1):104-106.
[26] 张艳,汪永锋,刘喜平,等.半夏泻心方及其拆方配伍药组对实验性大鼠胃癌前病变胃黏膜组织病理学影响[J].甘肃中医,2007,20(6):69-71.
[27] 崔国宁,刘喜平,李沛清,等.半夏泻心汤含药血清对胃癌微环境诱导人腹膜间皮细胞氧化应激反应的影响[J].时珍国医国药,2017,28(1):12-14.
[28] 王璟,刘喜平,李沛清,等.半夏泻心汤含药血清对胃癌微环境诱导腹膜间皮HMrSV5细胞损伤的保护作用[J].时珍国医国药,2015,26(11):2566-2568.
[29] 张炜,刘喜平,明海霞,等.半夏泻心汤含药血清对胃癌微环境诱导腹膜间皮HMrSV5细胞凋亡的影响[J].中华中医药杂志,2016,31(9):3735- 3738.
[30] 刘喜平,李沛清,明海霞,等.半夏泻心汤含药血清对胃癌腹膜转移细胞系GC9811-P增殖及侵袭转移的影响[J].中国中西医结合杂志,2016, 36(10):1224-1228.
[31] 杨冰月,李敏,敬勇,等.半夏及其炮制品化学成分及功效的差异研究[J].中草药,2018,49(18):4349-4355.
[32] 徐建亚,张衎,谢辉辉,等.生半夏及干姜人参半夏丸对小鼠生殖相关毒性的影响[J].中华中医药杂志,2017,32(7):3154-3157.
[33] 陈旸,朱宏,曹军平,等.毒性中药生半夏在急重症中的应用及病案举隅[J].中华灾害救援医学,2017,5(10):594-596.
[34] 张成铭.大剂量生半夏治疗恶性肿瘤16例[J].辽宁中医药大学学报, 2007,9(6):108-109.
[35] 罗林明,石雅宁,姜懿纳,等.人参抗肿瘤作用的有效成分及其机制研究进展[J].中草药,2017,48(3):582-596.
[36] 齐滨,刘莉,赵大庆,等.人参、西洋参和红参中糖类含量的比较研究[J].中国药房,2013,24(7):616-618.
[37] 王敏,赵振霞,刘永利,等.红参中5种人参皂苷含量的超高效液相色谱法同时测定[J].时珍国医国药,2019,30(1):56-58.
[38] 李烨婷,唐有为.人参皂苷Rg3体外通过抑制Wnt/β联蛋白通路阻止胃癌SGC7901细胞血管生成拟态的形成[J].中国肿瘤生物治疗杂志, 2019,26(5):518-523.
(收稿日期:2019-06-26)
(修回日期:2019-07-14;编辑:华强)
基金项目:国家自然科学基金(81860813)
通讯作者:刘喜平,E-mail:Lxp-d257@163.com
